名校
解题方法
1 . 根据下列图示所得出的结论正确的是
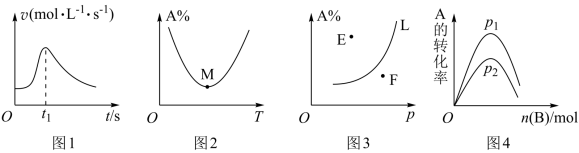

| A.图1是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高 |
| B.图2是A+B⇌C中A的百分含量随温度变化的曲线,说明该反应是放热反应 |
| C.图3是对于反应mA(g)+nB(g)⇌pC(g),当其他条件一定时A的百分含量随压强变化的图象,其中E点v正<v逆 |
| D.图4是对于反应A(g)+B(g)⇌2C(g)达平衡时,在一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
您最近一年使用:0次
2020-12-31更新
|
194次组卷
|
3卷引用:甘肃省天水市一中2021届高三上学期第三学段考试化学试题
10-11高三上·黑龙江双鸭山·阶段练习
名校
解题方法
2 . T ℃ 时,A气体与B气体反应生成C气体。反应过程中A、B、C的浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
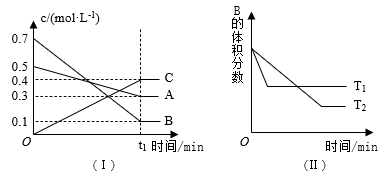

| A.t1 min后,其他条件不变,增大压强,平衡向逆反应方向移动 |
| B.t1 min后,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 |
| C.T ℃ 时,在相同容器中,若通入0.3 mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C进行反应,达到平衡后,C的浓度仍为0.4 mol·L-1 |
| D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
您最近一年使用:0次
2020-12-26更新
|
179次组卷
|
10卷引用:甘肃省天水市第六中学2019-2020学年高二上学期期末考试化学试题(普通班)
甘肃省天水市第六中学2019-2020学年高二上学期期末考试化学试题(普通班)(已下线)2010年黑龙江省双鸭山一中高三上学期期中考试(化学)(已下线)2012-2013学年河北省沧县中学高二10月月考化学试卷2016-2017学年江西省宜春市奉新一中高二上月考一化学试卷夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学反应速率及影响图像分析山西省长治市第二中学校2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题甘肃省民乐县第一中学2021--2022学年高二上学期期中考试化学试题安徽省安庆市怀宁县第二中学2022-2023学年高二上学期期末考试化学试题吉林省BEST合作体八校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
3 . 在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图甲,C的百分含量与温度的关系如图乙。
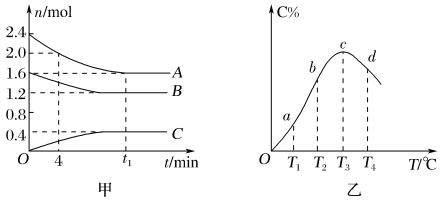
下列分析不正确的是

下列分析不正确的是
| A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1 |
| B.该反应的化学方程式为2A(g)+B(g)⇌C(g) |
| C.由T1向T2变化时,正反应速率大于逆反应速率 |
| D.该反应正反应是放热反应 |
您最近一年使用:0次
2020-05-08更新
|
119次组卷
|
2卷引用:甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题
名校
4 . 密闭容器中进行的可逆反应aA(g)+bB(g)⇌cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
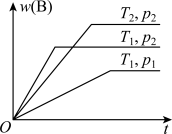

| A.T1<T2,p1<p2,a+b>c,正反应为吸热反应 |
| B.T1>T2,p1<p2,a+b<c,正反应为吸热反应 |
| C.T1<T2,p1>p2,a+b<c,正反应为吸热反应 |
| D.T1>T2,p1>p2,a+b>c,正反应为放热反应 |
您最近一年使用:0次
2020-05-08更新
|
404次组卷
|
25卷引用:甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题
甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题2016-2017学年新疆生产建设兵团二中高二上期中化学卷新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题内蒙古自治区翁牛特旗乌丹第一中学2018-2019学年高二上学期期中考试化学试题新疆自治区昌吉市第九中学2018-2019学年高二上学期第二次月考化学试题四川省宁南中学2018-2019学年高二下学期第一次月考化学试题山东省实验中学2020届高三第一次诊断性考试化学试题云南省玉溪市玉溪一中2019-2020学年高二上学期第一次月考化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》步步为赢 高二化学寒假作业:作业五 化学平衡的图像分析黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题湖北省新高考联考协作体2020-2021学年高二上学期期中考试化学试题贵州省毕节市七星关区毕节市实验高级中学2020-2021学年高二上学期期中考试化学试题重庆市朝阳中学高2020-2021学年高二上学期期中考试化学试题江苏省南京市雨花台中学2020-2021学年高二年级上学期期末调研测试化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题广东省大埔县虎山中学2022-2023学年高三上学期1月期末考试化学试题河北省承德县第一中学2022-2023学年高一下学期期末考试化学试题北京市东直门中学2022-2023学年高二上学期期中考试化学试题北京工业大学附属中学2023-2024学年高二上学期期中考试化学试题四川省达州市宣汉县第二中学2023-2024学年高二上学期中期考试化学试题四川省内江市2025届第三中学高二上学期化学试卷四川省自贡市第二十二中学校2023-2024学年高二上学期期中考试化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
10-11高二上·四川成都·期中
名校
解题方法
5 . 反应A(g) + 3B(g)  2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
 2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的
2C(g);ΔH<0,在不同温度,不同压强(P1>P2)下达到平衡时,混合气体中C的百分含量随温度变化的曲线为下图中的A. | B.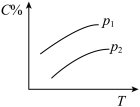 |
C.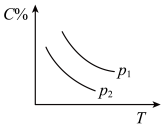 | D.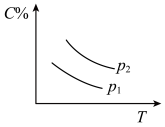 |
您最近一年使用:0次
2020-04-14更新
|
164次组卷
|
21卷引用:甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题
甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题甘肃省天水市天水一中2019-2020学年高二(普通班)上学期第一次月考化学(理)试题甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 (已下线)2010年四川省成都市实验中学高二上学期期中考试化学试卷(已下线)2010年黑龙江大庆实验中学高二上学期期中考试化学试卷(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷(已下线)2014-2015学年辽宁大连市第二十高级中学高二上期中考试化学试题(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷江苏省仪征中学2016-2017学年高二4月月考化学试题湖南省邵东县第十中学2018-2019学年高二上学期期中考试理科班化学试题山东省泰安第四中学2018-2019学年高二上学期12月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二上学期第二次月考化学试题广东省惠来县葵潭中学2019-2020学年高二上学期第二次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题(已下线)上海市松江一中2013届高三上学期期中考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题甘肃省武威第八中学2020-2021学年高二上学期月考化学试题海南省海口市灵山中学2019—2020学年高二上学期期中测试化学试题
10-11高二下·浙江嘉兴·期中
名校
6 . 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)⇌xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
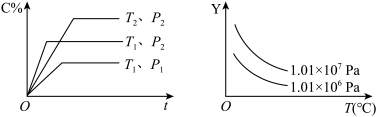

| A.反应物A的百分含量 | B.平衡混合气体中物质B的百分含量 |
| C.平衡混合气体的密度 | D.平衡混合气体的平均摩尔质量 |
您最近一年使用:0次
2019-12-05更新
|
268次组卷
|
16卷引用:2015-2016学年甘肃省甘谷一中高二上期末化学试卷
2015-2016学年甘肃省甘谷一中高二上期末化学试卷(已下线)2010—2011学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2010-2011学年江苏省五校联考高二下学期期末考试化学试题(已下线)2011-2012年江苏宿迁泗洪县洪翔中学高二下学期期中考试化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高二上期中化学卷浙江省温州市求知中学2018-2019学年高二上学期期中考试(选考)化学试题内蒙古自治区固阳县一中2018-2019学年高二上学期期中考试理科综合化学试题云南省普洱市澜沧县第一中学2018-2019学年高二下学期期末考试化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题甘肃省定西市岷县第一中学2019-2020学年高二下学期开学测试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精练)-2021年高考化学一轮复习讲练测安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题吉林省抚松县第六中学2020-2021学年高二下学期摸底考试化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期期中考试化学试题重庆市黔江中学校2022-2023学年高二上学期10月考试化学试卷
名校
7 . 已知某可逆反应:mA(g)+nB(g) xC(g) ΔΗ=Q kJ•mol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJ•mol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
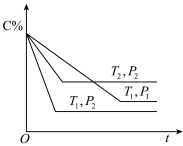
 xC(g) ΔΗ=Q kJ•mol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJ•mol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
| A.T1>T2,P1>P2,m+n>x,Q>0 |
| B.T1<T2,P1<P2,m+n<x,Q>0 |
| C.T1>T2,P1<P2,m+n<x,Q<0 |
| D.T1<T2,P1<P2,m+n>x,Q<0 |
您最近一年使用:0次
11-12高二上·江西赣州·期中
名校
8 . 可逆反应mA(固)+nB(气)⇌pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
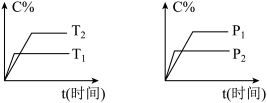

| A.达到平衡后,使用催化剂,C%将增大 |
| B.达到平衡后,若升高温度、化学平衡向逆反应方向移动 |
| C.方程式中n>p+q |
| D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
您最近一年使用:0次
2019-10-05更新
|
1848次组卷
|
39卷引用:甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题
甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 (已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年内蒙古包头三十三中高二上学期期末考试化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高二上学期期末考试化学试卷(已下线)2014-2015学年吉林延边二中高二9月阶段考试化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷2014-2015学年内蒙古巴彦淖尔市一中高二上学期期中化学试卷2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷2015-2016学年浙江台州中学高二上第三次统练化学试卷2016-2017学年河北省定州二中高二上学期第一次月考化学试卷2016-2017学年甘肃省嘉峪关市酒钢三中高二上学期期末考试化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷四川省泸州泸县第五中学2018届高三上学期期末考试理综化学试题吉林省吉林地区普通高中友好学校联合体2017-2018学年高二上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题【校级联考】广东省汕头市达濠华侨中学、东厦中学2018-2019学年高二(理)上学期阶段测试(二)化学试题安徽省六安市二中2018-2019学年高二第一学期10月月考化学试题甘肃省白银市会宁县第一中学2019-2020学年高二上学期期中考试化学(理)试题广东省广州市第八十九中学2019-2020学年高二上学期期中考试化学试题湖南省永州市宁远县第一中学2019-2020学年高二上学期期中考试化学试题福建省莆田四中2019-2020学年高二上学期期中考试化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题云南省曲靖市陆良县第十中学2019-2020学年高二上学期期末考试化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高二上学期期中考试化学试题广西桂林市第十八中学2019-2020学年高二下学期期中考试化学试题湖北省恩施州巴东县第二高级中学2019-2020学年高一下学期网课质量检测化学试题江西省上饶市横峰中学2020-2021学年高二上学期第一次月考化学(统招班)试题吉林省吉化第一高级中学校2020-2021学年高二上学期期末考试化学试题宁夏固原市隆德县2020-2021学年高二上学期期末考试化学试题湖南省湘潭电机子弟中学2019-2020学年高二下学期期中考试化学(理)试题河南省登封市第一高级中学2019-2020学年高二上学期期中考试化学试题广东省汕尾市2021-2022学年高一年级下学期期末考试化学试题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题云南省文山州广南县第二中学校2021-2022学年高二上学期12月考试化学试题广东省江门广雅中学2022-2023学年高二上学期期中考试化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题辽宁省名校联盟2023-2024学年高二上学期期初考试化学试题辽宁省锦州市黑山县名校联盟试2023-2024学年高二上学期开学考试化学试题黑龙江省虎林市高级中学2023-2024学年高二上学期第一次月考化学试题
名校
9 . 在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)  zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
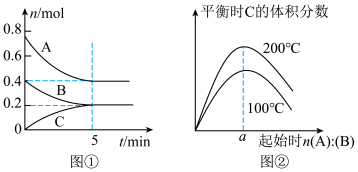
 zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
| A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1 |
B.由图②知反应xA(g)+yB(g)  zC(g)的ΔH>0,且a=2 zC(g)的ΔH>0,且a=2 |
| C.若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D.200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5 |
您最近一年使用:0次
2019-03-05更新
|
931次组卷
|
6卷引用:【全国百强校】甘肃省天水一中2018-2019学年高二下学期寒假作业检测化学试题
【全国百强校】甘肃省天水一中2018-2019学年高二下学期寒假作业检测化学试题河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)难点4 化学反应速率与化学平衡图表分析-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)专题09反应速率、化学平衡-2022年高考真题+模拟题汇编(全国卷)(已下线)专题09反应速率、化学平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题09反应速率、化学平衡-五年(2018~2022)高考真题汇编(全国卷)
名校
10 . 对于可逆反应mA(g)+nB(g) pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
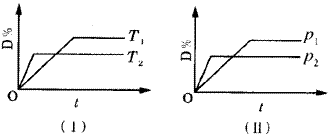
 pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
pC(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m+n>q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
您最近一年使用:0次
2019-01-30更新
|
131次组卷
|
4卷引用:甘肃省秦安县第一中学2021-2022学年高二上学期期中考试化学试题



