名校
1 . 化学反应的方向问题对于理论研究与生产实践都有及其重要的意义,下列有关化学反应方向的判断不正确的是
| A.ΔH<0,ΔS>0的反应在温度低时不能自发进行 |
| B.某吸热反应能自发进行,因此该反应是熵增反应 |
| C.Na与H2O的反应是熵增的放热反应,该反应能自发进行 |
| D.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH<0 |
您最近一年使用:0次
2022-03-23更新
|
383次组卷
|
8卷引用:辽宁省大连市第四十八中学2023-2024学年高二上学期10月月考化学试题
名校
2 . 下列有关热化学方程式说法正确的是
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.已知2C(s)+2O2(g)=2CO2(g) △H=akJ·mol-1,2C(s)+O2(g)=2CO(g) △H=bkJ·mol-1,则a>b |
C.已知Ba2+与SO 结合生成BaSO4时放热,中和反应的中和热△H=-57.3kJ·mol-1,则含1molH2SO4的稀溶液和含1molBa(OH)2的稀溶液反应的反应热△H<-114.6kJ·mol-1 结合生成BaSO4时放热,中和反应的中和热△H=-57.3kJ·mol-1,则含1molH2SO4的稀溶液和含1molBa(OH)2的稀溶液反应的反应热△H<-114.6kJ·mol-1 |
| D.甲烷的燃烧热△H=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 |
您最近一年使用:0次
2022-03-23更新
|
183次组卷
|
2卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期12月月考化学试题
名校
解题方法
3 . 下列说法错误的是
A.一定温度下,反应MgCl2(l) Mg(l)+ Cl2(g)的△H>0,△S>0 Mg(l)+ Cl2(g)的△H>0,△S>0 |
| B.△H<0,△S>0的反应在温度低时不能自发进行 |
| C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| D.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
您最近一年使用:0次
2022-03-22更新
|
534次组卷
|
14卷引用:辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题
辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题山东省日照市莒县2019-2020学年高二上学期期中考试化学试题(已下线)第02章 化学反应速率和化学平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2.4化学反应进行的方向(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学(实验班)试题广东实验中学附属天河学校2020--2021学年高二上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw105黑龙江省大庆市大庆实验中学2020-2021学年高二下学期开学考试化学试题(已下线)2.3 化学反应的方向-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)期中测试卷02-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)陕西省宝鸡市长岭中学2021-2022学年高二上学期期中考试化学试题(已下线)2.3 化学反应的方向-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)内蒙古北京宽高四子王实验学校2021-2022学年高二上学期12月月考化学试题天津市第二南开学校2022-2023学年度高二上学期期中质量调查化学试题
名校
4 . 回答下列问题:
(1)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为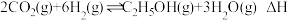 。通过表格中的数值可以推断:该反应的
。通过表格中的数值可以推断:该反应的
___________ (填“>”、“<”或“=”)0;其正反应在___________ (填“高温”、“低温”或“任何温度”)下能自发进行。若达到平衡时,液化分离出 ,反应速率将
,反应速率将___________ (填“增大”、“减小”或“不变”)。
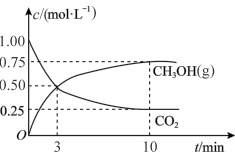
(2)工业上也可以利用 和
和 合成甲醇:
合成甲醇: 。某
。某 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入 和
和 发生反应,测得
发生反应,测得 和
和 浓度随时间变化如上图所示。
浓度随时间变化如上图所示。
① 内,
内, 的平均反应速率为
的平均反应速率为___________ ,该温度下的平衡常数为
___________ 。若达平衡时,保持温度不变,向容器中再充入 、
、 、
、 和
和 各
各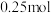 ,则此时
,则此时
___________  (填“>”、“<”或=”)。
(填“>”、“<”或=”)。
②下列说法能说明反应达到化学平衡状态的是___________ (填字母序号)。
A. 的消耗速率与
的消耗速率与 的消耗速率之比为3∶1
的消耗速率之比为3∶1
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D. 和
和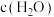 的浓度相等时
的浓度相等时
(1)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为
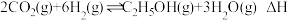 。通过表格中的数值可以推断:该反应的
。通过表格中的数值可以推断:该反应的
 ,反应速率将
,反应速率将温度/ | 400 | 500 |
| 平衡常数K | 9 | 5.3 |

(2)工业上也可以利用
 和
和 合成甲醇:
合成甲醇: 。某
。某 恒温恒容密闭容器中充入
恒温恒容密闭容器中充入 和
和 发生反应,测得
发生反应,测得 和
和 浓度随时间变化如上图所示。
浓度随时间变化如上图所示。①
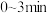 内,
内, 的平均反应速率为
的平均反应速率为
 、
、 、
、 和
和 各
各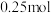 ,则此时
,则此时
 (填“>”、“<”或=”)。
(填“>”、“<”或=”)。②下列说法能说明反应达到化学平衡状态的是
A.
 的消耗速率与
的消耗速率与 的消耗速率之比为3∶1
的消耗速率之比为3∶1B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.
 和
和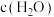 的浓度相等时
的浓度相等时
您最近一年使用:0次
2022-01-27更新
|
203次组卷
|
2卷引用:辽宁省丹东市2021-2022学年高二上学期期末教学质量监测化学试题
解题方法
5 . 《化学反应原理》模块从不同的视角对化学反应进行了探究、分析,以下观点中错误的是
①钢铁船舶的外壳安装若干锌块采用了牺牲阳极法
②难溶电解质溶解,所得的溶液中阴阳离子浓度一定相等
③ 时
时 溶液的
溶液的 等于
等于 时
时 的
的 溶液的
溶液的
④将 加入水中并加热使其转化为
加入水中并加热使其转化为
⑤ 溶液显碱性的原因:
溶液显碱性的原因:
⑥乙烯聚合为聚乙烯的反应是熵减的过程,却能够自发进行,该反应的
①钢铁船舶的外壳安装若干锌块采用了牺牲阳极法
②难溶电解质溶解,所得的溶液中阴阳离子浓度一定相等
③
 时
时 溶液的
溶液的 等于
等于 时
时 的
的 溶液的
溶液的
④将
 加入水中并加热使其转化为
加入水中并加热使其转化为
⑤
 溶液显碱性的原因:
溶液显碱性的原因:
⑥乙烯聚合为聚乙烯的反应是熵减的过程,却能够自发进行,该反应的

| A.①②③ | B.④⑤⑥ | C.②③⑤ | D.①②⑥ |
您最近一年使用:0次
名校
解题方法
6 . 在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙所示),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是。
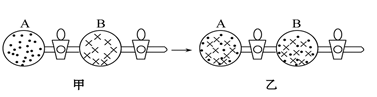

| A.此过程为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程 |
| B.此过程为自发过程,而且没有热量的吸收或放出 |
| C.此过程从有序到无序,混乱度增大 |
| D.此过程是自发可逆的 |
您最近一年使用:0次
2022-01-17更新
|
314次组卷
|
24卷引用:辽宁省联合校2020-2021学年高二上学期第一次月考化学试题
辽宁省联合校2020-2021学年高二上学期第一次月考化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题2014-2015学年湖北省枣阳市高级中学高二下学期期末化学试卷(已下线)同步君 选修4 第2章 第4节 化学反应进行的方向(已下线)2018年9月26日《每日一题》人教选修4-化学反应方向的判断人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题(已下线)2.2.1 化学反应的方向(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第1节 化学反应的方向高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第1节 化学反应的方向新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向(已下线)作业05 化学反应的方向-2021年高二化学暑假作业(人教版2019)选择性必修1(SJ)专题2第二单元课时1 化学反应的方向选择性必修1 专题2 第二单元 课时1 化学反应的方向湖北省部分高中联考协作体2021-2022学年高二上学期期中考试化学试题(已下线)2.3 化学反应的方向(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第05练 化学反应的方向-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)2.2.1 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)山东省德州市2020-2021学年高二上学期反应原理月考(A)化学试题(已下线)2.1 化学反应的方向-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)云南省文山州第一中学2021-2022学年高二下学期3月份考试化学试题2.2.1化学反应的方向 课中高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第四节 化学反应进行的方向 化学反应进行的方向
7 . 通过以下反应均可制备 :
:
①煤炭与水反应制氢: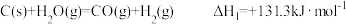
②甲烷与水反应制氢:
③太阳光催化分解水制氢:
下列有关说法正确的是
 :
:①煤炭与水反应制氢:
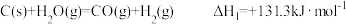
②甲烷与水反应制氢:

③太阳光催化分解水制氢:

下列有关说法正确的是
| A.通过反应①可以将煤转化为清洁燃料 |
B.若反应②使用催化剂,则 减小 减小 |
| C.反应③在低温下可以自发进行 |
D.制备等物质的量的 需要吸收的能量:①<②<③ 需要吸收的能量:①<②<③ |
您最近一年使用:0次
名校
解题方法
8 . 下列热化学方程式正确的是
| A.已知2C(s)+2O2(g)=2CO2(g) ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g) ΔH=bkJ·mol-1,则a<b |
| B.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 |
| C.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| D.甲烷的燃烧热ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 |
您最近一年使用:0次
2022-01-03更新
|
298次组卷
|
13卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题
辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题【校级联考】江西省赣州市南康中学、于都中学2018-2019学年高二上学期第三次月考化学试题江西省赣州市南康区南康中学2020-2021学年高二上学期第三次大考化学试题河北省张家口市宣化第一中学2020-2021学年高二上学期1月月考化学试题广西钦州市第四中学2020-2021学年下学期高二3月月考化学(体艺班)试题(已下线)选择性必修1 综合检测(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)山西省山西师范大学实验学校2021-2022学年高二上学期第二次月考化学试题山西省运城市芮城中学2021-2022学年高二上学期12月月考化学试题天津市武清区杨村第一中学2021-2022学年高二上学期第三次月考化学试题云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)河南省焦作市第十一中学2023-2024学年高二上学期期中考试 化学试题江西省吉安市第三中学2023届高三一模考试化学试题(已下线)选择题6-10
9 . 2019年12月4日“全球碳计划”发布报告说,全球 排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。
排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。
(1)一种途径是用 转化为成为有机物实现碳循环。如:
转化为成为有机物实现碳循环。如:
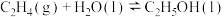
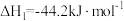

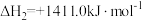 。
。
①已知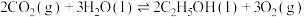 ,其正反应的活化能为
,其正反应的活化能为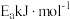 ,则逆反应的活化能为
,则逆反应的活化能为___________  。
。
②工业生产用氯乙烷在碱性条件下水解获得乙醇,反应的离子方程式为 ,已知:
,已知: 为速率方程,研究表明,
为速率方程,研究表明, 浓度减半,反应速率减半,而
浓度减半,反应速率减半,而 浓度减半对反应速率没有影响,则反应速率方程式为
浓度减半对反应速率没有影响,则反应速率方程式为___________ (用含有k的表达式表示)。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
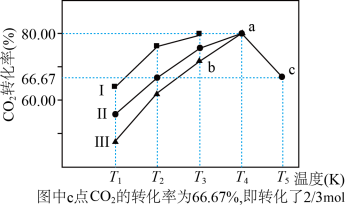
①催化剂效果最佳的反应是___________ (填“曲线I”“曲线II”或“曲线III”)对应的反应。
②b点,v(正)___________ (填“>”,“<”,“=”)v(逆)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________ 。
④c点时该反应的平衡常数K=___________ 。
(3)用钌的配合物作催化剂,一定条件下可直接光催化分解 ,发生反应:
,发生反应:
①该反应的
___________ 0(填“>”“<”“=”),
②
___________ 0(填“>”“<”“=”),③在低温下,该反应___________ 自发进行(填“能”或“不能”)。
 排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。
排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。 的综合利用是解决温室问题的有效途径。
的综合利用是解决温室问题的有效途径。(1)一种途径是用
 转化为成为有机物实现碳循环。如:
转化为成为有机物实现碳循环。如: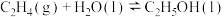
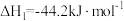

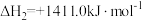 。
。①已知
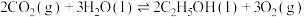 ,其正反应的活化能为
,其正反应的活化能为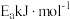 ,则逆反应的活化能为
,则逆反应的活化能为 。
。②工业生产用氯乙烷在碱性条件下水解获得乙醇,反应的离子方程式为
 ,已知:
,已知: 为速率方程,研究表明,
为速率方程,研究表明, 浓度减半,反应速率减半,而
浓度减半,反应速率减半,而 浓度减半对反应速率没有影响,则反应速率方程式为
浓度减半对反应速率没有影响,则反应速率方程式为(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的反应是
②b点,v(正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是
④c点时该反应的平衡常数K=
(3)用钌的配合物作催化剂,一定条件下可直接光催化分解
 ,发生反应:
,发生反应:
①该反应的

②

您最近一年使用:0次
2021-12-05更新
|
204次组卷
|
2卷引用:辽宁省大连市2021-2022学年高二上学期期中考试化学试题
名校
解题方法
10 . 某化学学习小组的同学查阅资料知: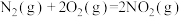
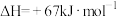 ,他们对上述反应的自发性进行讨论,下列结论合理的是
,他们对上述反应的自发性进行讨论,下列结论合理的是
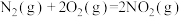
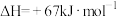 ,他们对上述反应的自发性进行讨论,下列结论合理的是
,他们对上述反应的自发性进行讨论,下列结论合理的是| A.任何温度下都能自发进行 | B.较高温度下能自发进行 |
| C.较低温度下能自发进行 | D.任何温度下都不能自发进行 |
您最近一年使用:0次
2021-11-18更新
|
256次组卷
|
5卷引用:辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题



