1 . 下列不属于自发进行的变化是
| A.红墨水加到清水使整杯水变红 | B.冰在室温下融化成水 |
C.电解熔融态 | D.铁器在潮湿的空气中生锈 |
您最近一年使用:0次
名校
解题方法
2 . 用 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:
①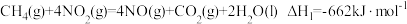
②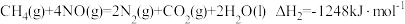
下列说法正确的是
 催化还原
催化还原 ,可以消除氮氧化物的污染。已知:
,可以消除氮氧化物的污染。已知:①
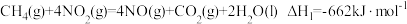
②
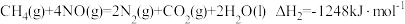
下列说法正确的是
| A.反应②在低温下不能自发进行 |
B.若反应①中消耗 (标准状况下) (标准状况下) ,则放出 ,则放出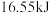 热量 热量 |
C.生成相同物质的量的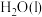 ,反应①②中转移的电子数不相同 ,反应①②中转移的电子数不相同 |
D.若用标准状况下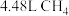 还原 还原 只生成 只生成 和 和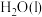 ,则放出的热量为 ,则放出的热量为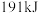 |
您最近一年使用:0次
2022-09-02更新
|
211次组卷
|
5卷引用:辽宁省葫芦岛市协作校2022-2023学年高二上学期第一次月考化学试题
名校
3 . 下列有关反应原理的说法正确的是
A.对于 且能自发进行的化学反应,其 且能自发进行的化学反应,其 |
B.向新制氯水中加适量石灰石不能增大溶液中的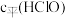 |
C.对于 的可逆反应来说,升高温度可加快反应速率,增大反应物的平衡转化率 的可逆反应来说,升高温度可加快反应速率,增大反应物的平衡转化率 |
| D.反应物分子间的碰撞都能使化学反应发生,碰撞越多,反应速率越高 |
您最近一年使用:0次
2022-09-02更新
|
308次组卷
|
5卷引用:辽宁省渤海大学附属高级中学2022-2023学年高二上学期第一次月考化学试题
4 . 由于化石燃料的大量使用,产生CO2等温室气体随意排放造成的全球变暖,严重地影响到了地球的生态环境和全球气候。因此,研究CO2减排在全球各国具有紧迫而重要的意义。
CaO在自然界存在广泛,作为CO2的吸附剂具有极大的经济优势。
(1)273K时,CaO(s)+CO2(g)=CaCO3(g) △H=﹣178.3kJ·mol﹣1,已知△S=﹣160.45Jmol﹣1·K﹣1,该温度下反应是否能够自发进行?_______ (填“是”或“否”)
(2)实验发现,干燥的二氧化碳和氧化钙几乎不反应,水可以作为该反应的催化剂,利用化学反应方程式解释水的催化机理:_______ 。
CaO在自然界存在广泛,作为CO2的吸附剂具有极大的经济优势。
(1)273K时,CaO(s)+CO2(g)=CaCO3(g) △H=﹣178.3kJ·mol﹣1,已知△S=﹣160.45Jmol﹣1·K﹣1,该温度下反应是否能够自发进行?
(2)实验发现,干燥的二氧化碳和氧化钙几乎不反应,水可以作为该反应的催化剂,利用化学反应方程式解释水的催化机理:
您最近一年使用:0次
名校
5 . 下列叙述不正确的是
| A.混乱度减小的吸热反应一定不能自发进行 |
| B.在温度、压强一定条件下,自发反应总是向△G=△H﹣T△S<0的方向进行 |
| C.碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 |
| D.水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 |
您最近一年使用:0次
2022-09-01更新
|
289次组卷
|
2卷引用:辽宁省沈阳市铁西区重点协作校2021-2022学年高二上学期期中考试化学试题
解题方法
6 . 氮及其化合物与人类生产生活息息相关。
(1)氮气在雷电的作用下,生成氮的氧化物,再经复杂变化形成能供给植物营养的硝酸盐。涉及的部分反应:
I.2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) △H1=-116.1 kJ·mol-1;
II.HNO3(aq)+2NO(g)+H2O(l)=3HNO2(aq) △H2=-75.9 kJ·mol-1;
III.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) △H3;
①△H3=____ kJ·mol-1。
②将两个充有等量NO2的A、B烧瓶,分别放入两个盛有等量的水的烧杯中,待气体颜色稳定后,若向右边的烧杯中加入5.0 g硝酸铵晶体,实验装置如图所示(略去铁架台等),则观察到B烧瓶中气体颜色____ (填“变深”、“不变”或“变浅”),其原因是_______ 。

(2)氮气是生产氮肥的主要原料。
①实验室可用氯化铵与消石灰反应制备少量NH3。
2NH4Cl(s)+Ca(OH)2(s)=CaCl2(s)+2NH3(g)+2H2O(g) △H>0,该反应在____ (填“高温”、“低温”或“任何温度”)下能自发进行,说明理由:____ 。
②已知N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1,工业合成氨通常选择30MPa左右,700K左右,以铁触媒为催化剂,分析工业合成氨时不选用更高的压强或更高的温度的可能原因:
2NH3(g) △H=-92.4 kJ·mol-1,工业合成氨通常选择30MPa左右,700K左右,以铁触媒为催化剂,分析工业合成氨时不选用更高的压强或更高的温度的可能原因:____ 。
(3)CO和NO是汽车尾气中的主要污染物,将它们转化为无害物质是重要的研究课题。
已知:在25℃时,
IV.2NO(g) N2(g)+O2(g) △H4=-180.5 kJ·mol-1 K4
N2(g)+O2(g) △H4=-180.5 kJ·mol-1 K4
V.CO(g)+ O2(g)
O2(g) CO2(g) △H5=-283.0 kJ·mol-1K5
CO2(g) △H5=-283.0 kJ·mol-1K5
①25℃时,反应2NO(g)+2CO(g) N2(g)+2CO2(g)的平衡常数K6=
N2(g)+2CO2(g)的平衡常数K6=____ (填含K4、K5的代数式)。
②在某恒温恒压的条件下,向密闭容器中充入2 mol NO和2 mol CO,仅发生反应2NO(g)+2CO(g) N2(g)+2CO2(g),此时混合气体的总体积为1 L,在t1时刻达到平衡状态,此时NO的转化率为40%,则该条件下的平衡常数K′6=
N2(g)+2CO2(g),此时混合气体的总体积为1 L,在t1时刻达到平衡状态,此时NO的转化率为40%,则该条件下的平衡常数K′6=____ (保留两位有效数字)。
(1)氮气在雷电的作用下,生成氮的氧化物,再经复杂变化形成能供给植物营养的硝酸盐。涉及的部分反应:
I.2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) △H1=-116.1 kJ·mol-1;
II.HNO3(aq)+2NO(g)+H2O(l)=3HNO2(aq) △H2=-75.9 kJ·mol-1;
III.3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) △H3;
①△H3=
②将两个充有等量NO2的A、B烧瓶,分别放入两个盛有等量的水的烧杯中,待气体颜色稳定后,若向右边的烧杯中加入5.0 g硝酸铵晶体,实验装置如图所示(略去铁架台等),则观察到B烧瓶中气体颜色

(2)氮气是生产氮肥的主要原料。
①实验室可用氯化铵与消石灰反应制备少量NH3。
2NH4Cl(s)+Ca(OH)2(s)=CaCl2(s)+2NH3(g)+2H2O(g) △H>0,该反应在
②已知N2(g)+3H2(g)
 2NH3(g) △H=-92.4 kJ·mol-1,工业合成氨通常选择30MPa左右,700K左右,以铁触媒为催化剂,分析工业合成氨时不选用更高的压强或更高的温度的可能原因:
2NH3(g) △H=-92.4 kJ·mol-1,工业合成氨通常选择30MPa左右,700K左右,以铁触媒为催化剂,分析工业合成氨时不选用更高的压强或更高的温度的可能原因:(3)CO和NO是汽车尾气中的主要污染物,将它们转化为无害物质是重要的研究课题。
已知:在25℃时,
IV.2NO(g)
 N2(g)+O2(g) △H4=-180.5 kJ·mol-1 K4
N2(g)+O2(g) △H4=-180.5 kJ·mol-1 K4V.CO(g)+
 O2(g)
O2(g) CO2(g) △H5=-283.0 kJ·mol-1K5
CO2(g) △H5=-283.0 kJ·mol-1K5①25℃时,反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)的平衡常数K6=
N2(g)+2CO2(g)的平衡常数K6=②在某恒温恒压的条件下,向密闭容器中充入2 mol NO和2 mol CO,仅发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g),此时混合气体的总体积为1 L,在t1时刻达到平衡状态,此时NO的转化率为40%,则该条件下的平衡常数K′6=
N2(g)+2CO2(g),此时混合气体的总体积为1 L,在t1时刻达到平衡状态,此时NO的转化率为40%,则该条件下的平衡常数K′6=
您最近一年使用:0次
2022-08-23更新
|
186次组卷
|
3卷引用:辽宁省营口地区2022-2023学年高二上学期开学考试化学试题
名校
解题方法
7 . 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g) +H2O(g)。下图表示该反应进行过程中能量的变化。关于该反应的下列说法中正确的是


| A.ΔH>0, ΔS>0 | B.ΔH>0,ΔS<0 |
| C.ΔH<0, ΔS<0 | D.ΔH<0,ΔS>0 |
您最近一年使用:0次
2022-08-18更新
|
357次组卷
|
22卷引用:辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题
辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题河南省长垣市第十中学2020-2021学年高二上学期第二次月考化学试题湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题河北省石家庄市第一中学2021-2022学年高二上学期开学考试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)山东省烟台市招远市第二中学2021-2022学年高二10月月考化学试题安徽省蚌埠第三中学2021-2022学年高二上学期10月教学质量检测化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题河南省范县第一中学2021-2022学年高二上学期第二次月考检测化学试题贵州省凯里市第一中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高二上学期第一次月考化学试题福建泉州现代中学2021-2022学年高二上学期期中考试化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题湖北省恩施州高中教育联盟2020-2021学年高一下学期期末考试化学试题(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)
8 . 化学反应速率、化学平衡是化学反应的重要原理,下列说法正确的是
A.在恒容恒温条件下,当 达到平衡后,再充入一定量的Ar后,活化分子百分数减少,反应速率减慢 达到平衡后,再充入一定量的Ar后,活化分子百分数减少,反应速率减慢 |
B.25℃时将 的HA溶液加水稀释至 的HA溶液加水稀释至 ,稀释后溶液的体积大于等于原溶液体积的1000倍 ,稀释后溶液的体积大于等于原溶液体积的1000倍 |
C.反应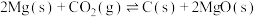  ,则该反应能在高温自发进行 ,则该反应能在高温自发进行 |
D.保持温度不变,向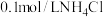 溶液中加入 溶液中加入 固体,容液中 固体,容液中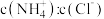 的比值变小 的比值变小 |
您最近一年使用:0次
名校
9 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
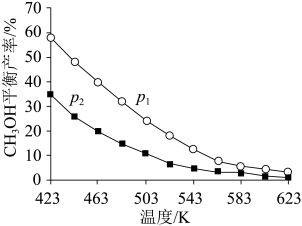
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
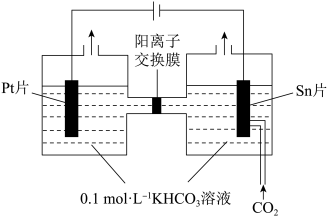
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
109次组卷
|
3卷引用:辽宁省朝阳市建平县2021-2022学年高二下学期期末考试化学试题
名校
解题方法
10 . 下列有关化学反应方向及判据的说法中不正确的是
| A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行 |
| B.NH4HCO3(s) =NH3(g)+H2O(g)+CO2(g) ΔH =+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.焓变和熵变都与反应的自发性有关,但焓变或熵变不可以单独作为反应自发性的判据 |
| D.自发反应就是能较快进行的反应,非自发反应就是无法进行的反应 |
您最近一年使用:0次
2022-07-13更新
|
758次组卷
|
4卷引用:辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题
辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题河南省南阳市2021-2022学年高二下学期期末考试化学试题(已下线)2.3 化学反应的方向-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)山东省潍坊实验中学2022-2023学年高二上学期第一次单元过关检测化学试题



