1 . 国家主席习近平提出了中国应对气候变化的两个目标:二氧化碳排放力争于2030年前达到峰值,于2060年前实现碳中和。杭州亚运会火炬使用的燃料为“零碳甲醇”,是利用焦炉气中的H2与从工业尾气中捕集的二氧化碳反应合成,实现废碳再生、循环内零碳排放。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。___________ 。
①该反应在___________ (填“高温”或“低温”)下能自发进行。
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是___________ 。
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/mol
ⅱ.CO(g)+2H2(g) CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol
ⅲ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为___________ 。
②反应ⅱ的平衡常数Kx=___________ (保留位小数)[对于反应aM(g)+bN(g) cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=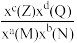 ,x为物质的量分数]。
,x为物质的量分数]。
(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[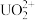 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:___________ 。
②阴极上可能发生副反应: +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=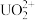 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+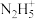 =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是___________ 。
③电还原处理+6价的铀转移1rnole-,阴极区H+减少___________ mol(不考虑副反应)。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。

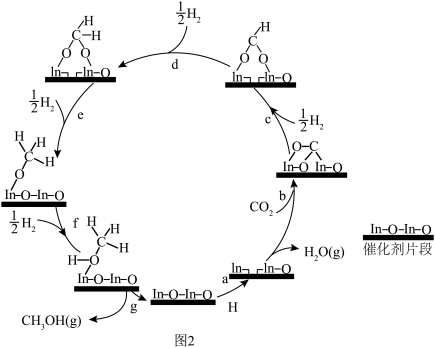
①该反应在
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/molⅱ.CO(g)+2H2(g)
 CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol ⅲ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为
②反应ⅱ的平衡常数Kx=
 cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=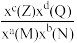 ,x为物质的量分数]。
,x为物质的量分数]。(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[
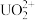 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示: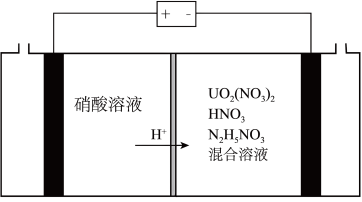
②阴极上可能发生副反应:
 +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=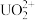 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+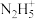 =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是③电还原处理+6价的铀转移1rnole-,阴极区H+减少
您最近一年使用:0次
名校
2 . 氯化硫酰(SO2Cl2)常用作氧化剂,它是一种无色液体,熔点:-54.1℃,沸点:69.1℃,可用干燥的SO2和Cl2在活性炭作催化剂的条件下制取:SO2(g)+Cl2(g)⇌SO2Cl2(l) ΔH=-97.3kJ·mol-1。下列有关SO2Cl2制取的说法正确的是
| A.该反应在高温下能自发进行 |
| B.使用活性炭作催化剂能缩短该反应达平衡的时间 |
| C.化学平衡发生移动,该反应平衡常数必发生变化 |
| D.使SO2Cl2液化从平衡体系中分离,能加快正反应速率,增大Cl2转化率 |
您最近一年使用:0次
名校
3 . 研究碳、氮等元素化合物的性质或转化对体会化学与生活有重要意义。
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g) CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
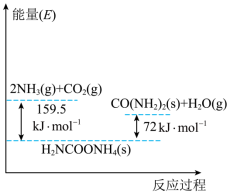
(1)总反应的
______  ,该反应在
,该反应在______ (填“高温”或“低温”或“任何条件都不”)可以自发进行。
(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为______ mol·L-1,浓度均为 0.1mol/L 的 NaNO2和 CH3COONa 的混合溶液中各离子浓度由大到小的关系为__________ 。
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是: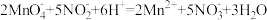 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。
进行滴定操作时无需另加指示剂,达到滴定终点时的现象是_______ ,测得该样品中NaNO2的质量分数为_______ 。(写出计算式)
Ⅰ.以CO2和NH3为原料合成尿素总反应为:CO2 (g)+ 2NH3 (g)
 CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
CO (NH2) (s) + H2O (g) ΔH该反应的具体过程分两步完成,ⅰ.CO2和NH3生成H2NCOONH4;ⅱ.H2NCOONH4分解生成尿素,反应过程能量变化如图。
(1)总反应的
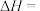
 ,该反应在
,该反应在(2)若该反应在恒容密闭容器中进行,判断该反应达到化学平衡状态的依据是________ (填字母序号)。
| A.反应速率2 v(CO2) = v(NH3) | B.混合气体中 CO2的浓度保持不变 |
| C.混合气体密度不变 | D.消耗2 mol NH3的同时生成 1 mol H2O |
(3)在恒温、体积为1L的恒容装置中通入CO2和NH3各1mol 、1.5mol,达平衡时CO2的转化率为50%,平衡常数的值为
Ⅱ.亚硝酸钠(NaNO2)是肉制品生产中常使用的一种食品添加剂,外观与食盐极为相似,具有较强毒性,误食可能造成死亡。已知常温下 Ka(HNO2)=1.75×10-4,Ka(CH3COOH)=1.8×10-5。
(4)常温下,pH=4的HNO2溶液中,由水电离出的c(H+)约为
(5)高锰酸钾常用于亚硝酸盐的测定。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品a g,加水溶解,配制成100 mL溶液。
②取25.00 mL溶液于锥形瓶中,用0.02000 mol·L-1 KMnO4标准溶液(酸性)进行滴定,反应离子方程式是:
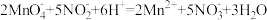 ,滴定结束后消耗KMnO4溶液VmL。
,滴定结束后消耗KMnO4溶液VmL。进行滴定操作时无需另加指示剂,达到滴定终点时的现象是
您最近一年使用:0次
4 . 下列说法正确的是
| A.凡是需要加热才发生的反应都是非自发反应 |
| B.固体溶解一定是熵减小的过程 |
| C.熵增的反应不一定是自发反应 |
D.反应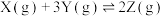  ,降低温度,则平衡向右移动 ,降低温度,则平衡向右移动 |
您最近一年使用:0次
名校
解题方法
5 . 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
(1)已知,该反应ΔS_____ 0(填“<”“>”或“=”)。
(2)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
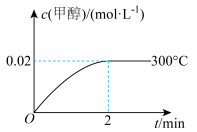
①在0~2min内,以H2表示的平均反应速率为_______ mol·L-1·min-1。
②300℃时该反应的平衡常数K=_______ 。
 CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。(1)已知,该反应ΔS
(2)在300℃,5 MPa条件下,将0.20 mol的CO与0.58 mol H2的混合气体充入2L密闭容器中发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为
②300℃时该反应的平衡常数K=
您最近一年使用:0次
名校
解题方法
6 . 下列推论正确的是
A. 燃烧热为 燃烧热为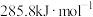 ,则有 ,则有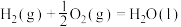 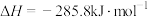 |
B.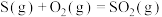  , ,  ;则: ;则: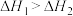 |
C.通常状况下,中和热为57.4kJ/mol,则有: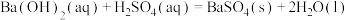 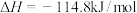 |
D.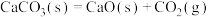 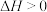 ,则:该反应在高温下能自发进行 ,则:该反应在高温下能自发进行 |
您最近一年使用:0次
名校
解题方法
7 . 通过化学的方法实现 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径,由
减排途径,由 和
和 制备
制备 (二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:
(二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:
a.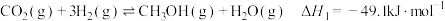
b.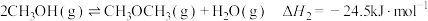
c.
已知: ,如:
,如: 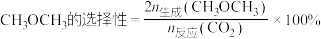 。
。
回答下列问题:
(1)写出 与
与 转化为
转化为 和
和 (反应d)的热化学方程式
(反应d)的热化学方程式______________________ 。
(2)反应a达到平衡时,若缩小体积增大压强,则 变
变____________ (填“大”或“小”)。
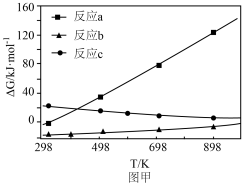
(3)反应a、b、c的吉布斯自由能随温度变化如图甲所示,298K时,能自发进行的反应有___________ ;反应c为熵______________ (填“增”或“减”)反应。
(4)向体积为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 ,若仅考点上述反应,平衡时
,若仅考点上述反应,平衡时 和
和 的选择性及
的选择性及 的转化率随温度的变化如图乙实线所示。
的转化率随温度的变化如图乙实线所示。
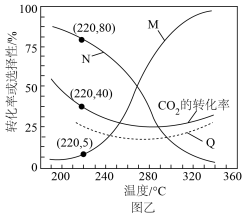
①图中曲线____________ (填“N”或“M”)表示 的选择性。
的选择性。
②平衡时 的转化率随温度的变化
的转化率随温度的变化____________ (填“可能”或“不可能”)如图中虚线Q所示。
③温度高于270℃,随着温度的升高, 的平衡转化率如图所示变化的原因是
的平衡转化率如图所示变化的原因是___________________ 。
④计算反应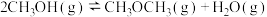 在220℃下的平衡常数为
在220℃下的平衡常数为______________ (结果保留三位有效数字)。
 的资源化利用是一种理想的
的资源化利用是一种理想的 减排途径,由
减排途径,由 和
和 制备
制备 (二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:
(二甲醚,被誉为“21世纪的清洁燃料”)的反应原理如下:a.
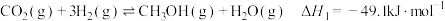
b.
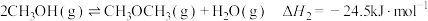
c.

已知:
 ,如:
,如: 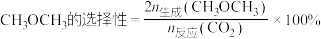 。
。回答下列问题:
(1)写出
 与
与 转化为
转化为 和
和 (反应d)的热化学方程式
(反应d)的热化学方程式(2)反应a达到平衡时,若缩小体积增大压强,则
 变
变(3)反应a、b、c的吉布斯自由能随温度变化如图甲所示,298K时,能自发进行的反应有

(4)向体积为
 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 ,若仅考点上述反应,平衡时
,若仅考点上述反应,平衡时 和
和 的选择性及
的选择性及 的转化率随温度的变化如图乙实线所示。
的转化率随温度的变化如图乙实线所示。
①图中曲线
 的选择性。
的选择性。②平衡时
 的转化率随温度的变化
的转化率随温度的变化③温度高于270℃,随着温度的升高,
 的平衡转化率如图所示变化的原因是
的平衡转化率如图所示变化的原因是④计算反应
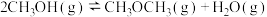 在220℃下的平衡常数为
在220℃下的平衡常数为
您最近一年使用:0次
2023-12-12更新
|
192次组卷
|
2卷引用:重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题
名校
8 . 硫酸工业中利用了反应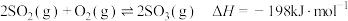 ,下列说法正确的是
,下列说法正确的是
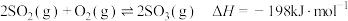 ,下列说法正确的是
,下列说法正确的是A.该反应的 |
B. 催化生成 催化生成 时采用常压,因为高压会使平衡逆向移动 时采用常压,因为高压会使平衡逆向移动 |
| C.加入催化剂可以提高该反应的平衡转化率 |
D.为提高 的平衡转化率,可以适当提高 的平衡转化率,可以适当提高 的浓度 的浓度 |
您最近一年使用:0次
2023-12-12更新
|
147次组卷
|
2卷引用:重庆市育才中学校、西南大学附中、万州中学2023-2024学年高二上学期12月联考化学试题
名校
解题方法
9 . 完成下列问题。
(1)向1L密闭容器中加入2molCO、4mol ,在适当的催化剂作用下,发生如下反应:
,在适当的催化剂作用下,发生如下反应:
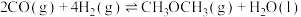
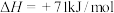
①该反应能否___________ 自发进行(填“能”、“不能”或“无法判断”);
②若容器容积不变,下列措施可增加甲醚( )产率的是
)产率的是___________ 。
A.加入催化剂
B.将 从体系中分离
从体系中分离
C.充入He,使体系总压强增大
D.按原比例再充入CO和
(2)
 在一定条件下,某反应过程中部分数据如下表:
在一定条件下,某反应过程中部分数据如下表:
达到平衡时,该反应的平衡常数K=________ (用分数表示),平衡时 的转化率是
的转化率是_________ 。在其他条件不变的情况下,若30min时向容器中再充入1mol 和1mol
和1mol ,则平衡
,则平衡___________ 移动(填“正向”、“逆向”或“不”)。
(3)利用 干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如图步骤来实现:
干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如图步骤来实现:
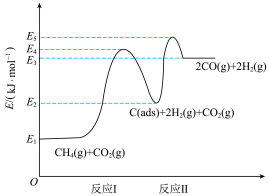
反应I: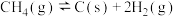
反应II: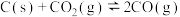
上述反应中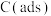 为吸附活性炭,反应历程的能量变化如上图,
为吸附活性炭,反应历程的能量变化如上图,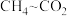 干重整反应的热化学方程式为
干重整反应的热化学方程式为___________ (选用含 、
、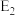 、
、 、
、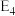 、
、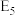 的表达式表示反应热),该反应的决速步骤是
的表达式表示反应热),该反应的决速步骤是___________ (填“反应I”或“反应II”)。
(1)向1L密闭容器中加入2molCO、4mol
 ,在适当的催化剂作用下,发生如下反应:
,在适当的催化剂作用下,发生如下反应: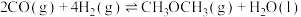
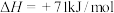
①该反应能否
②若容器容积不变,下列措施可增加甲醚(
 )产率的是
)产率的是A.加入催化剂
B.将
 从体系中分离
从体系中分离C.充入He,使体系总压强增大
D.按原比例再充入CO和

(2)

 在一定条件下,某反应过程中部分数据如下表:
在一定条件下,某反应过程中部分数据如下表:| 反应条件 | 反应时间 |  (mol) (mol) |  (mol) (mol) |  (mol) (mol) |  (mol) (mol) |
恒温恒容( ℃、2L) ℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
 的转化率是
的转化率是 和1mol
和1mol ,则平衡
,则平衡(3)利用
 干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如图步骤来实现:
干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如图步骤来实现:
反应I:
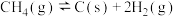
反应II:
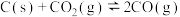
上述反应中
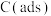 为吸附活性炭,反应历程的能量变化如上图,
为吸附活性炭,反应历程的能量变化如上图,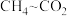 干重整反应的热化学方程式为
干重整反应的热化学方程式为 、
、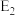 、
、 、
、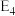 、
、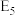 的表达式表示反应热),该反应的决速步骤是
的表达式表示反应热),该反应的决速步骤是
您最近一年使用:0次
2023-11-29更新
|
75次组卷
|
2卷引用: 重庆市杨家坪中学2023-2024学年高二上学期11月月考化学试卷
名校
解题方法
10 . 中华优秀传统文化涉及了很多化学知识,下列有关说法错误的是
| A.《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金。”强水涉及到强电解质 |
| B.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,利用的是盐类的水解 |
| C.刘长卿诗云“水声冰下咽,砂路雪中平”,固态冰转化为液态水为熵增的过程 |
D.《本草图经》记载“盖此矾色绿,味酸,烧之则赤”,因绿矾能电离出 ,所以“味酸” ,所以“味酸” |
您最近一年使用:0次
2023-11-29更新
|
252次组卷
|
2卷引用: 重庆市杨家坪中学2023-2024学年高二上学期11月月考化学试卷



