1 . 天然气经催化重整转化成合成气(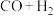 )后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:
)后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:
反应Ⅰ:

反应Ⅱ:

(1)反应Ⅰ可分为如下两步:
 裂解:
裂解: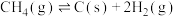
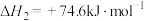
 重整:
重整: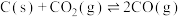
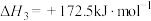
则 =
=______ 。反应Ⅰ能够自发进行的条件是______ ,判断依据是______ 。
(2) ℃时,向4L容器中通入7mol
℃时,向4L容器中通入7mol 、6mol
、6mol ,发生反应Ⅰ、Ⅱ.
,发生反应Ⅰ、Ⅱ. min后达到平衡,体系中
min后达到平衡,体系中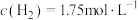 ,
,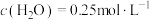 ,压强为
,压强为 。①此温度下,反应Ⅰ的平衡常数
。①此温度下,反应Ⅰ的平衡常数 =
=______ (写出计算式即可,不必化简)[对于气相反应,用某组分B的平衡压强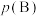 代替物质的量浓度
代替物质的量浓度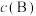 表示的平衡常数,记作
表示的平衡常数,记作 ,如
,如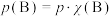 ,
, 为平衡总压强,
为平衡总压强,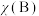 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②请在图中画出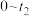 时段
时段 随时间变化曲线并标出
随时间变化曲线并标出 的平衡浓度
的平衡浓度______ 。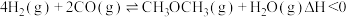
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是______ (填标号)。
A. 、
、 、
、 、
、 的反应速率之比为4:2:1:1
的反应速率之比为4:2:1:1
B. 、
、 、
、 、
、 的物质的量之比为4:2:1:1
的物质的量之比为4:2:1:1
C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②某温度下,将2.0mol 和4.0mol
和4.0mol 充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中
充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是
的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是______ (填标号)。 ,
,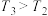 B.
B. ,
,
C. ,
, D.
D. ,
,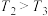
 )后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:
)后再合成其他化工产品,既可减少能源浪费,又能生产高附加值产品。以甲烷、二氧化碳为原料催化重整制合成气,体系中可发生如下两个反应:反应Ⅰ:


反应Ⅱ:


(1)反应Ⅰ可分为如下两步:
 裂解:
裂解: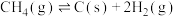
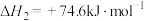
 重整:
重整: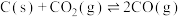
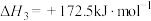
则
 =
=(2)
 ℃时,向4L容器中通入7mol
℃时,向4L容器中通入7mol 、6mol
、6mol ,发生反应Ⅰ、Ⅱ.
,发生反应Ⅰ、Ⅱ. min后达到平衡,体系中
min后达到平衡,体系中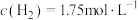 ,
,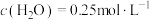 ,压强为
,压强为 。①此温度下,反应Ⅰ的平衡常数
。①此温度下,反应Ⅰ的平衡常数 =
=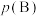 代替物质的量浓度
代替物质的量浓度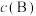 表示的平衡常数,记作
表示的平衡常数,记作 ,如
,如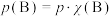 ,
, 为平衡总压强,
为平衡总压强,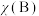 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②请在图中画出
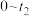 时段
时段 随时间变化曲线并标出
随时间变化曲线并标出 的平衡浓度
的平衡浓度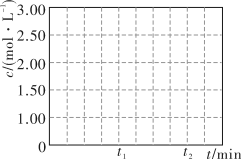
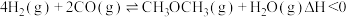
①在恒温恒压条件进行此反应,下列能说明反应已达到平衡的是
A.
 、
、 、
、 、
、 的反应速率之比为4:2:1:1
的反应速率之比为4:2:1:1B.
 、
、 、
、 、
、 的物质的量之比为4:2:1:1
的物质的量之比为4:2:1:1C.混合气体的平均摩尔质量保持不变
D.容器中气体的密度保持不变
②某温度下,将2.0mol
 和4.0mol
和4.0mol 充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中
充入容积为2L的密闭容器中,反应达到平衡时,改变压强和温度,平衡体系中 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是
的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是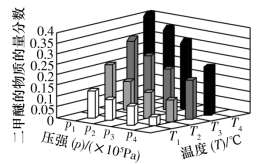
 ,
,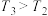 B.
B. ,
,
C.
 ,
, D.
D. ,
,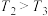
您最近一年使用:0次
名校
解题方法
2 . 环戊二烯(C5H6)是一种重要的有机化工原料。
Ⅰ.环戊二烯容易二聚生成双环戊二烯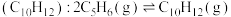 。不同温度下,溶液中环戊二烯的浓度(初始浓度为
。不同温度下,溶液中环戊二烯的浓度(初始浓度为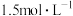 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
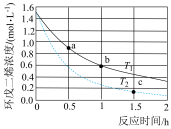
(1)反应开始至b点时,用双环戊二烯表示的平均速率为______  。
。
(2)T1______ T2(填“>”“<”或“=”)。
(3)a点的正反应速率______ b点的逆反应速率(填“>”“<”或“=”)。
Ⅱ.环戊二烯(C5H6)与环戊烯(C5H8)可发生相互转化。有如下反应:
反应ⅰ:
反应ⅱ: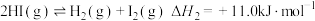
反应ⅲ: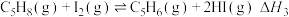
(4)反应i在______ (填“高温”或“低温”)下可自发进行。
(5)反应ⅲ的焓变
______  。
。
(6)某温度时,在1L恒容密闭容器中充入碘和环戊烯各1mol,只发生反应ⅲ,平衡时总压是起始总压的1.25倍。
①平衡时环戊烯的体积分数为______ 。
②该温度下,反应ⅲ的化学平衡常数K=______ 。
③保持温度和体积不变,向平衡体系中再充入1mol环戊二烯和1mol环戊烯,平衡______ 移动(填“向正反应方向”“向逆反应反向”或“不”)。
Ⅰ.环戊二烯容易二聚生成双环戊二烯
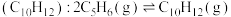 。不同温度下,溶液中环戊二烯的浓度(初始浓度为
。不同温度下,溶液中环戊二烯的浓度(初始浓度为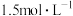 )与反应时间的关系如图所示。
)与反应时间的关系如图所示。
(1)反应开始至b点时,用双环戊二烯表示的平均速率为
 。
。(2)T1
(3)a点的正反应速率
Ⅱ.环戊二烯(C5H6)与环戊烯(C5H8)可发生相互转化。有如下反应:
反应ⅰ:

反应ⅱ:
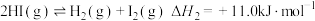
反应ⅲ:
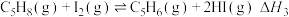
(4)反应i在
(5)反应ⅲ的焓变

 。
。(6)某温度时,在1L恒容密闭容器中充入碘和环戊烯各1mol,只发生反应ⅲ,平衡时总压是起始总压的1.25倍。
①平衡时环戊烯的体积分数为
②该温度下,反应ⅲ的化学平衡常数K=
③保持温度和体积不变,向平衡体系中再充入1mol环戊二烯和1mol环戊烯,平衡
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的是
A.一定条件下反应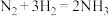 达到平衡时, 达到平衡时,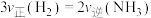 |
B. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的 |
C.室温下, 的 的 溶液与 溶液与 的 的 溶液等体积混合,溶液 溶液等体积混合,溶液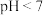 |
D.对于乙酸与乙醇的酯化反应( ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
您最近一年使用:0次
2024-03-10更新
|
177次组卷
|
2卷引用:湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷
4 . 在常温常压下,下列属于自发过程的是
A. |
B.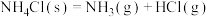 |
C.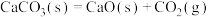 |
D.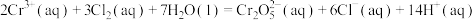 |
您最近一年使用:0次
2024-03-07更新
|
57次组卷
|
2卷引用:湖南省娄底市涟源市2023-2024学年高二上学期1月期末考试化学试题
名校
5 . 下列说法正确的是
| A.增大压强,活化分子百分数增多,化学反应速率增大 |
B.C(石墨,s)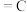 (金刚石,s) (金刚石,s) 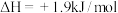 ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
C.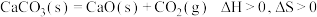 ,不论在何种条件下都不可能自发进行 ,不论在何种条件下都不可能自发进行 |
D.在恒温恒容下,发生反应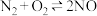 ,若在容器中充入 ,若在容器中充入 ,正、逆反应的速率均不变 ,正、逆反应的速率均不变 |
您最近一年使用:0次
解题方法
6 . 利用甲烷制取氢气等气体是科学家研究的热点课题。
(1)一定条件下, 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
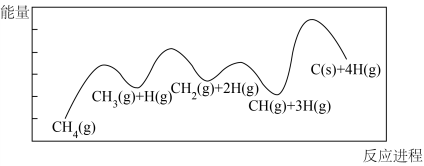
①该历程图表示___________ 步反应,其中正反应活化能最大步骤的反应方程式为___________ 。
② 分解反应
分解反应___________ 。
A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭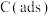 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ: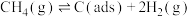 (慢反应)
(慢反应)
反应Ⅱ: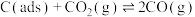 (快反应)
(快反应)
①加入活性炭C(ads)使该反应的活化能___________ (填“升高”“降低”或“不变”)。
② 与
与 制备“合成气”的反应为
制备“合成气”的反应为___________ 反应(填“放热”或“吸热”),其热化学方程式为___________ ( 用
用 表示),能量变化图中:
表示),能量变化图中:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(1)一定条件下,
 分解反应
分解反应 的部分反应历程如下图所示。
的部分反应历程如下图所示。
①该历程图表示
②
 分解反应
分解反应A.高温下能自发进行 B.低温下能自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(2)科学家提出以吸附性活性炭
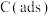 为催化剂,利用
为催化剂,利用 与
与 制备“合成气”(
制备“合成气”( 、
、 )。其反应历程分两步,反应历程的能量变化如下图:
)。其反应历程分两步,反应历程的能量变化如下图:
反应Ⅰ:
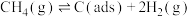 (慢反应)
(慢反应)反应Ⅱ:
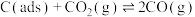 (快反应)
(快反应)①加入活性炭C(ads)使该反应的活化能
②
 与
与 制备“合成气”的反应为
制备“合成气”的反应为 用
用 表示),能量变化图中:
表示),能量变化图中:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
解题方法
7 . 含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由___________ 。
(2)已知2SO2(g)+O2 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
①反应开始到第10分钟,SO3反应速率为________ 。
②该温度下反应的平衡常数为________ 。
③平衡时SO2的转化率为________ 。
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是______ 。
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是______ 。
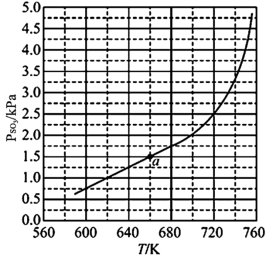
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)_____ kPa,Kp(Ⅰ)随反应温度升高而_____ (填“增大”“减小”或“不变”)。
(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l) ΔH=−11.9kJ·mol-1。判断该反应的自发性并说明理由
(2)已知2SO2(g)+O2
 2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。
2SO3(g) ΔH=−198kJ·mol-1,850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol·L-1、8.0×10-3mol·L-1和4.4×10-2mol·L-1。①反应开始到第10分钟,SO3反应速率为
②该温度下反应的平衡常数为
③平衡时SO2的转化率为
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)
 Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
Fe2O3(s)+SO2(g)+SO3(g) (Ⅰ),平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)
您最近一年使用:0次
8 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
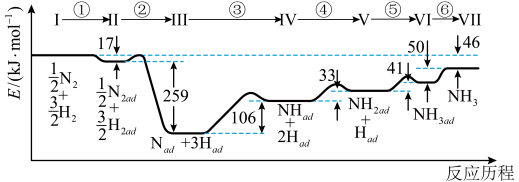
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
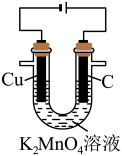
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
144次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
名校
解题方法
9 . 工业上,利用异丙醇制备丙烯。已知:
①
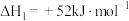
②

③

已知几种共价键键能如下表所示:
下列叙述正确的是
①

②


③


已知几种共价键键能如下表所示:
| 共价键 |  |  |  |  |  |  |
键能/( ) ) | 413 | 347 |  | 799 | 467 | 498 |
| A.反应①和②在任何温度下都能自发进行 |
B.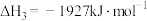 |
C. 的键能为 的键能为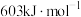 |
| D.在恒温恒容容器进行反应①②③,平衡时总压减小 |
您最近一年使用:0次
名校
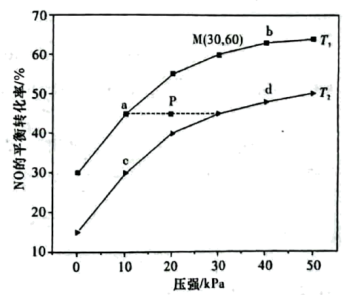
10 . 亚硝酰氯( )是有机合成的氯化剂。合成原理:
)是有机合成的氯化剂。合成原理:
 ,在密闭反应器中投入
,在密闭反应器中投入 和
和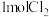 合成
合成 ,测得
,测得 的平衡转化率与温度、压强关系如图所示,下列叙述错误的是
的平衡转化率与温度、压强关系如图所示,下列叙述错误的是
 )是有机合成的氯化剂。合成原理:
)是有机合成的氯化剂。合成原理:
 ,在密闭反应器中投入
,在密闭反应器中投入 和
和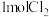 合成
合成 ,测得
,测得 的平衡转化率与温度、压强关系如图所示,下列叙述错误的是
的平衡转化率与温度、压强关系如图所示,下列叙述错误的是
| A.该反应在较低温度下能自发进行 |
B. 的体积分数: 的体积分数: |
C. 点时反应器中气体的平均摩尔质量约为 点时反应器中气体的平均摩尔质量约为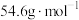 |
D. 点时同时减压和升温, 点时同时减压和升温, 的平衡转化率由 的平衡转化率由 点向 点向 点迁移 点迁移 |
您最近一年使用:0次



