解题方法
1 . 下列内容与结论相对应的是
| 选项 | 内容 | 结论 |
| A |  | 该过程的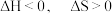 |
| B | 常温下,硝酸铵固体溶于水可自发进行 | 该过程的 |
| C | 一个反应的 | 反应一定不能自发进行 |
| D |  能自发进行 能自发进行 | 则该反应的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下列叙述正确的是
| A.稀醋酸中加少量醋酸钠能增大醋酸的电离程度 |
B.25℃时,将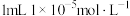 盐酸稀释至1000mL,所得溶液的pH为8 盐酸稀释至1000mL,所得溶液的pH为8 |
| C.蔗糖在水中溶解,这是熵增的过程 |
D.0.1molAgCl和0.1molAgI混合后加入1L水中所得溶液中 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的是
A.反应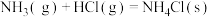 在室温下可自发进行,则该反应的 在室温下可自发进行,则该反应的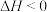 |
B. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的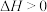 |
C. 室温下不能自发进行,则该反应的 室温下不能自发进行,则该反应的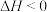 |
D.常温下,反应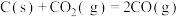 不能自发进行,则该反应的 不能自发进行,则该反应的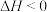 |
您最近一年使用:0次
2024-03-04更新
|
119次组卷
|
18卷引用:云南省玉溪师范学院附属中学2021-2022学年高二上学期期末考试化学试题
云南省玉溪师范学院附属中学2021-2022学年高二上学期期末考试化学试题云南省昆明市第十中学2021-2022学年高二下学期3月月考化学试题(已下线)2019年9月29日《每日一题》选修4—— 每周一测2019年10月24日《每日一题》2019-2020学年高二化学人教选修4——化学反应方向的判断内蒙古翁牛特旗乌丹第二中学2019-2020学年高二上学期期中考试化学试题江西省新余市分宜中学2019-2020学年高二上学期第一次段考化学试题(已下线)【新东方】 2020-2安徽省桐城市天城中学2019-2020学年高二上学期段考化学试题(已下线)第02章 化学反应速率与化学平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)山东省临沂市沂水一中2020-2021学年高二9月月考化学试题河北省安平中学2020-2021学年高二上学期第一次月考化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题(已下线)2.3 化学反应的方向-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)2.1 化学反应的方向-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)浙江省宁波市北仑中学2023-2024学年高二上学期期初考试化学试题浙江省宁波市北仑中学2023-2024学年高二上学期 期中化学试卷新疆实验中学2023-2024学年高二上学期期中考试化学试题浙江省杭州师范大学附属中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
4 . 研究化学反应的方向、速率、限度具有重要意义,下列说法正确的是
| A.ΔH<0、ΔS>0的反应在温度低时不能自发进行 |
B.一定温度下反应CaCO3(s) CaO(s)+CO2(g)达平衡,增加CaCO3的量,平衡正向移动 CaO(s)+CO2(g)达平衡,增加CaCO3的量,平衡正向移动 |
| C.升高温度可增大反应物分子的活化分子百分数从而提高化学反应速率 |
| D.在其他外界条件不变的情况下,汽车排气管中使用催化剂,可以改变产生尾气的反应方向 |
您最近一年使用:0次
2024-02-26更新
|
200次组卷
|
2卷引用:云南省大理州民族中学2023-2024学年高二下学期见面考化学试题
名校
5 . 甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,相关反应的热化学方程式为:
ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;
ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;
ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。
回答下列问题:
(1)a=______ (用b、c表示),已知反应ⅱ在一定条件下可自发进行,则b______ (填“>”“<”或“=”)0。
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)___ (填“>”“<”或“=”)v(逆),平衡常数_______ (填“变大”“变小”或“不变”)。
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
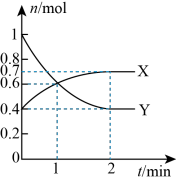
①Y为_____ (填化学式)。
②0~1min时v(CO)为_____ mol/(L·min)。
③该温度下,该反应的平衡常数Kc=______ 。
(4)工业上以 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

______ 。若该反应的 ,
, (
(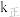 、
、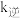 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则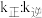
_______ (填“增大”“不变”或“减小”)。
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和 分别取
分别取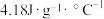 和
和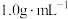 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热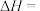
_____  。
。
②下列操作会使所测得的焓变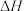 偏小的是
偏小的是______ 。
a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
ⅰ.CO(g)+2H2(g)
 CH3OH(g) ΔH=a kJ/mol;
CH3OH(g) ΔH=a kJ/mol;ⅱ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=b kJ/mol;
CH3OH(g)+H2O(g) ΔH=b kJ/mol;ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=−c kJ/mol。
CO(g)+H2O(g) ΔH=−c kJ/mol。回答下列问题:
(1)a=
(2)在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2与H2,在催化剂的作用下仅发生反应ⅲ。该反应达到平衡时,其他条件不变,通入CO2时,则v(正)
(3)一定温度下,向体积为2L的恒容密闭容器中通入CO、H2、CH3OH,发生反应ⅰ,其中X、Y的物质的量与时间的关系如图所示,反应进行1min时三种物质的体积分数均相等。
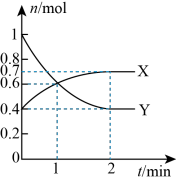
①Y为
②0~1min时v(CO)为
③该温度下,该反应的平衡常数Kc=
(4)工业上以
 和
和 为原料可制备合成气(CO、H2),已知
为原料可制备合成气(CO、H2),已知 、
、 、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应
、CO的燃烧热分别为890 kJ/mol、285kJ/mol、283kJ/mol,则反应

 ,
, (
(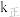 、
、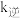 为速率常数,只与温度有关),平衡后降低温度,则
为速率常数,只与温度有关),平衡后降低温度,则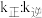
(5)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cm△T计算获得。
①热量的测定:取0.5000mol/LNaOH溶液和0.5500mol/L盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,(c和
 分别取
分别取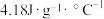 和
和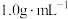 ,忽略水以外各物质吸收的热量,后同),则该实验测得中和热
,忽略水以外各物质吸收的热量,后同),则该实验测得中和热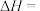
 。
。②下列操作会使所测得的焓变
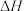 偏小的是
偏小的是a.用等物质的量浓度的醋酸代替盐酸实验 b.量热装置绝热效果欠佳 c.NaOH溶液量多了
您最近一年使用:0次
解题方法
6 . 下列说法错误的是
A. ,恒温时,缩小容积,气体颜色变浅 ,恒温时,缩小容积,气体颜色变浅 |
B.若压强不再随时间变化能说明反应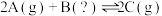 已达平衡,则 已达平衡,则 一定为气体 一定为气体 |
C.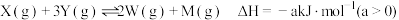 ,加入 ,加入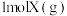 与 与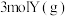 充分反应后,放出热量小于 充分反应后,放出热量小于 |
D. 该反应 该反应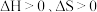 |
您最近一年使用:0次
名校
解题方法
7 . 下列说法错误的是
A.反应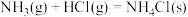 在室温下可自发进行,则该反应的 在室温下可自发进行,则该反应的 |
B.常温下,若反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
C.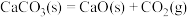 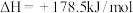 ,该反应高温才能自发 ,该反应高温才能自发 |
D.一定温度下,反应 的 的 , , |
您最近一年使用:0次
2024-01-21更新
|
72次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
8 . 下列关于焓判据和熵判据的说法中,不正确的是
| A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
| B.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ·mol-1,ΔS=-280.1J·mol-1·K-1。此反应在常温常压下能自发进行 |
| C.碳酸钙分解为吸热反应,该反应室温下不能自发进行,但在高温下则能自发进行 |
| D.吉布斯自由能大于0的反应一定不能发生 |
您最近一年使用:0次
2024-01-17更新
|
166次组卷
|
2卷引用:云南省曲靖市2023-2024学年高二上学期1月期末化学试题
名校
9 . Ⅰ.工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mo1,ΔS=-200J/(mol·K)。请回答下列问题:
2NH3(g) ΔH=-92.4kJ/mo1,ΔS=-200J/(mol·K)。请回答下列问题:
(1)常温下,合成氨反应___________ (填“能”或“不能”)自发进行,其平衡常数表达式K=___________ 。
(2)对于合成氨的反应,下列说法正确的是___________(填序号)。
Ⅱ.在500°C、20MPa时,将N2、H2置于一个容积为2L的恒容密闭容器中发生反应。反应过程中各种物质的物质的量变化如图所示:
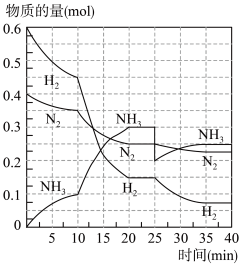
(3)10min内以H2表示的平均反应速率为___________ 。
(4)反应第一次达到平衡时N2的转化率为___________ 。
(5)在反应进行至10min时,曲线发生变化的原因为___________ (填序号,下同);在反应进行至25min时,曲线发生变化的原因为___________ 。
A.加了催化剂 B.降低温度 C.分离了部分NH3
(6)实验室中模拟合成氨过程,将1molN2和2.7molH2置于恒温、体积恒为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是___________ (填序号)。
a.反应不再进行,已经停止
b.单位时间内生成nmolN2的同时,消耗3nmolH2
c.3v正(H2)= 2v逆(NH3)
d. N2、H2和NH3的物质的量浓度之比为1:3:2
e.混合气体的压强不再改变
f.混合气体的密度不再改变
 2NH3(g) ΔH=-92.4kJ/mo1,ΔS=-200J/(mol·K)。请回答下列问题:
2NH3(g) ΔH=-92.4kJ/mo1,ΔS=-200J/(mol·K)。请回答下列问题:(1)常温下,合成氨反应
(2)对于合成氨的反应,下列说法正确的是___________(填序号)。
| A.该反应在任意条件下都可以自发进行 |
| B.加入催化剂,能提高NH3的产率 |
| C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2 |
| D.该反应属于人工固氮 |
Ⅱ.在500°C、20MPa时,将N2、H2置于一个容积为2L的恒容密闭容器中发生反应。反应过程中各种物质的物质的量变化如图所示:

(3)10min内以H2表示的平均反应速率为
(4)反应第一次达到平衡时N2的转化率为
(5)在反应进行至10min时,曲线发生变化的原因为
A.加了催化剂 B.降低温度 C.分离了部分NH3
(6)实验室中模拟合成氨过程,将1molN2和2.7molH2置于恒温、体积恒为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是
a.反应不再进行,已经停止
b.单位时间内生成nmolN2的同时,消耗3nmolH2
c.3v正(H2)= 2v逆(NH3)
d. N2、H2和NH3的物质的量浓度之比为1:3:2
e.混合气体的压强不再改变
f.混合气体的密度不再改变
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
| A.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ/mol,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0kJ/mol,则C(s,石墨)=C(s,金刚石) ΔH=+1.5kJ/mol |
B.由C(s)+ O2(g)=CO(g) ΔH=-110.5kJ/mol,可知碳的燃烧热为110.5kJ/mol O2(g)=CO(g) ΔH=-110.5kJ/mol,可知碳的燃烧热为110.5kJ/mol |
| C.常温常压下,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,则HF(aq) +NaOH(aq)=NaF(aq)+H2O(1) ΔH=-57.3kJ/mol |
| D.ΔH>0和ΔS>0的反应,在任何温度下都不能自发进行 |
您最近一年使用:0次



