1 . 室温下,反应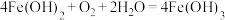 可以自发进行。下列叙述错误的是
可以自发进行。下列叙述错误的是
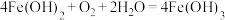 可以自发进行。下列叙述错误的是
可以自发进行。下列叙述错误的是A.该反应 |
| B.该反应有可能是吸热反应 |
| C.反应过程中,白色沉淀逐渐变成灰绿色,最后呈红褐色 |
| D.综合考虑焓变和熵变可以判断反应自发进行的方向 |
您最近一年使用:0次
名校
解题方法
2 . 神舟十五号顺利发射升空,标志着我国航天事业的飞速发展。
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。
相关物质的摩尔生成焓∆HfHm如下表所示。
注:一定温度下,由元素的最稳定单质生成1mol纯物质的热效应称为该物质的摩尔生成焓,用∆HfHm表示。如N2H4(1)的摩尔生成焓:N2(g)+2H2(g)=N2H4(l) ∆HfHm =+165.8kJ/mol
①∆H1=___________ kJ/mol。
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是___________ 。
(2)火箭推进器内氢氧燃烧的简化反应历程如下图所示,分析其反应机理。
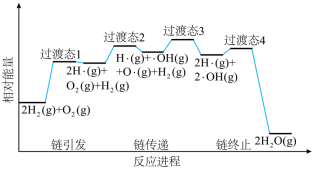
该历程分步进行,其中氢氧燃烧决速步对应的反应方程式为___________ 。
Ⅱ.在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g) N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,
N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,
(3)则NO的平衡转化率α(NO)=___________ (结果保留三位有效数字),该反应的平衡常数Kp=___________ (用含P0的代数式表示)
Ⅰ.火箭推进剂的研究是航天工业中的重要课题,常见推进剂的燃料包括汽油液肼(N2H4)、液氢等,具有不同的推进效能。回答下列问题:
(1)火箭推进剂可用N2H4作燃料,N2O4作氧化剂,反应的热化学方程式可表示为2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H1。
相关物质的摩尔生成焓∆HfHm如下表所示。
| 物质 | N2O4(g) | N2H4(l) | H2O(g) |
| 摩尔生成焓∆HfHm(kJ/mol) | +10.8 | +165.8. | -242.0 |
①∆H1=
②结合化学反应原理分析,N2H4(l)作推近剂燃料可与N2O4(g)自发进行反应的原因是
(2)火箭推进器内氢氧燃烧的简化反应历程如下图所示,分析其反应机理。

该历程分步进行,其中氢氧燃烧决速步对应的反应方程式为
Ⅱ.在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g)
 N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,
N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p=0.9p0,(3)则NO的平衡转化率α(NO)=
您最近一年使用:0次
3 . 回答下列问题
(1)下列 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是___________ 。
a.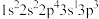 b.
b.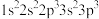 c.
c.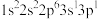 d.
d.
(2)下列各组多电子原子的能级能量比较不正确的是___________ 。
a. b.
b. c.
c.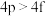 d.
d.
(3)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是___________ 。
a.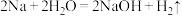 b.
b.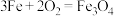
c. d.
d.
(4)某反应过程中的能量变化如图所示:___________ (填“增大”、“减小”或“不变”)。
②根据图像,该反应
___________ (用含a、b的代数式表示)。
(5)写出基态P原子价电子排布式___________ ,该基态原子中能量最高的电子所占的轨道形状是___________ 。
(6)已知:在25℃, 时。
时。
反应Ⅰ.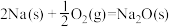
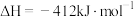 ;
;
反应Ⅱ.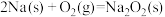
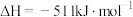 。
。
写出 与
与 反应生成
反应生成 的热化学方程式
的热化学方程式___________ 。
(7) 在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因
在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因___________ 。
(1)下列
 原子的核外电子排布式中,能量最高的是
原子的核外电子排布式中,能量最高的是a.
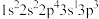 b.
b.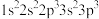 c.
c.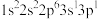 d.
d.
(2)下列各组多电子原子的能级能量比较不正确的是
a.
 b.
b. c.
c.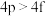 d.
d.
(3)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是
a.
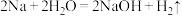 b.
b.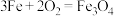
c.
 d.
d.
(4)某反应过程中的能量变化如图所示:

②根据图像,该反应

(5)写出基态P原子价电子排布式
(6)已知:在25℃,
 时。
时。反应Ⅰ.
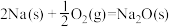
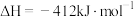 ;
;反应Ⅱ.
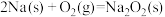
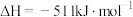 。
。写出
 与
与 反应生成
反应生成 的热化学方程式
的热化学方程式(7)
 在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因
在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因
您最近一年使用:0次
4 . 合成氨工业中原料气进入合成塔前需经过铜氨溶液“净化”,除去其中的CO,原理为
 。下列说法正确的是
。下列说法正确的是

 。下列说法正确的是
。下列说法正确的是| A.该反应在任何温度下均能自发进行 | B.降低温度有利于吸收CO |
| C.增大压强有利于铜氨溶液再生 | D.为节约成本,原料气可以不进行净化 |
您最近一年使用:0次
2024-01-24更新
|
71次组卷
|
2卷引用:山西省长治市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 下列说法正确的是
| A.使用催化剂可降低反应活化能,增大活化分子百分数,提高反应物的转化率 |
B.常温,反应 能自发进行,则该反应的 能自发进行,则该反应的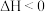 |
C.若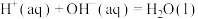  ,则含2molNaOH的溶液与浓硫酸完全反应,放出的热量为114.6kJ ,则含2molNaOH的溶液与浓硫酸完全反应,放出的热量为114.6kJ |
| D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
您最近一年使用:0次
2024-01-22更新
|
94次组卷
|
2卷引用:四川省达州市2023-2024学年高二上学期期末监测化学试题
名校
6 . 下列说法正确的是
| A.凡是需要加热才发生的反应都是非自发反应 |
| B.固体溶解一定是熵减小的过程 |
| C.熵增的反应不一定是自发反应 |
D.反应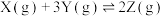  ,降低温度,则平衡向右移动 ,降低温度,则平衡向右移动 |
您最近一年使用:0次
2024-01-22更新
|
59次组卷
|
2卷引用:重庆市部分区2023-2024学年高二上学期期末联考化学试题
解题方法
7 . 下列关于化学反应方向的说法正确的是
| A.凡是放热反应都是自发反应 | B.非自发反应任何条件都不能发生 |
| C.凡是熵增大的反应都是自发反应 | D.反应是否自发与熵变和焓变都有关 |
您最近一年使用:0次
2024-01-20更新
|
63次组卷
|
2卷引用:北京市石景山区2023-2024学年高二上学期期末考试化学试卷
解题方法
8 . Ⅰ.含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量 :
: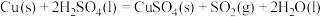
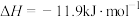 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)已知
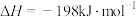 。850K时,在一恒容密闭反应器中充入一定量的
。850K时,在一恒容密闭反应器中充入一定量的 和
和 ,当反应达到平衡后测得
,当反应达到平衡后测得 、
、 和
和 的浓度分别为
的浓度分别为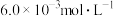 、
、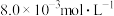 和
和 。
。
①该温度下反应的平衡常数为___________ 。
②平衡时 的转化率为
的转化率为___________ 。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法不正确的是___________ 。
A.须采用高温高压的反应条件使 氧化为
氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和 的转化率
的转化率
D.在吸收塔中宜采用水或稀硫酸吸收 以提高吸收速率
以提高吸收速率
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是___________ 。
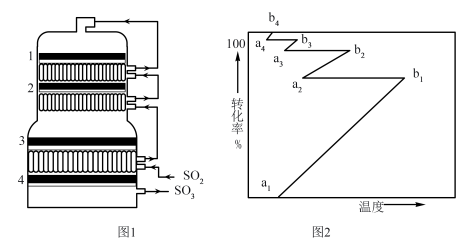
A. B.
B. C.
C. D.
D. E.
E. F.
F. G.
G.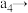
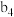
Ⅱ.一定条件下,用 、NiO或
、NiO或 作催化剂对燃煤烟气回收。反应为
作催化剂对燃煤烟气回收。反应为
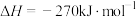 。
。
(4)其他条件相同、催化剂不同, 的转化率随反应温度的变化如图3,
的转化率随反应温度的变化如图3, 和NiO作催化剂均能使
和NiO作催化剂均能使 的转化率达到最高,不考虑催化剂价格因素,选择
的转化率达到最高,不考虑催化剂价格因素,选择 的主要优点是:
的主要优点是:___________ 。
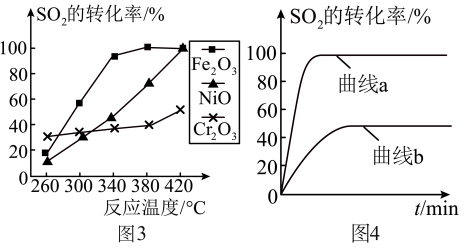
(5)某科研小组用 作催化剂。在380℃时,分别研究了
作催化剂。在380℃时,分别研究了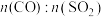 为1:1、3:1时
为1:1、3:1时 转化率的变化情况图4。则图4中表示
转化率的变化情况图4。则图4中表示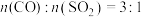 的变化曲线为
的变化曲线为___________ 。
(1)实验室可用铜与浓硫酸反应制备少量
 :
: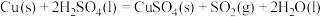
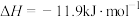 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)已知

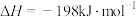 。850K时,在一恒容密闭反应器中充入一定量的
。850K时,在一恒容密闭反应器中充入一定量的 和
和 ,当反应达到平衡后测得
,当反应达到平衡后测得 、
、 和
和 的浓度分别为
的浓度分别为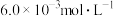 、
、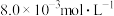 和
和 。
。①该温度下反应的平衡常数为
②平衡时
 的转化率为
的转化率为(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法不正确的是
A.须采用高温高压的反应条件使
 氧化为
氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和
 的转化率
的转化率D.在吸收塔中宜采用水或稀硫酸吸收
 以提高吸收速率
以提高吸收速率②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是

A.
 B.
B. C.
C. D.
D. E.
E. F.
F. G.
G.
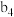
Ⅱ.一定条件下,用
 、NiO或
、NiO或 作催化剂对燃煤烟气回收。反应为
作催化剂对燃煤烟气回收。反应为
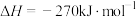 。
。(4)其他条件相同、催化剂不同,
 的转化率随反应温度的变化如图3,
的转化率随反应温度的变化如图3, 和NiO作催化剂均能使
和NiO作催化剂均能使 的转化率达到最高,不考虑催化剂价格因素,选择
的转化率达到最高,不考虑催化剂价格因素,选择 的主要优点是:
的主要优点是:(5)某科研小组用
 作催化剂。在380℃时,分别研究了
作催化剂。在380℃时,分别研究了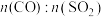 为1:1、3:1时
为1:1、3:1时 转化率的变化情况图4。则图4中表示
转化率的变化情况图4。则图4中表示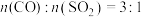 的变化曲线为
的变化曲线为
您最近一年使用:0次
解题方法
9 . 下列反应可以自发进行但不能利用熵判据解释的是
| A.NaHCO3(s)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) |
| B.Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) |
| C.4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) |
| D.2KClO3(s)=2KCl(s)+3O2(g) |
您最近一年使用:0次
名校
10 . 课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g)  2NH3(g) ΔH < 0,ΔS < 0 。
2NH3(g) ΔH < 0,ΔS < 0 。
(1)下列关于工业合成氨的说法正确的是________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中 T 表示温度,n 表示H2物质的量)。
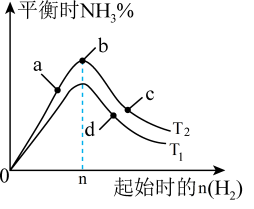
①图象中T2和T1的关系是:T2______ T1(填“>,<或=”,下同)
②a、 b、 c、 d 四点所处的平衡状态中,反应物N2的转化率最高的是______ (填字母)。
(3)恒温下, 往一个 4L 的密闭容器中充入5.2mol H2和 2mol N2,反应过程中对 NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的一定处于平衡状态的时间段是_______ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和 NH3各 4mol,化学平衡将向_____ 反应方向移动(填“正”或“逆”)。请通过计算说明该方向的判断理由___________ 。
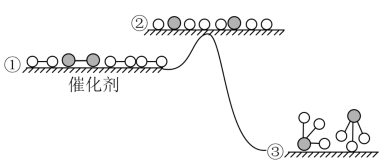
(4)工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是_______。
 2NH3(g) ΔH < 0,ΔS < 0 。
2NH3(g) ΔH < 0,ΔS < 0 。(1)下列关于工业合成氨的说法正确的是________。
| A.因 为ΔH< 0,所以该反应一定能自发进行 |
| B.因为ΔS < 0,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能 |
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中 T 表示温度,n 表示H2物质的量)。

①图象中T2和T1的关系是:T2
②a、 b、 c、 d 四点所处的平衡状态中,反应物N2的转化率最高的是
(3)恒温下, 往一个 4L 的密闭容器中充入5.2mol H2和 2mol N2,反应过程中对 NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L−1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和 NH3各 4mol,化学平衡将向
(4)工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是_______。

| A.增大压强,① → ②之间的能量差值会增大 |
| B.合成氨的正、逆反应的焓变相同 |
| C.合成氨的过程是吸热过程 |
| D.若使用催化剂,生成等量的 NH3需要的时间更短 |
您最近一年使用:0次



