1 . 已知乙二酸俗称草酸(H2C2O4)。25℃,有下表相关数据,请回答下列问题
(1)写出 水解的离子方程式
水解的离子方程式___________
(2)相同条件下物质的量浓度都为0.01mol/LNa2C2O4溶液的pH比NaHCO3溶液的pH___________ (填“大”、“小”或“相等”)
(3)常温下将0.2mol/L的KOH溶液10mL与0.1mol/L的草酸溶液10mL混合,混合后溶液中阴离子浓度由大到小顺序为___________
(4)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入amol/L的草酸钾溶液10mL后,有草酸钙沉淀生成,则a的最小值为___________
(5)为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定至终点。重复上述操作2次,滴定结果如表所示:
①滴定过程中,盛装KMnO4溶液的仪器为___________ (填名称)
②滴定终点的现象为___________
③已知反应:5H2C2O4+2 +6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=
+6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=___________
④若滴定终点读数俯视KMnO4溶液液面,则x值会___________ (填“偏大”、“偏小”或“无影响”)
| 电离常数 | 溶度积 | ||
| 草酸 | 碳酸 | 草酸钙 | 碳酸钙 |
| Ka1=5.0×10-2 Ka2=5.4×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ksp=4.0×10-8 | Ksp=2.5×10-9 |
(1)写出
 水解的离子方程式
水解的离子方程式(2)相同条件下物质的量浓度都为0.01mol/LNa2C2O4溶液的pH比NaHCO3溶液的pH
(3)常温下将0.2mol/L的KOH溶液10mL与0.1mol/L的草酸溶液10mL混合,混合后溶液中阴离子浓度由大到小顺序为
(4)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入amol/L的草酸钾溶液10mL后,有草酸钙沉淀生成,则a的最小值为
(5)为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4溶液滴定至终点。重复上述操作2次,滴定结果如表所示:
| 实验序号 | V(KMnO4溶液) | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 0.50 | 10.00 |
| 2 | 1.10 | 11.10 |
| 3 | 1.50 | 11.50 |
①滴定过程中,盛装KMnO4溶液的仪器为
②滴定终点的现象为
③已知反应:5H2C2O4+2
 +6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=
+6H+=10CO2↑+2Mn2++8H2O。根据数据,计算x=④若滴定终点读数俯视KMnO4溶液液面,则x值会
您最近一年使用:0次
2 . 下列实验过程不能达到实验目的的是
| 实验目的 | 实验过程 | |
| A | 测定CH3COOH溶液的浓度 | 用标准NaOH溶液滴定CH3COOH溶液,选择甲基橙为指示剂 |
| B | 探究KI与FeCl3反应的限度 | 取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应滴入5滴15%的KSCN溶液 |
| C | 比较CH3COOH和HCOOH酸性强弱 | 相同温度下,测定浓度均为0.1mol·L-1CH3COONa溶液与HCOONa溶液的pH |
| D | 比较Ksp[Cu(OH)2]和Ksp[Mg(OH)2]的大小关系 | 某温度下,向1mL0.1mol·L-1MgSO4溶液中,滴入3mL0.1mol·L-1NaOH溶液,产生白色沉淀,再滴入2滴0.1mol·L-1CuSO4溶液,有蓝色沉淀出现 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 根据所学知识回答下列问题:
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为______________ 。
(2)已知:常温时,亚硫酸的电离平衡常数Ka1=1.23×10-2,Ka2=5.60×10-8,则0.1 mol·L-1的NaHSO3溶液显_______ (填“酸”、“中”或“碱”)性,请用相应的数据及文字说明:______________ 。
(3)实验室用FeCl3(s)配制FeCl3溶液的操作为_______ ,若将FeCl3溶液蒸干并灼烧至恒重,得到的物质为_______ (填化学式)。
(4)25℃时,将足量氯化银分别放入下列4种溶液中,充分搅拌后,银离子浓度由大到小的顺序是_______ (填标号);②中氯离子的浓度为_______ mol·L-1.(氯化银的Ksp=1.8×10-10)
①100 mL蒸馏水 ②100 mL 0.2 mol·L-1 AgNO3溶液
③100 mL 0.1 mol·L-1 氯化铝溶液 ④100 mL 0.1 mol·L-1盐酸
(1)0.1 mol·L-1的KAl(SO4)2溶液中各离子的浓度由大到小的顺序为
(2)已知:常温时,亚硫酸的电离平衡常数Ka1=1.23×10-2,Ka2=5.60×10-8,则0.1 mol·L-1的NaHSO3溶液显
(3)实验室用FeCl3(s)配制FeCl3溶液的操作为
(4)25℃时,将足量氯化银分别放入下列4种溶液中,充分搅拌后,银离子浓度由大到小的顺序是
①100 mL蒸馏水 ②100 mL 0.2 mol·L-1 AgNO3溶液
③100 mL 0.1 mol·L-1 氯化铝溶液 ④100 mL 0.1 mol·L-1盐酸
您最近一年使用:0次
4 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向NaHS溶液中滴入酚酞 | 溶液变红 | HS-水解程度小于电离程度 |
| B | 向浓度均为0.1 mol·L-1的FeCl3、CuCl2的混合溶液中逐滴加入氨水 | 出现红褐色沉淀 | Ksp[Fe(OH)3]>Ksp[Cu(OH)2] |
| C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
| D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀产生 | KI3溶液中还含有I2和I- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-29更新
|
421次组卷
|
2卷引用:湖南省常德市2020-2021学年高二上学期期末考试化学试题
5 . 已知同温度下,溶解或电离出 的能力:
的能力: 。下列离子方程式不正确的是
。下列离子方程式不正确的是
 的能力:
的能力: 。下列离子方程式不正确的是
。下列离子方程式不正确的是A. | B. |
C. | D. |
您最近一年使用:0次
2021-01-27更新
|
82次组卷
|
2卷引用:湖南省常德市2020-2021学年高二上学期期末考试化学试题
2014·陕西·二模
名校
6 . 已知25℃时,AgCl的Ksp=1.56×10-10,AgBr的Ksp=5.0×10-13,将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓硝酸银溶液,发生的反应为
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀少于AgBr沉淀 | D.AgCl沉淀多于AgBr沉淀 |
您最近一年使用:0次
2021-01-19更新
|
196次组卷
|
18卷引用:2015-2016学年湖南省常德一中高二下第一次月考化学试卷
2015-2016学年湖南省常德一中高二下第一次月考化学试卷(已下线)2014陕西省西工大附中高三上学期第二次适应性训练化学试卷(已下线)2015届湖北省恩施高中高三上学期起点考试化学试卷2015届湖南省长浏宁三县一中高三5月模拟考试化学试卷2015届湖南省长沙、浏阳、宁乡三市高三下学期模拟考试化学试卷辽宁省本溪市第一中学2018-2019学年高二上学期期末考试化学试题山西省运城市芮城县2018-2019学年高二上学期期末考试化学试题河南省洛阳市2018-2019学年高二第一学期期中考试化学试题吉林省长春市实验中学2019-2020学年高二上学期期中考试化学试题北京市昌平区新学道临川学校2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测(已下线)【南昌新东方】2019 南大附中 高二上 期中江西省临川一中暨临川一中实验学校2020-2021学年高二上学期期中考试化学试题河南省新蔡县2020-2021学年高二上学期期末调研考试化学试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题四川省成都外国语学校2020-2021学年高二下学期开学考试化学试题内蒙古呼和浩特市2021-2022学年高二上学期期末考试化学试题陕西省渭南市白水县2021-2022学年高二上学期期末考试化学试题
名校
解题方法
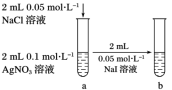
7 . 下列实验操作、现象及结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 分别向两支盛有4mL0.01mol/L的KMnO4酸性溶液中,各加入2mL 0.01mol/L和0.02mol/L的草酸溶液 | 加入0.02 mol/L草酸溶液的紫色先褪去 | 浓度越大,化学反应速率越快 |
B | 白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后,取溶液少许于试管中,向其中滴加几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生 氧化还原反应 |
C | 将溴乙烷在NaOH乙醇溶液中反应生成的气体通入酸性高锰酸钾溶液中 | 高锰酸钾溶液紫色褪去 | 反应生成了乙烯 |
D |
| a出现白色沉淀,b出现黄色沉淀 | 不能证明,溶度积: Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-16更新
|
196次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期4月月考化学试题
名校
解题方法
8 . 已知:常温下,Ksp(CuS)=1.0×10-36,Ksp(HgS)=1.6×10-52;pM=-lgc(M2+)。常温下,向10.0mL0.20mol。L-1Cu(NO3)2溶液中逐滴滴加0.10mol·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是
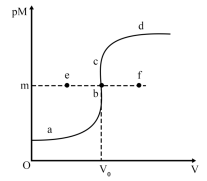

| A.V0=20.0mL,m=18 |
| B.若c[Cu(NO3)2]=0.1mol·L-1,则反应终点可能为e点 |
| C.a、b、d三点中,由水电离的c(H+)和c(OH-)的乘积最大的为b点 |
| D.相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动 |
您最近一年使用:0次
2021-01-12更新
|
539次组卷
|
9卷引用:【市级联考】湖南省常德市2019届高三下学期第一次模拟考试理科综合化学试题
【市级联考】湖南省常德市2019届高三下学期第一次模拟考试理科综合化学试题(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编2020届人教版高三化学二轮复习选择题专攻练——水溶液中的离子平衡黑龙江省实验中学2020-2021学年高二上学期期末考试化学试题山东省烟台市2022-2023学年高二上学期期中考试化学试题山东省招远第一中学2022-2023学年高二上学期期中学业水平诊断化学试题山东省文登第一中学2022-2023学年高二上学期1月期末考试化学试题(已下线)第5讲 难溶电解质的溶解平衡黑龙江省齐齐哈尔市讷河市第二中学2023-2024学年高二上学期期末考试化学试题
名校
9 . 下列有关说法正确的是
| A.N2(g)+3H2(g)⇌2NH3(g) △H<0,仅升高温度,达平衡时氢气转化率增大 |
| B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量CuSO4溶液 |
| C.若吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”—定条件下可自发进行,则该反应△S<0 |
| D.在稀AgNO3溶液中加入过量NaCl溶液,产生白色沉淀,再加入少量Na2S溶液,出现黑色沉淀,则加入Na2S溶液后c(Ag+)不变 |
您最近一年使用:0次
2021-01-06更新
|
105次组卷
|
2卷引用:湖南省常德市芷兰实验中学2020-2021学年高二下学期第一次月考化学试题
名校
解题方法
10 . 能正确表示下列反应的离子方程式是 ( )
A.向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O = AlO +4NH +4NH +2H2O +2H2O |
B.足量NaHCO3溶液与澄清石灰水反应:HCO + Ca2++OH-= CaCO3↓+ H2O + Ca2++OH-= CaCO3↓+ H2O |
| C.向Mg(OH)2悬浊液中加入FeCl3溶液,白色沉淀转化为红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
D.NaHCO3溶液与NaHSO4溶液反应:CO +2H+= H2O+CO2↑ +2H+= H2O+CO2↑ |
您最近一年使用:0次
2021-01-05更新
|
631次组卷
|
3卷引用:湖南省常德市第一中学 2023届高三7月摸底考试化学试题