名校
1 . 用Ksp表示难溶物的溶度积。下列有关沉淀溶解平衡的说法中,正确的是
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.温度升高,沉淀物的Ksp一定增大 |
| D.25℃时,Ksp(AgCl)> Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
您最近一年使用:0次
2021-04-16更新
|
177次组卷
|
3卷引用:湖南省常德市一中2020-2021学年高二下学期期中考试化学试题
名校
解题方法
2 . 以金属切削废料(由铁屑和镍钴合金、金刚砂组成)为原料回收镍钴生产NiSO4·7H2O和CoCl2·6H2O的工艺如图:
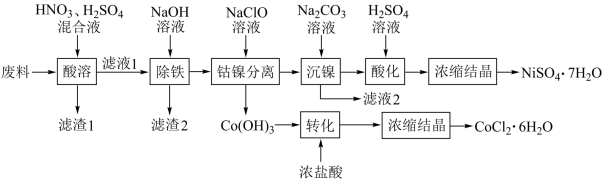
已知:①相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
②常温下,Ksp(NiCO3)=1.0×10-7。
回答下列问题:
(1)将废料研磨成粉的作用是___ 。
(2)理论上“除铁”需控制pH的范围为___ ,“滤渣2”中除Fe(OH)3外,还有少量黄钠铁矾[Na2Fe6(SO4)4(OH)12],写出Fe3+生成黄钠铁矾的离子方程式:___ 。
(3)写出“钴镍分离”时发生反应的离子方程式:___ 。“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液2”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___ [沉镍率=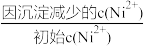 ]。
]。
(4)“转化”时产生的气体为___ 。
(5)碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为:NiOOH+MH Ni(OH)2+M。放电时,负极反应式为
Ni(OH)2+M。放电时,负极反应式为___ 。

已知:①相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Co3+ | Co2+ | Fe3+ | Fe2+ | Ni2+ |
| 开始沉淀的pH | 0.3 | 7.2 | 1.5 | 6.3 | 6.9 |
| 沉淀完全的pH | 1.1 | 9.2 | 2.8 | 8.3 | 8.9 |
回答下列问题:
(1)将废料研磨成粉的作用是
(2)理论上“除铁”需控制pH的范围为
(3)写出“钴镍分离”时发生反应的离子方程式:
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=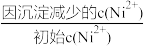 ]。
]。(4)“转化”时产生的气体为
(5)碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为:NiOOH+MH
 Ni(OH)2+M。放电时,负极反应式为
Ni(OH)2+M。放电时,负极反应式为
您最近一年使用:0次
2021-04-07更新
|
515次组卷
|
4卷引用:湖南省常德市2021届高三第一次(3月)模拟考试化学试题
湖南省常德市2021届高三第一次(3月)模拟考试化学试题(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)福建省莆田一中2021届高三模拟质量检测化学试题湖南省永州市第一中学2022届高三第二次月考化学试题
名校
3 . 常温下,几种物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入___ ,将溶液调至pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=___ mol/L。
(2)上述溶液过滤后,将所得滤液经过蒸发浓缩、冷却结晶得到CuCl2•2H2O晶体。某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入适当过量的KI固体,充分反应后用0.1000mol/LNa2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
试回答:
①可选用___ 作滴定指示剂,滴定终点的现象是___ 。
②含有CuCl2•2H2O晶体的试样的纯度是___ 。
③若滴定到终点时,仰视读数,则测定结果___ 。
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入
(2)上述溶液过滤后,将所得滤液经过蒸发浓缩、冷却结晶得到CuCl2•2H2O晶体。某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入适当过量的KI固体,充分反应后用0.1000mol/LNa2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:2Cu2++4I-=2CuI↓+I2;I2+2S2O
 =S4O
=S4O +2I-)。
+2I-)。试回答:
①可选用
②含有CuCl2•2H2O晶体的试样的纯度是
③若滴定到终点时,仰视读数,则测定结果
您最近一年使用:0次
名校
解题方法
4 . (1)常温下,pH=12的NaOH溶液,其浓度c(NaOH)=
(2)常温下,某一元弱酸溶液的pH=1,其浓度
(3)向物质的量浓度均为0.01mol/L的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是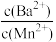 =
=
您最近一年使用:0次
名校
5 . 已知25℃时,以下五种物质的Ksp:
现以0.1mol/L的AgNO3溶液测定某溶液中c(Cl-),适宜做该滴定指示剂的物质是
| 物质 | AgCl | Ag2CrO4 | AgBr | AgI | Ag2S |
| Ksp | 2×10-10 | 2×10-12 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 |
| 颜色 | 白色 | 砖红色 | 淡黄色 | 黄色 | 黑色 |
| A.K2CrO4 | B.KBr | C.KI | D.K2S |
您最近一年使用:0次
6 . 常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法不正确的是
| A.两溶液混合,AgCl和AgI都沉淀 |
| B.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 |
| C.向AgI的饱和溶液中加AgNO3,c(Ag+)增大,Ksp(AgI)不变 |
| D.若取0.1435克AgCl固体配成100mL水(忽略体积变化),c(Cl-)约为1.3×10-5mol/L |
您最近一年使用:0次
名校
7 . 已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH__ 。(填“大”“小”或“相等”)
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为__ 。
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)__________ 。
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)
您最近一年使用:0次
8 . 氧化锌是一种常用的化学添加剂,广泛应用于塑料、硅酸盐制品、合成橡胶、油漆涂料等产品的制作中。常温下,提纯含SiO2、FeO、MnO、NiO等杂质的氧化锌的工艺流程如下,回答下列问题:
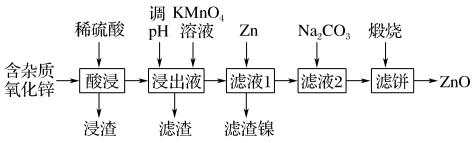
(1)MnO、NiO均为碱性氧化物,“浸渣”的主要成分是___________
(2)“滤渣”中含有MnO2和甲,甲的化学式为___________
(3)加入锌的目的是除去Ni2+,则反应的离子方程式为___________
(4)若“浸出液”中c(Zn2+)=1.0 mol/L,“调pH”的范围是___________ [已知Fe(OH)3、Zn(OH)2的Ksp分别为1.0×10-38、1.0×10-17,Fe3+沉淀完即c(Fe3+)<1.0×10-5mol·L-,Zn2+不沉淀]
(5)若滤饼的成分为Zn(OH)2·ZnCO3,写出“滤液2”中加入Na2CO3发生反应的离子方程式:___________ 。

(1)MnO、NiO均为碱性氧化物,“浸渣”的主要成分是
(2)“滤渣”中含有MnO2和甲,甲的化学式为
(3)加入锌的目的是除去Ni2+,则反应的离子方程式为
(4)若“浸出液”中c(Zn2+)=1.0 mol/L,“调pH”的范围是
(5)若滤饼的成分为Zn(OH)2·ZnCO3,写出“滤液2”中加入Na2CO3发生反应的离子方程式:
您最近一年使用:0次
2021-03-10更新
|
201次组卷
|
2卷引用:湖南省常德市芷兰实验中学2020-2021学年高二下学期第一次月考化学试题
名校
9 . 钡盐生产过程中排出大量的钡泥[主要含有 、
、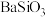 、
、 、
、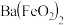 等],由该钡泥制取硝酸钡
等],由该钡泥制取硝酸钡 的工艺流程如下:
的工艺流程如下:
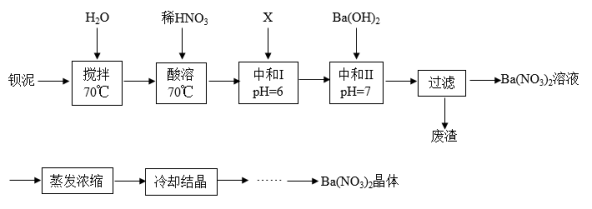
已知废渣中含有Fe(OH)3。下列说法错误的是
 、
、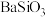 、
、 、
、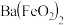 等],由该钡泥制取硝酸钡
等],由该钡泥制取硝酸钡 的工艺流程如下:
的工艺流程如下:
已知废渣中含有Fe(OH)3。下列说法错误的是
| A.“酸溶”时的不溶物成分主要为硅酸和硫酸钡 |
| B.为了加快反应速率,“酸溶”时,可采取搅拌、高温等措施 |
| C.“中和Ⅰ”加入的X可选用BaCO3 |
| D.废渣经过加工可用来生产油漆或涂料 |
您最近一年使用:0次
2021-03-01更新
|
254次组卷
|
5卷引用:湖南省常德市鼎城区第一中学2021-2022学年高三下学期期中考试化学试题
名校
解题方法
10 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:
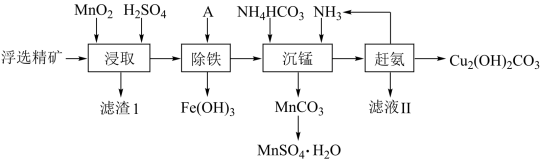
已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
②[Cu(NH3)4]SO4常温稳定,在热的水溶液中会分解生成NH3
③Ksp[Fe(OH)3]=4.0×10-38
④硫在二硫化碳中的溶解度随温度升高而增大。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___________ (任写一种)
(2)滤渣Ⅰ经CS2提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分是___________ 。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过低或过高的原因是___________
(3)常温下,“除铁”时加入试剂A可用CuO,调节pH的范围为___________ ,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为___________
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___________
(5)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00 g,加蒸馏水配成100 mL溶液,取出25.00 mL用标准浓度的BaCl2溶液测定,完全反应后得到了4.66 g沉淀,则此样品的纯度为___________ (保留到小数点后两位)

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀的pH | 9.0 | 3.7 | 6.7 | 9.8 |
②[Cu(NH3)4]SO4常温稳定,在热的水溶液中会分解生成NH3
③Ksp[Fe(OH)3]=4.0×10-38
④硫在二硫化碳中的溶解度随温度升高而增大。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ经CS2提取后可获得一种淡黄色副产品,则滤渣Ⅰ中的主要成分是
(3)常温下,“除铁”时加入试剂A可用CuO,调节pH的范围为
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:
(5)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00 g,加蒸馏水配成100 mL溶液,取出25.00 mL用标准浓度的BaCl2溶液测定,完全反应后得到了4.66 g沉淀,则此样品的纯度为
您最近一年使用:0次
2021-02-05更新
|
115次组卷
|
2卷引用:湖南省临澧县第一中学2020-2021学年高二上学期期末考试化学试题



