名校
1 . SrF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节SrF2浊液的pH,测得在不同pH条件下,体系中-lgc(X)(X 为Sr2+或F )与lg[ ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是

 ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是
A.L1代表-lgc(Sr2+)与lg[ ]的变化曲线 ]的变化曲线 |
| B.Ka(HF)的数值为10-2.2 |
| C.a、c 两点的溶液中均存在2c(Sr2+) + (H+) = c(F ) + c(OH-) |
| D.c 点的溶液中存在c(Cl-)>(F-) |
您最近一年使用:0次
2022-04-20更新
|
1164次组卷
|
6卷引用:湖南省常德市汉寿县第一中学2022届高三下学期第三次模考化学试题
湖南省常德市汉寿县第一中学2022届高三下学期第三次模考化学试题黑龙江省哈尔滨市第九中学2022届高三下学期第三次模拟考试理综化学试题(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)湖北省襄阳市第五中学2022届高三年级适应性考试(五)化学试题湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题
名校
2 . 某工业生产上用铜镍矿石(主要成分为CuS、NiS、FeS、SiO2及不溶于酸的杂质)制备胆矾CuSO4•5H2O的流程如图。

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org)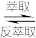 CuR2(org)+2H+(aq)。
CuR2(org)+2H+(aq)。
(1)焙烧前粉碎的目的是_______ 。
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为_______ ,试剂X的最佳选择是_______ (填标号)。
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
该滤液的pH为_______ ;加入的Cu(OH)2_______ (填“已经”或“没有”)完全溶解。
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为_______ 。
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为_______ 。
(6)上述流程中获取金属铜的方法是电解硫酸铜溶液。若电解200mL 0.5mol/L CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是_______ 。

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org)
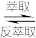 CuR2(org)+2H+(aq)。
CuR2(org)+2H+(aq)。(1)焙烧前粉碎的目的是
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
| 离子 | Fe3+ | Cu2+ | Ni2+ | Fe2+ |
| 浓度/(mol·L-1) | 1.0×10-6 | 5.0 | 1.2 | 0 |
| 对应氢氧化物的Ksp | 6.4×10-38 | 2.2×10-20 | 2.0×10-15 | 8.0×10-16 |
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为
(6)上述流程中获取金属铜的方法是电解硫酸铜溶液。若电解200mL 0.5mol/L CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是
您最近一年使用:0次
2022-04-18更新
|
508次组卷
|
5卷引用:湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题
湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题福建省龙岩第一中学2022届高三下学期第一次模拟考试化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)湖南省攸县第二中学2022-2023学年高三第六次月考化学试题(已下线)预测卷05-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
3 . Co2O3主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为Co2O3,含少量Fe2O3、SiO2及铝、镁、钙等金属元素的氧化物)制取Co2O3的工艺流程如图所示。

部分阳离子以氢氧化物形式沉淀时溶液pH
回答下列问题:
(1)“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是_______ (写出一种即可),加入Na2SO3的作用是_______ 。
(2)“氧化”过程中金属离子与NaClO3反应的离子方程式为_______ ,由此推测还原性:Fe2+_______ Co2+(填“>”或“<”)。
(3)滤渣2的主要成分为_______ (写化学式),检验铁元素的离子已被完全沉淀的实验操作及现象;取少量待测液于试管中,_______ 。
(4)已知某温度下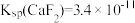 ,
,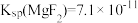 。该温度下,“沉淀除杂”时加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中
。该温度下,“沉淀除杂”时加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中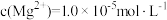 ,则滤液中c(Ca2+)为
,则滤液中c(Ca2+)为_______ (保留2位有效数字)。
(5) 在空气中充分煅烧,除得到产品外还产生了CO2,则反应中
在空气中充分煅烧,除得到产品外还产生了CO2,则反应中 与O2的化学计量数之比为
与O2的化学计量数之比为_______ 。

部分阳离子以氢氧化物形式沉淀时溶液pH
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 |
(1)“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是
(2)“氧化”过程中金属离子与NaClO3反应的离子方程式为
(3)滤渣2的主要成分为
(4)已知某温度下
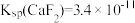 ,
,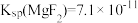 。该温度下,“沉淀除杂”时加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中
。该温度下,“沉淀除杂”时加入足量的NaF溶液可将Ca2+、Mg2+沉淀除去,若所得滤液中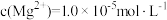 ,则滤液中c(Ca2+)为
,则滤液中c(Ca2+)为(5)
 在空气中充分煅烧,除得到产品外还产生了CO2,则反应中
在空气中充分煅烧,除得到产品外还产生了CO2,则反应中 与O2的化学计量数之比为
与O2的化学计量数之比为
您最近一年使用:0次
2022-04-15更新
|
1877次组卷
|
11卷引用:湖南省常德市桃源县第一中学2022届高三下学期第二次模拟化学试题
湖南省常德市桃源县第一中学2022届高三下学期第二次模拟化学试题湖南省常德市石门县第一中学2022届高三下学期月考化学试题广东省广州市天河区2022届高三一模化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】03(已下线)必刷卷02-2022年高考化学考前信息必刷卷(广东专用)(已下线)化学-2022年高考押题预测卷02(全国乙卷)(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题湖南省株洲市第一中学2023届高三第七次月考化学试题(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)T16-工业流程题
10-11高二下·浙江杭州·期中
名校
解题方法
4 . 下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[ 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒
③石灰岩(喀斯特地貌)溶洞的形成
④ 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以
⑤泡沫灭火器灭火原理
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强
②误将钡盐[
 、
、 ]当作食盐食用后,常用0.5%的
]当作食盐食用后,常用0.5%的 溶液解毒
溶液解毒 ③石灰岩(喀斯特地貌)溶洞的形成
④
 不能作“钡餐”,而
不能作“钡餐”,而 可以
可以 ⑤泡沫灭火器灭火原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
您最近一年使用:0次
2022-04-06更新
|
1239次组卷
|
55卷引用:湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题
湖南省常德市淮阳中学2019-2020学年高二下学期期中考试化学试题(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷河北省衡水中学2016-2017学年高一下学期三调考试化学试题吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题2017-2018学年四川省乐山四校高二第二学期半期联考化学试题【全国百强校】河北省辛集中学2018-2019学年高二上学期期中考试化学试题(已下线)2019年1月7日 《每日一题》人教选修4-沉淀的生成与溶解【全国百强校】河北省冀州市中学2018-2019学年高二上学期第五次月考化学试题2019年10月20日《每日一题》2020年高考化学一轮复习—— 每周一测黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期中考试化学试题北京市2019—2020学年高二上学期期中考试化学试题(选修4人教版)苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷山西省太原市太原师范学院附属中学2019-2020学年高二上学期12月月考理科化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡原理的应用(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题(已下线)第26讲 难溶电解质的溶解平衡(精讲)-2022年一轮复习讲练测选择性必修1(SJ)专题3第四单元 沉淀溶解平衡课时1 沉淀溶解平衡及其应用(已下线)专题3.4.2 沉淀溶解平衡的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)北京市首都师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省哈尔滨市第一六二中学2021-2022学年高二上学期期末考试化学试题(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)江西省遂川中学2021-2022学年高二上学期第二次月考化学(A卷)试题黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题江苏省天一中学2021-2022学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省黄陵中学2021-2022学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山西省太原师范学院附属中学2022-2023学年高二上学期12月月考化学试题山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题新疆阿克苏市实验中学2022-2023学年高二上学期期末考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第52练 难溶电解质的溶解平衡3.4.1沉淀溶解平衡原理 课后(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)作业(二十一) 沉淀溶解平衡的应用
名校
解题方法
5 . 含铬电镀废水的主要成分如下表,常用“ 沉淀法”和“药剂还原沉淀法”进行处理。
沉淀法”和“药剂还原沉淀法”进行处理。
Ⅰ.“ 沉淀法”工艺流程如下图。
沉淀法”工艺流程如下图。
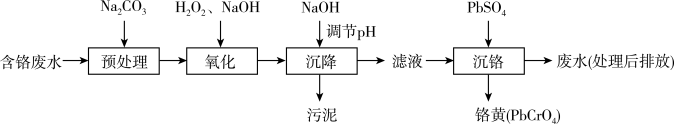
金属离子沉淀完全时( )及沉淀开始溶解时的pH如下。
)及沉淀开始溶解时的pH如下。
(1)“氧化”过程中 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
(2)“沉降”过程中应调节pH范围是_______ ~10.5。
(3)已知25℃时 、
、 ;
;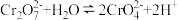 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
Ⅱ.“药剂还原沉淀法”工艺流程如下图。
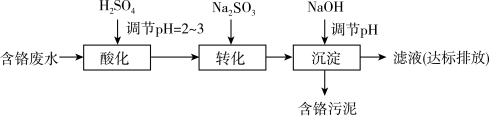
(4)“还原”过程中, 被Cr(Ⅵ)氧化为
被Cr(Ⅵ)氧化为_______ 。
(5)比较“ 沉淀法”和“药剂还原沉淀法”工艺的优劣
沉淀法”和“药剂还原沉淀法”工艺的优劣_______ (写出一条即可)。
 沉淀法”和“药剂还原沉淀法”进行处理。
沉淀法”和“药剂还原沉淀法”进行处理。| 离子 | Cr(Ⅵ) |  |  |  |  |
含量/ | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
Ⅰ.“
 沉淀法”工艺流程如下图。
沉淀法”工艺流程如下图。
金属离子沉淀完全时(
 )及沉淀开始溶解时的pH如下。
)及沉淀开始溶解时的pH如下。| 金属离子 |  |  |  |  |  | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | - | 13.5 | 14.0 | 10.5 | 12.0 | |
(1)“氧化”过程中
 转化为
转化为 的离子方程式为
的离子方程式为(2)“沉降”过程中应调节pH范围是
(3)已知25℃时
 、
、 ;
;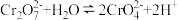 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
Ⅱ.“药剂还原沉淀法”工艺流程如下图。

(4)“还原”过程中,
 被Cr(Ⅵ)氧化为
被Cr(Ⅵ)氧化为(5)比较“
 沉淀法”和“药剂还原沉淀法”工艺的优劣
沉淀法”和“药剂还原沉淀法”工艺的优劣
您最近一年使用:0次
2022-04-02更新
|
473次组卷
|
2卷引用:湖南省常德市澧县第一中学2021-2022学年高三下学期期中考试化学试题
名校
解题方法
6 . 从废感光胶片中回收银的流程如下,相关离子方程式错误的是


A.FeCl3溶液呈酸性: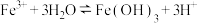 |
B.反应①: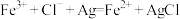 |
C.反应②: |
D.反应③: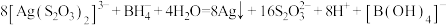 |
您最近一年使用:0次
2022-04-02更新
|
654次组卷
|
5卷引用:湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题
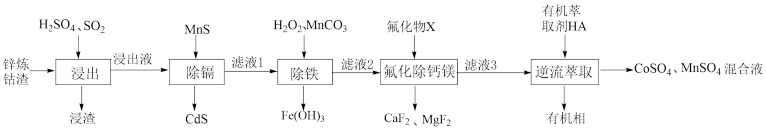
7 . 以经焙烧处理的锌冶炼钴渣(主要含有 、
、 、
、 、
、 ,少量
,少量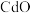 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备电池级
等杂质)为原料制备电池级 、
、 混合液的工艺流程如下:
混合液的工艺流程如下:
已知:常温下,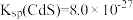 ,
,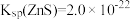 。
。
回答下列问题:
(1)“浸渣”的主要成分是___________ 。
(2)“浸出”时, 转化为
转化为 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(3)若溶液中金属离子浓度为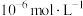 ,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保
,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保 恰好沉淀完全而
恰好沉淀完全而 不沉淀,
不沉淀,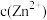 的值有何要求?
的值有何要求?___________ (列式计算说明)。
(4)“氟化物 ”为___________(填标号)。
”为___________(填标号)。
(5)萃取时,发生反应: 。采取“逆流萃取”的作用是
。采取“逆流萃取”的作用是___________ ,有机相可通过硫酸处理后得到的副产品为___________ (填化学式)。
 、
、 、
、 、
、 ,少量
,少量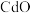 、
、 、
、 、
、 、
、 、
、 等杂质)为原料制备电池级
等杂质)为原料制备电池级 、
、 混合液的工艺流程如下:
混合液的工艺流程如下:
已知:常温下,
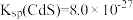 ,
,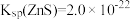 。
。回答下列问题:
(1)“浸渣”的主要成分是
(2)“浸出”时,
 转化为
转化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(3)若溶液中金属离子浓度为
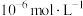 ,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保
,则认为该离子可忽略不计或沉淀完全。“除镉”时,为了确保 恰好沉淀完全而
恰好沉淀完全而 不沉淀,
不沉淀,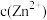 的值有何要求?
的值有何要求?(4)“氟化物
 ”为___________(填标号)。
”为___________(填标号)。A. | B. | C. | D. |
 。采取“逆流萃取”的作用是
。采取“逆流萃取”的作用是
您最近一年使用:0次
8 . 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知 =0.29)。下列分析正确的是
=0.29)。下列分析正确的是
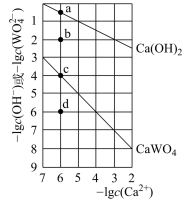
 =0.29)。下列分析正确的是
=0.29)。下列分析正确的是
| A.由图可知常温下Ksp(CaWO4)<Ksp[Ca(OH)2] |
| B.室温下饱和Ca(OH)2溶液中加入少量CaO,溶液变浑浊,恢复至室温,Ca(OH)2的Ksp不变,钙离子浓度不变 |
C.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合:c(WO )<c(Ca2+)<c(H+)<c(OH—) )<c(Ca2+)<c(H+)<c(OH—) |
| D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液组成沿da线向c点移动(假设混合后溶液体积不变) |
您最近一年使用:0次
2022-03-17更新
|
175次组卷
|
2卷引用:湖南省常德市临澧县第一中学2021-2022学年高三下学期开学考试化学试题
名校
9 . SO2虽是大气污染物之一,但也是重要的工业原料。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜。镍等金属化合物)作燃煤尾气脱硫剂,简化流程如图所示。下列说法错误的是


| A.软锰矿浆吸收SO2反应的主要化学方程式为MnO2+SO2=MnSO4 |
| B.MnCO3的作用是通过调节pH沉淀铁离子和铝离子,若换为KOH可以达到更好的效果 |
| C.MnS除铜、镍过程是将Cu2+转化为Cu2S,Ni2+转化为NiS |
| D.该流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2,达到变废为宝的目的 |
您最近一年使用:0次
2022-03-17更新
|
220次组卷
|
3卷引用:湖南省常德市临澧县第一中学2021-2022学年高三下学期开学考试化学试题
名校
解题方法
10 . 六氟锑酸钠(NaSbF6)广泛用于有机合成、光化学反应中的催化剂、蚀刻剂及医药中间体,一种由锑矿粉(主要含Sb2O3、Fe2O3,还含有少量Sb2O5、Sb2S3、CuS等)合成六氟锑酸钠的工艺流程如图所示:

已知:①Sb的氧化物及氢氧化物的性质与Al的类似; 可溶于NaOH溶液。
可溶于NaOH溶液。
②常温下,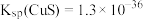 、
、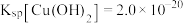 。
。
③ 难溶于水。
难溶于水。
请回答下列问题:
(1) 中Sb的化合价为
中Sb的化合价为_______ 。
(2)“碱浸”时,若 转化为
转化为 ,则
,则 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(3)“碱浸渣”的主要成分为_______ (填化学式)。
(4)“除杂”时,当溶液中出现蓝色沉淀,停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的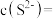
_______ 。
(5)“转化”过程中需先向溶液中加入浓NaOH溶液,加热至适当温度后,慢慢滴入30%H2O2溶液进行氧化回流。则“转化”步骤发生反应的化学方程式为_______ 。
(6)已知“系列操作”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则“氟化”时发生反应的离子方程式为_______ 。
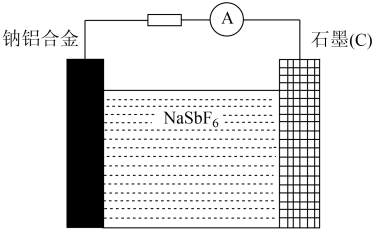
(7)以六氟锑酸钠为离子导体的新型钠离子可充电电池的结构如图,该电池放电时的工作原理为 ,则放电时,石墨电极上的电极反应式为
,则放电时,石墨电极上的电极反应式为_______ 。

已知:①Sb的氧化物及氢氧化物的性质与Al的类似;
 可溶于NaOH溶液。
可溶于NaOH溶液。②常温下,
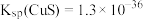 、
、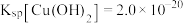 。
。③
 难溶于水。
难溶于水。 请回答下列问题:
(1)
 中Sb的化合价为
中Sb的化合价为(2)“碱浸”时,若
 转化为
转化为 ,则
,则 与
与 反应的离子方程式为
反应的离子方程式为(3)“碱浸渣”的主要成分为
(4)“除杂”时,当溶液中出现蓝色沉淀,停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的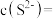
(5)“转化”过程中需先向溶液中加入浓NaOH溶液,加热至适当温度后,慢慢滴入30%H2O2溶液进行氧化回流。则“转化”步骤发生反应的化学方程式为
(6)已知“系列操作”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则“氟化”时发生反应的离子方程式为
(7)以六氟锑酸钠为离子导体的新型钠离子可充电电池的结构如图,该电池放电时的工作原理为
 ,则放电时,石墨电极上的电极反应式为
,则放电时,石墨电极上的电极反应式为
您最近一年使用:0次



