名校
1 . 下列实验方案设计、现象和结论都正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 向某无色溶液中滴加浓盐酸 | 产生的气体能使品红溶液褪色 | 原溶液中一定含有 SO 或HSO 或HSO |
| B | 向NaAlO2溶液中滴加 NaHCO3溶液 | 有白色浑浊出现,并产生气体 | AlO 和HCO 和HCO 发生了相互促进的水解 发生了相互促进的水解 |
| C | 向等浓度NaCl和NaBr混合溶液中滴加少量AgNO3溶液并振荡 | 沉淀呈浅黄色 | Ksp(AgCl)>Ksp(AgBr) |
| D | 向 NaBr 溶液中先通入过量氯气,后滴加淀粉-KI溶液 | 溶液先变橙色,后变蓝色 | 非金属性:Cl>Br>I |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 以湿法炼锌厂所产的钴锰渣(主要成分为 Co2O3、CoO、NiO、MnO2,含少量 Fe2O3、ZnO、CuO、CaO 等)为原料回收制备 CoC2O4 的工艺如下:

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体_______ ,说出该气体的一种用途_______ 。
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为_______ 。
(3)试分析Cu2+主要以_______ [填“CuS”或“Cu(OH)2”]形式除去。
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为_______ mol (用含 a、b 的式子表示)。
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。
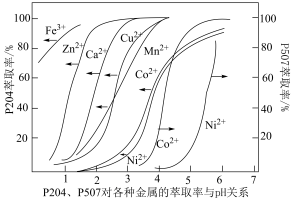
①直接用于分离钴镍的萃取剂是_______ 。
②指出分离钴镍的合适pH范围为_______ (填标号)。
A.3~4 B.4~5 C.5~6 D.6~7

已知:“酸浸”后溶液中含有 Co2+、Mn2+、Ni2+、Fe2+、Zn2+、Ca2+、Cu2+。常温下, Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15;Ksp(CuS)=1.3×10-36,Ksp[Cu(OH)2]=2.2×10-20, Ksp(ZnS)=1.3×10-24。回答下列问题:
(1)“酸浸”时可能产生有毒气体
(2)“氧化调 pH”过程中得到KFe3(SO4)2(OH)6的离子方程式为
(3)试分析Cu2+主要以
(4)“滤渣 3”中含有 a mol S、b mol MnO2,则理论上需要Co(OH)3的物质的量为
(5)采用双萃取剂 P204、P507 分离钴镍。P204、P507 对金属离子的萃取率与 pH 的关系如下图所示。

①直接用于分离钴镍的萃取剂是
②指出分离钴镍的合适pH范围为
A.3~4 B.4~5 C.5~6 D.6~7
您最近一年使用:0次
名校
解题方法
3 . 以β-锂辉石(主要成分为 Li2O、Al2O3、SiO2,含 FeO、Fe2O3、MgO 等少量杂质)为原料制备Li2CO3 的工艺流程如下:

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH 分别为3.2、5.2、9.7 和12.4 ;下列说法错误的是

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH 分别为3.2、5.2、9.7 和12.4 ;下列说法错误的是
| A.滤渣Ⅰ的主要成分为 SiO2 |
| B.母液中可回收得到副产品 Na2SO4 |
| C.试剂 X 为 NaOH 溶液 |
| D.相同条件下,溶解度:Li2SO4>Li2CO3 |
您最近一年使用:0次
名校
解题方法
4 . 钪(Sc)元素在国防、航天、激光、核能、医疗等方面有广泛应用。我国某地的矿山富含铜多金属矿(主要含Cu2S、Sc2S3、FeS、CaS和SiO2),科研人员从矿石中综合回收金属钪的工艺流程设计如下:

已知:①"萃取"时发生反应有: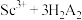 (有机液)
(有机液) Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液) Fe(HA2)3+3H+
Fe(HA2)3+3H+
②常温下,“萃取”前溶液中 c(Sc3+)=0.60 ,Ksp[Sc(OH)3]=6.0
,Ksp[Sc(OH)3]=6.0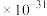 ;
;
请回答下列问题:
(1)“加热酸溶”时需要搅拌,目的是___________ ,产生的气体是___________ (写化学式)。
(2)滤渣Ⅱ的主要成分为___________ 。
(3)“萃取”过程中需控制好“萃取”前溶液pH,过大或者过小都会影响有机试剂的Sc3+萃取率,计算Sc3+萃取率最大时的pH=___________ 。
(4)已知25℃时,Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3 +6H+,该反应的平衡常数K=
+6H+,该反应的平衡常数K=___________ (用含a、b、c的代数式表示)。
(5)在空气中煅烧生成Sc2O3的化学方程式为___________ 。
(6)“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,液态锌是___________ (填“阳极”或“阴极”),阳极反应式为___________ 。

已知:①"萃取"时发生反应有:
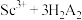 (有机液)
(有机液) Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+;Fe3++3H2A2(有机液) Fe(HA2)3+3H+
Fe(HA2)3+3H+②常温下,“萃取”前溶液中 c(Sc3+)=0.60
 ,Ksp[Sc(OH)3]=6.0
,Ksp[Sc(OH)3]=6.0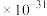 ;
;请回答下列问题:
(1)“加热酸溶”时需要搅拌,目的是
(2)滤渣Ⅱ的主要成分为
(3)“萃取”过程中需控制好“萃取”前溶液pH,过大或者过小都会影响有机试剂的Sc3+萃取率,计算Sc3+萃取率最大时的pH=
(4)已知25℃时,Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3
 +6H+,该反应的平衡常数K=
+6H+,该反应的平衡常数K=(5)在空气中煅烧生成Sc2O3的化学方程式为
(6)“电解”过程中,用石墨和液态锌作电极,KCl、LiCl、ScCl3熔融物作电解液,液态锌是
您最近一年使用:0次
名校
5 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是 、
、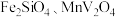 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示: 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,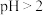 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1) 中
中 为
为 价,
价, 的化合价为
的化合价为_______ ;基态 原子价层电子排布图为
原子价层电子排布图为_______ 。
(2)“焙烧Ⅰ”中将 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为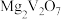 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有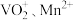 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到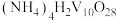 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液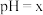 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
_______ 。
 、
、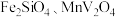 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示: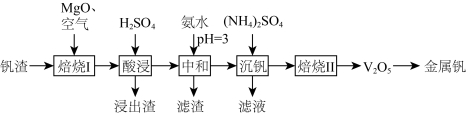
 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中,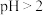 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时 的 的 | 3.2 | 9.0 | 10.1 | 10.9 |
(1)
 中
中 为
为 价,
价, 的化合价为
的化合价为 原子价层电子排布图为
原子价层电子排布图为(2)“焙烧Ⅰ”中将
 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将 转化为
转化为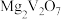 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
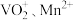 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
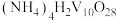 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液
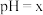 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
您最近一年使用:0次
2023-07-01更新
|
111次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期5月月考化学试题
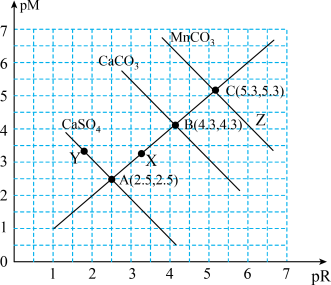
6 . 25℃时,难溶盐CaSO4、CaCO3、MnCO3溶液中阳离子浓度的负对数 和阴离子浓度的负对数
和阴离子浓度的负对数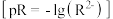 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
 和阴离子浓度的负对数
和阴离子浓度的负对数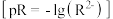 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A.25℃,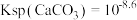 |
| B.向A点对应的溶液中加入固体CaCl2,可得到Y点对应的溶液 |
| C.25℃,三种物质的溶解度:MnCO3<CaCO3<CaSO4 |
| D.25℃,向100mLMnCO3饱和溶液中加入0.01mol CaCl2(s),有CaCO3沉淀生成 |
您最近一年使用:0次
7 . 以废锌催化剂(主要成分为ZnO 及少量Fe2O3、CuO、MnO、SiO2)为原料制备锌的流程如下:

已知:①“浸取”时,ZnO、CuO转化为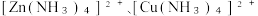 进入溶液;②25℃时, Ksp
进入溶液;②25℃时, Ksp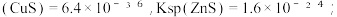 ③深度除杂标准:溶液中
③深度除杂标准:溶液中 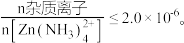
(1)“滤渣1”的主要成分为 Mn(OH)2、SiO2和_______ 。
(2)“深度除锰”是在碱性条件下将残留的Mn2+转化为MnO2,离子方程式为_______ 。
(3)“深度除铜”时,锌的最终回收率、[除铜效果以反应后溶液中铜锌比 表示]与“(NH4)2S 加入量”[以
表示]与“(NH4)2S 加入量”[以 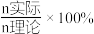 表示]的关系曲线如图所示。
表示]的关系曲线如图所示。
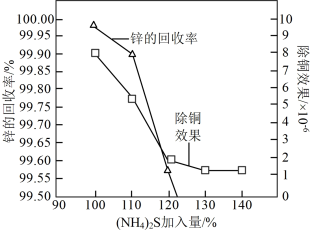
①当(NH4)2S加入量≥100%时,锌的最终回收率下降的原因是_______ (用离子方程式表示),该反应的平衡常数为_______ 。{已知 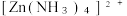 的
的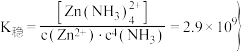
②“深度除铜”时(NH4)2S加入量最好应选_______ (填字母)。
A.100% B.110% C.120% D.130%
(4)ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。
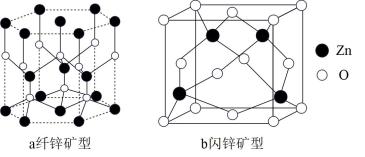
①图a纤锌矿型ZnO晶体中O2-的配位数为_______ 。
②图b闪锌矿型晶胞密度为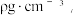 则Zn2+与(O2-的距离为
则Zn2+与(O2-的距离为_______ nm。(设NA为阿伏加德罗常数的值)

已知:①“浸取”时,ZnO、CuO转化为
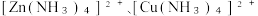 进入溶液;②25℃时, Ksp
进入溶液;②25℃时, Ksp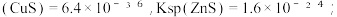 ③深度除杂标准:溶液中
③深度除杂标准:溶液中 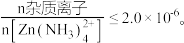
(1)“滤渣1”的主要成分为 Mn(OH)2、SiO2和
(2)“深度除锰”是在碱性条件下将残留的Mn2+转化为MnO2,离子方程式为
(3)“深度除铜”时,锌的最终回收率、[除铜效果以反应后溶液中铜锌比
 表示]与“(NH4)2S 加入量”[以
表示]与“(NH4)2S 加入量”[以 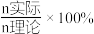 表示]的关系曲线如图所示。
表示]的关系曲线如图所示。
①当(NH4)2S加入量≥100%时,锌的最终回收率下降的原因是
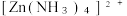 的
的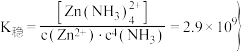
②“深度除铜”时(NH4)2S加入量最好应选
A.100% B.110% C.120% D.130%
(4)ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,如图结构。

①图a纤锌矿型ZnO晶体中O2-的配位数为
②图b闪锌矿型晶胞密度为
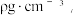 则Zn2+与(O2-的距离为
则Zn2+与(O2-的距离为
您最近一年使用:0次
名校
解题方法
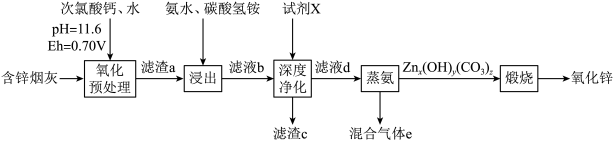
8 . 氧化锌是一种白色粉末,可溶于酸、氢氧化钠溶液、氨水和氨水铵盐缓冲溶液中,它在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种由含锌烟灰(含有 、
、 等)制备氧化锌的工艺流程如图所示。
等)制备氧化锌的工艺流程如图所示。
已知:ⅰ)四价铅的氧化性大于次氯酸钙的氧化性;
ⅱ)二价金属氧化物能分别与氨络合,如 (Ⅱ)、
(Ⅱ)、 (Ⅱ)可生成
(Ⅱ)可生成 、
、 ;
;
ⅲ)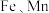 元素对应优势微粒与溶液的
元素对应优势微粒与溶液的 及氧化剂氧化电位(
及氧化剂氧化电位( )关系如图:
)关系如图:

ⅳ) 时相关物质的
时相关物质的 见下表:
见下表:
回答下列问题:
(1)“氧化预处理”时,加入 溶液的目的为
溶液的目的为_______ ,写出该过程中含铁物质发生反应的离子方程式:_______ 。
(2)“深度净化”时,可采用以下两种方案:
方案甲:加入足量锌粉。该方案所得滤渣c中除了含Zn、Cd之外,还含有_______ (填化学式)。
方案乙:加入Na2S粉末。已知杂质离子浓度较为接近且远小于含锌离子的浓度。则杂质离子生成沉淀的先后顺序依次为_______ (写沉淀的化学式);工业生产中常采用方案甲而不采用方案乙,其原因为_______ 。
(3)“蒸氨”时得到混合气体e和固体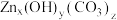 。混合气体e可返回至
。混合气体e可返回至_______ 工序循环利用;取 固体,经充分“搬烧”后得到氧化锌
固体,经充分“搬烧”后得到氧化锌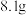 ,同时产生的气体通入到足量
,同时产生的气体通入到足量 溶液中,可得沉淀
溶液中,可得沉淀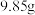 ,则固体
,则固体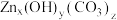 的化学式为
的化学式为_______ 。
(4)通过氢电极增压法可利用产品氧化锌进一步制得单质锌(如图),电解池中发生总反应的离子方程式为_______ 。

 、
、 等)制备氧化锌的工艺流程如图所示。
等)制备氧化锌的工艺流程如图所示。
已知:ⅰ)四价铅的氧化性大于次氯酸钙的氧化性;
ⅱ)二价金属氧化物能分别与氨络合,如
 (Ⅱ)、
(Ⅱ)、 (Ⅱ)可生成
(Ⅱ)可生成 、
、 ;
;ⅲ)
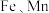 元素对应优势微粒与溶液的
元素对应优势微粒与溶液的 及氧化剂氧化电位(
及氧化剂氧化电位(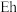 )关系如图:
)关系如图:
ⅳ)
 时相关物质的
时相关物质的 见下表:
见下表:| 物质 |  |  |  |  |  |  |
 | 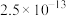 |  |  | 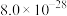 | 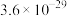 |  |
(1)“氧化预处理”时,加入
 溶液的目的为
溶液的目的为(2)“深度净化”时,可采用以下两种方案:
方案甲:加入足量锌粉。该方案所得滤渣c中除了含Zn、Cd之外,还含有
方案乙:加入Na2S粉末。已知杂质离子浓度较为接近且远小于含锌离子的浓度。则杂质离子生成沉淀的先后顺序依次为
(3)“蒸氨”时得到混合气体e和固体
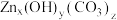 。混合气体e可返回至
。混合气体e可返回至 固体,经充分“搬烧”后得到氧化锌
固体,经充分“搬烧”后得到氧化锌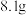 ,同时产生的气体通入到足量
,同时产生的气体通入到足量 溶液中,可得沉淀
溶液中,可得沉淀 ,则固体
,则固体 的化学式为
的化学式为(4)通过氢电极增压法可利用产品氧化锌进一步制得单质锌(如图),电解池中发生总反应的离子方程式为

您最近一年使用:0次
2023-05-26更新
|
214次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
9 . 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡: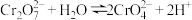
回答下列问题:
(1)探究外界因素对该平衡的影响。取三支相同(标号1,2,3)试管盛有相同体积 溶液进行实验,完成下列表格中的填空。
溶液进行实验,完成下列表格中的填空。
(2)利用(1)中所得溶液A、B探究pH对 溶液的氧化性强弱的影响。完成表格中的填空。
溶液的氧化性强弱的影响。完成表格中的填空。
(3)在化学分析中采用 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中
生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中 时,此时溶液中
时,此时溶液中 等于
等于_______  。[已知
。[已知 ]
]
 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡: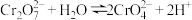
回答下列问题:
(1)探究外界因素对该平衡的影响。取三支相同(标号1,2,3)试管盛有相同体积
 溶液进行实验,完成下列表格中的填空。
溶液进行实验,完成下列表格中的填空。| 实验操作 | 实验现象 | 实验结论 |
| 向试管1中加入几滴浓NaOH溶液,得溶液A | 溶液变为① | 其他条件不变时,减小② |
| 向试管2中加入几滴较浓H2SO4溶液,得溶液B | 溶液变为④ | 其他条件不变时,增大生成物浓度,平衡向逆反应方向移动 |
| 向试管2中加入FeSO4,再加入适量NaOH溶液 | 先形成蓝紫色溶液,加入NaOH溶液后产生红褐色沉淀和⑤ | K2Cr2O7溶液具有氧化性,产物不溶于适量NaOH溶液 |
 溶液的氧化性强弱的影响。完成表格中的填空。
溶液的氧化性强弱的影响。完成表格中的填空。| 实验操作 | 实验现象 | 实验结论 |
| 相同量的溶液A、B中分别加入相同量甲醇溶液 | 向溶液A无明显现象,溶液B形成蓝紫色溶液 |
 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中
生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中 时,此时溶液中
时,此时溶液中 等于
等于 。[已知
。[已知 ]
]
您最近一年使用:0次
名校
10 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将少量醋酸滴入 溶液中 溶液中 | 未产生明显气泡 | 酸性: |
| B | 向盛有相同体积、浓度的 溶液的两支试管中分别滴加 溶液的两支试管中分别滴加 和 和 HI溶液,观察出现棕黄色现象的时间 HI溶液,观察出现棕黄色现象的时间 | 后者出现棕黄色时间短 | 其他条件不变时,一般浓度越大,该反应化学反应速率越快 |
| C | 将装有相同质量 和 和 的混合气的两支烧瓶分别置于热水、冰水中 的混合气的两支烧瓶分别置于热水、冰水中 | 浸泡在热水中的烧瓶红棕色更深 |   |
| D | 向盛有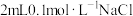 溶液滴加2滴等浓度 溶液滴加2滴等浓度 溶液,悬浊液静置,取上层清液,滴入少量稀NaI溶液 溶液,悬浊液静置,取上层清液,滴入少量稀NaI溶液 | 出现黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



