名校
解题方法
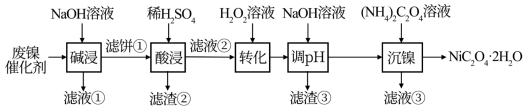
1 . 金属镍及其化合物有极高的实用价值,可以制备储氢合金、新型镍氢电池及耐腐蚀的合金,还是一种很好的催化剂。某油脂厂废弃的镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其它不溶性物质。采用如下工艺流程制备草酸镍晶体( ):
):
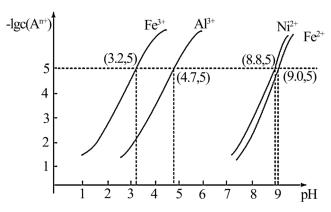
已知①当溶液中某离子浓度小于 mol/L时认为沉淀完全;
mol/L时认为沉淀完全;
② 的电离平衡常数
的电离平衡常数 ;
; 的电离平衡常数
的电离平衡常数 、
、 。
。
③溶液中金属离子浓度用 表示,
表示, 随溶液pH变化的图象如图所示:
随溶液pH变化的图象如图所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是:溶解金属铝及其氧化物、_______ 。
(2)保持其它条件相同,在不同温度下进行酸浸时,镍浸出率随时间变化如图所示:
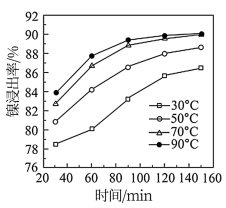
则“酸浸”的适宜温度和时间分别为_______ (填字母)。
a.30℃、30min b.90℃、150min c.70℃、120min
(3)滤渣③的主要成分是_______ (填化学式)。
(4) 溶液呈
溶液呈_______ 性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序是_______ 。
(5)根据题目中的数据计算 的Ksp=
的Ksp=_______ 。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是_______ 。
 ):
):
已知①当溶液中某离子浓度小于
 mol/L时认为沉淀完全;
mol/L时认为沉淀完全;②
 的电离平衡常数
的电离平衡常数 ;
; 的电离平衡常数
的电离平衡常数 、
、 。
。③溶液中金属离子浓度用
 表示,
表示, 随溶液pH变化的图象如图所示:
随溶液pH变化的图象如图所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是:溶解金属铝及其氧化物、
(2)保持其它条件相同,在不同温度下进行酸浸时,镍浸出率随时间变化如图所示:

则“酸浸”的适宜温度和时间分别为
a.30℃、30min b.90℃、150min c.70℃、120min
(3)滤渣③的主要成分是
(4)
 溶液呈
溶液呈(5)根据题目中的数据计算
 的Ksp=
的Ksp= 浓度为
浓度为 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是
您最近一年使用:0次
2022-10-09更新
|
489次组卷
|
3卷引用:湖南省常德市临澧县第一中学2022-2023学年高二上学期第一次阶段性考试化学试题
名校
解题方法
2 . 透明铁黄(FeOOH)是一种分散性良好的铁系颜料。工业上采用硫铁矿熔烧去硫后烧渣(主要成分为 、FeO、
、FeO、 、
、 、不考虑其他杂质)制备透明铁黄工艺流程如下:
、不考虑其他杂质)制备透明铁黄工艺流程如下:
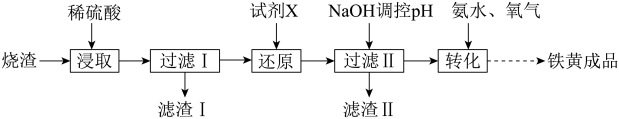
(1)浸取液中 的核外电子排布式为
的核外电子排布式为_______ 。
(2)“过滤I”后,滤液中所含金属阳离子有_______ 。
(3)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为_______ 。
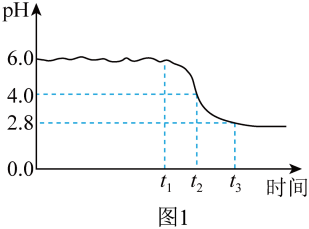
(4)制备铁黄:向一定浓度 溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
已知:25℃时, 完全沉淀(离子浓度
完全沉淀(离子浓度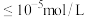 )的
)的 。
。
①滴加氨水产生沉淀,当pH为6.0时,溶液中残留 浓度为
浓度为_______ mol/L。
②请写出0~ 时段发生的化学方程式
时段发生的化学方程式_______ ; ~
~ 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:_______ 。
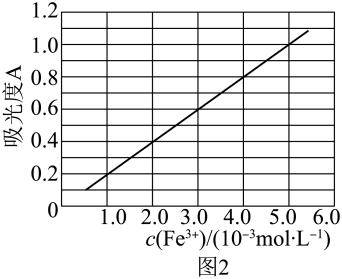
(5)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。_______
 、FeO、
、FeO、 、
、 、不考虑其他杂质)制备透明铁黄工艺流程如下:
、不考虑其他杂质)制备透明铁黄工艺流程如下:
(1)浸取液中
 的核外电子排布式为
的核外电子排布式为(2)“过滤I”后,滤液中所含金属阳离子有
(3)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为
(4)制备铁黄:向一定浓度
 溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
已知:25℃时,
 完全沉淀(离子浓度
完全沉淀(离子浓度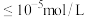 )的
)的 。
。①滴加氨水产生沉淀,当pH为6.0时,溶液中残留
 浓度为
浓度为②请写出0~
 时段发生的化学方程式
时段发生的化学方程式 ~
~ 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:(5)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知
 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
您最近一年使用:0次
2022-09-03更新
|
284次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月期中化学试题
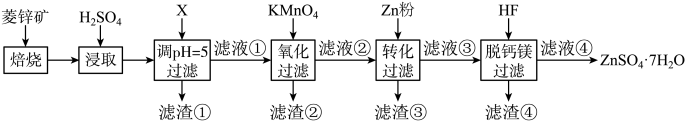
3 . 硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调溶液 ,最适宜使用的X是
,最适宜使用的X是_______ (填标号)。
A. B.
B. C.
C.
滤渣①的主要成分是_______ 、_______ 、_______ 。
(4)向 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是_______ 、_______ 。
| 离子 |  |  |  |  |  |
 | 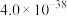 | 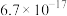 | 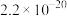 |  | 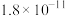 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调溶液
 ,最适宜使用的X是
,最适宜使用的X是A.
 B.
B. C.
C.
滤渣①的主要成分是
(4)向
 的滤液①中分批加入适量
的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有
溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为
,该步反应的离子方程式为(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓
 反应可以释放HF并循环利用,同时得到的副产物是
反应可以释放HF并循环利用,同时得到的副产物是
您最近一年使用:0次
2022-06-08更新
|
25765次组卷
|
34卷引用:湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题
湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题2022年高考全国甲卷化学真题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题15 工艺流程综合题-备战2023年高考化学母题题源解密(全国通用)陕西省西安市长安区第一中学2021-2022学年高二下学期期末考试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题云南省部分重点中学2022-2023学年高三上学期月考化学试题河北省石家庄市第四十三中学2022-2023学年高三上学期10月月考化学试题河南省濮阳市南乐县第一高级中学2022-2023学年高三上学期9月月考化学试题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题河南省宋基信阳实验中学2022-2023学年高三上学期11月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高二12月月考化学试题山东省德州市第一中学2022-2023学年高二上学期期末线上考试化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程超重点6 高考热点命题素材——过渡金属元素湖北省襄阳市第五中学2022-2023学年高二上学期12月月考化学试题(已下线)题型38 其他金属的冶炼(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)回归教材重难点04 “9种”物质的性质及应用-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省江油中学2023-2024学年高三上学期9月月考理科综合化学试题上海市复旦大学附属中学2023-2024学年高二上学期期中考试化学试卷湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建云南省宣威市第九中学2023-2024学年高三下学期入学考试理综试题-高中化学四川省甘孜藏族自治州某重点中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 . 碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
完成下列填空:
(1)反应I后的溶液中存在的阳离子有____ 。
(2)加入少量NaHCO3的目的是将溶液的pH调节在____ 范围内,从而使溶液中的____ ,该工艺中“搅拌”的作用是____ 。
(3)反应II加入NaNO2的目的是氧化Fe2+,反应的离子方程式为____ 。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约了NaNO2___ g。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+可部分水解生成[Fe2(OH)4]2+聚合离子,该水解反应的离子方程式为____ 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO 。为检验所得产品中是否含有Fe2+,应使用的试剂为
。为检验所得产品中是否含有Fe2+,应使用的试剂为___ (选填序号)。
a.氯水 b.KSCN溶液 c.NaOH溶液 d.酸性KMnO4溶液

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I后的溶液中存在的阳离子有
(2)加入少量NaHCO3的目的是将溶液的pH调节在
(3)反应II加入NaNO2的目的是氧化Fe2+,反应的离子方程式为
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+可部分水解生成[Fe2(OH)4]2+聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO
 。为检验所得产品中是否含有Fe2+,应使用的试剂为
。为检验所得产品中是否含有Fe2+,应使用的试剂为a.氯水 b.KSCN溶液 c.NaOH溶液 d.酸性KMnO4溶液
您最近一年使用:0次
名校
5 . 室温下,某小组设计下列实验探究含银化合物的转化。
实验1:向4mL0.01mol/LAgNO3溶液中加入2mL0.01mol/LNaCl溶液,产生白色沉淀。
实验2:向实验1所得悬浊液中加入2mL0.01mol/LNaBr溶液,产生淡黄色沉淀,过滤。
实验3:向实验2所得淡黄色沉淀中滴入一定量Na2S溶液,产生黑色沉淀,过滤。
已知:室温下Ksp(AgCl)=2×10-10。
下列说法正确的是
实验1:向4mL0.01mol/LAgNO3溶液中加入2mL0.01mol/LNaCl溶液,产生白色沉淀。
实验2:向实验1所得悬浊液中加入2mL0.01mol/LNaBr溶液,产生淡黄色沉淀,过滤。
实验3:向实验2所得淡黄色沉淀中滴入一定量Na2S溶液,产生黑色沉淀,过滤。
已知:室温下Ksp(AgCl)=2×10-10。
下列说法正确的是
| A.实验1静置所得上层清液中c(Cl-)约为1.4×10-3mol/L |
| B.实验2的现象能够说明Ksp(AgCl)>Ksp(AgBr) |
| C.实验3所用Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+c(H2S) |
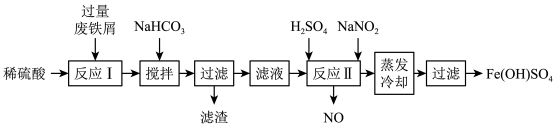
D.实验3过滤后所得清液中存在:c2(Ag+)=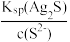 且c(Ag+)≤ 且c(Ag+)≤ |
您最近一年使用:0次
2022-05-07更新
|
695次组卷
|
5卷引用:湖南省澧县第一中学2022届高三下学期第三次模拟预测考试化学试题
6 . 由难溶性磷酸锂渣(主要成分为Li3PO4)为原料制备电池级Li2CO3的流程如下:

已知:①Li2CO3在不同温度下的溶解度: 0℃ 1.54g,20℃ 1.33g, 90℃ 0.78g。
②碳酸锂:水溶液煮沸时容易发生水解。
(1)溶解除磷。将一定量磷酸锂渣与CaCl2溶液、盐酸中的一种配成悬浊液,加入到三颈烧瓶中(装置如图),一段时间后,通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,得到LiCl溶液。
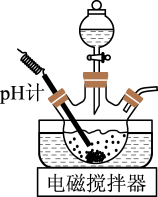
①滴液漏斗中的液体是_______ 。
②Li3PO4转化为LiCl和CaHPO4的离子方程式为_______ 。
(2)除钙。通过离子交换法除去溶液中Ca2+。若要使后续得到的Li2CO3 中不含CaCO3(设沉淀后溶液中Li+浓度为0.1 mol·L-1),需控制除钙后溶液中c(Ca2+)≤_______ 。[Ksp(Li2CO3)=2.5×10-2,Ksp(CaCO3)=2.8×10-9]
(3)制备Li2CO3。向除杂后的LiCl溶液中加入N235萃取剂(50%三辛癸烷基叔胺与50% ,异辛醇的混合液),边搅拌边向混合液中通CO2,过滤洗涤得到Li2CO3。
①方法能制得Li2CO3的原因是_______ 。
②检验滤渣是否洗涤完全的实验方法是_______ 。
(4)若粗品碳酸锂中含少量难溶性杂质,为获得较高产率的纯Li2CO3,请补充完整实验 方案:向粗品Li2CO3中加水,按一定速率通入CO2,边通边搅拌,_______ 。(已知:①LiHCO3受热易分解;②实验过程中Li2CO3转化速率与时间的关系图如图所示。)
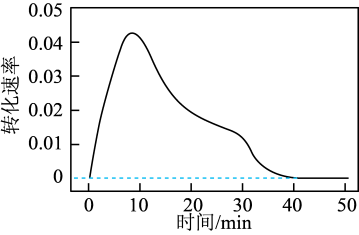

已知:①Li2CO3在不同温度下的溶解度: 0℃ 1.54g,20℃ 1.33g, 90℃ 0.78g。
②碳酸锂:水溶液煮沸时容易发生水解。
(1)溶解除磷。将一定量磷酸锂渣与CaCl2溶液、盐酸中的一种配成悬浊液,加入到三颈烧瓶中(装置如图),一段时间后,通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,得到LiCl溶液。

①滴液漏斗中的液体是
②Li3PO4转化为LiCl和CaHPO4的离子方程式为
(2)除钙。通过离子交换法除去溶液中Ca2+。若要使后续得到的Li2CO3 中不含CaCO3(设沉淀后溶液中Li+浓度为0.1 mol·L-1),需控制除钙后溶液中c(Ca2+)≤
(3)制备Li2CO3。向除杂后的LiCl溶液中加入N235萃取剂(50%三辛癸烷基叔胺与50% ,异辛醇的混合液),边搅拌边向混合液中通CO2,过滤洗涤得到Li2CO3。
①方法能制得Li2CO3的原因是
②检验滤渣是否洗涤完全的实验方法是
(4)若粗品碳酸锂中含少量难溶性杂质,为获得较高产率的纯Li2CO3,请补充完整实验 方案:向粗品Li2CO3中加水,按一定速率通入CO2,边通边搅拌,

您最近一年使用:0次
2022-05-07更新
|
837次组卷
|
3卷引用:湖南省澧县第一中学2022届高三下学期第三次模拟预测考试化学试题
名校
解题方法
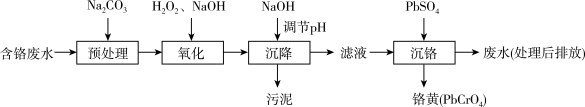
7 . 含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和”药剂还原沉淀法”进行处理。
I.“Pb2+沉淀法”工艺流程如图。
金属离子沉淀完全时(c=1.0×10-5mol•L-1)及沉淀开始溶解时的pH如表。
(1)“氧化”过程中Cr(OH)3转化为CrO 的离子方程式为
的离子方程式为____ 。
(2)“沉降”过程中应调节pH范围是____ ~10.5。
(3)已知25℃是Ksp(PbSO4)=2.5×10-8;Ksp(PbCrO4)=2.8×10-13;Cr2O +H2O
+H2O 2CrO
2CrO +2H+。“沉铬”过程中:
+2H+。“沉铬”过程中:
①生成铬黄的离子方程式为____ 。
②从平衡角度分析pH对沉锋率的影响____ 。
II.“药剂还原沉淀法”工艺流程如图。
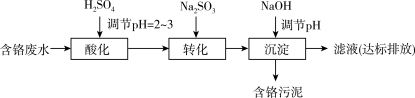
(4)“还原”过程中,SO 被Cr(VI)氧化为
被Cr(VI)氧化为____ 。
(5)“沉淀”过程中,当溶液pH为8.6时,c(Cr3+)=____ mol•L-1。
(6)比较“Pb2+沉淀法”和“药剂还原沉淀法”工艺的优劣____ (写出一条即可)。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量/mgL | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |

金属离子沉淀完全时(c=1.0×10-5mol•L-1)及沉淀开始溶解时的pH如表。
| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | - | 13.5 | 14.0 | 10.5 | 12.0 | |
 的离子方程式为
的离子方程式为(2)“沉降”过程中应调节pH范围是
(3)已知25℃是Ksp(PbSO4)=2.5×10-8;Ksp(PbCrO4)=2.8×10-13;Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+。“沉铬”过程中:
+2H+。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉锋率的影响
II.“药剂还原沉淀法”工艺流程如图。

(4)“还原”过程中,SO
 被Cr(VI)氧化为
被Cr(VI)氧化为(5)“沉淀”过程中,当溶液pH为8.6时,c(Cr3+)=
(6)比较“Pb2+沉淀法”和“药剂还原沉淀法”工艺的优劣
您最近一年使用:0次
2022-05-06更新
|
205次组卷
|
2卷引用:湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题
名校
解题方法
8 . 已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
| C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2 |
您最近一年使用:0次
9 . T℃下,三种硫酸盐M(M: )的沉淀溶解平衡曲线如图所示。已知
)的沉淀溶解平衡曲线如图所示。已知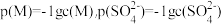 。下列说法正确的是
。下列说法正确的是

 )的沉淀溶解平衡曲线如图所示。已知
)的沉淀溶解平衡曲线如图所示。已知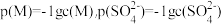 。下列说法正确的是
。下列说法正确的是
A.溶度积: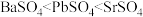 |
B.Y点对应的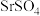 是过饱和溶液,能继续溶解 是过饱和溶液,能继续溶解 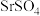 |
C.Z点对应的溶液中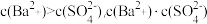 等于 等于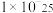 |
D. 能转化成 能转化成 |
您最近一年使用:0次
2022·江苏南通·模拟预测
名校
解题方法
10 . 实验小组以某铜渣(主要成分 、
、 ,含少量
,含少量 和
和 )为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[
)为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[ ]。实验包括如下过程:
]。实验包括如下过程:
(1)浸取。
将一定量的铜渣粉碎后加入到如图-1所示的三颈烧瓶中,再通过分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液体的间隔利用二连球鼓入O2,铜渣充分反应后,向溶液中加入少量 ,过滤。
,过滤。
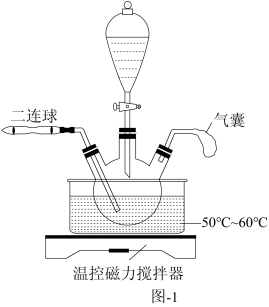
①已知浸取时无S和SO2生成,写出浸取时 所发生反应的离子方程式:
所发生反应的离子方程式:_______ 。
②滴加液体的间隔向三颈烧瓶内鼓入O2的目的是_______ 。
③当观察到_______ ,可以停止鼓入O2。
④加入 的目的是
的目的是_______ 。[已知 ]
]
(2)制取 。
。
向滤液中加入 溶液调节
溶液调节 范围为
范围为_______ ,过滤;向滤渣中加入稀硫酸至滤渣恰好完全溶解,得 溶液。{设
溶液。{设 、
、 开始沉淀时
开始沉淀时 ,沉淀完全时
,沉淀完全时 。
。 ,
, }
}
(3)制 。
。
已知 的产率{
的产率{ }随起始
}随起始 与
与 的比值和溶液pH的关系如图2所示。
的比值和溶液pH的关系如图2所示。
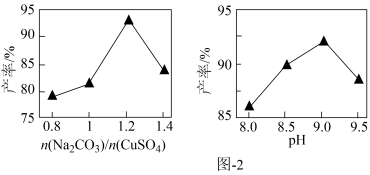
①补充完整制取 的实验方案:向烧杯中加入
的实验方案:向烧杯中加入 溶液,将烧杯置于70℃的水浴中,
溶液,将烧杯置于70℃的水浴中,_______ ,低温烘干,得到 。(实验中可选用的试剂或仪器:
。(实验中可选用的试剂或仪器: 溶液、
溶液、 溶液、
溶液、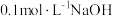 溶液、
溶液、 盐酸、pH计)
盐酸、pH计)
②实验时发现,若反应时溶液pH过大,所得 的产率偏低,但Cu元素含量偏大,原因是
的产率偏低,但Cu元素含量偏大,原因是_______ 。
 、
、 ,含少量
,含少量 和
和 )为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[
)为原料先制备硫酸铜,再由硫酸铜制备碱式碳酸铜[ ]。实验包括如下过程:
]。实验包括如下过程:(1)浸取。
将一定量的铜渣粉碎后加入到如图-1所示的三颈烧瓶中,再通过分液漏斗分批滴入稀硝酸和稀硫酸混合溶液,滴加液体的间隔利用二连球鼓入O2,铜渣充分反应后,向溶液中加入少量
 ,过滤。
,过滤。
①已知浸取时无S和SO2生成,写出浸取时
 所发生反应的离子方程式:
所发生反应的离子方程式:②滴加液体的间隔向三颈烧瓶内鼓入O2的目的是
③当观察到
④加入
 的目的是
的目的是 ]
](2)制取
 。
。向滤液中加入
 溶液调节
溶液调节 范围为
范围为 溶液。{设
溶液。{设 、
、 开始沉淀时
开始沉淀时 ,沉淀完全时
,沉淀完全时 。
。 ,
, }
}(3)制
 。
。已知
 的产率{
的产率{ }随起始
}随起始 与
与 的比值和溶液pH的关系如图2所示。
的比值和溶液pH的关系如图2所示。
①补充完整制取
 的实验方案:向烧杯中加入
的实验方案:向烧杯中加入 溶液,将烧杯置于70℃的水浴中,
溶液,将烧杯置于70℃的水浴中, 。(实验中可选用的试剂或仪器:
。(实验中可选用的试剂或仪器: 溶液、
溶液、 溶液、
溶液、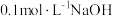 溶液、
溶液、 盐酸、pH计)
盐酸、pH计)②实验时发现,若反应时溶液pH过大,所得
 的产率偏低,但Cu元素含量偏大,原因是
的产率偏低,但Cu元素含量偏大,原因是
您最近一年使用:0次
2022-04-21更新
|
1252次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2021-2022学年高三下学期4月月考化学试题
湖南省常德市汉寿县第一中学2021-2022学年高三下学期4月月考化学试题(已下线)江苏省南通市如皋市2021-2022学年高三下学期 4月适应性考试(二)化学试题江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题



