名校
解题方法
1 . 三氧化二镍( )是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物,
)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物, ,C等)制备
,C等)制备 的工艺流程如下所示:
的工艺流程如下所示:
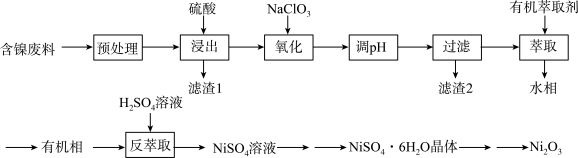
已知:①在该实验条件下 、
、 不能氧化
不能氧化 。
。
②常温下,溶液中0.010 mol/L金属离子形成氢氧化物沉淀的pH如下表所示:
③萃取的原理为 (水相)
(水相) (有机相)
(有机相)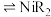 (有机相)
(有机相) (水相)
(水相)
回答下列问题:
(1)“预处理”时,可以用_______ (填化学式)溶液除去废料表面的油脂油污。
(2)“浸出”时,提高浸出效率可采取的措施有_______ (任写一种)。
(3)“氧化”时,加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)若常温下,“调pH”时,溶液中 浓度为0.1 mol/L,为使
浓度为0.1 mol/L,为使 等杂质离子沉淀完全(
等杂质离子沉淀完全(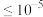 mol/L),经过计算,需控制溶液的pH范围是
mol/L),经过计算,需控制溶液的pH范围是_______ 。
(5)“萃取”时,操作若在实验室进行,需要用到的主要玻璃仪器有_______ 、烧杯。请利用化学平衡原理解释该流程中用 反萃取的原理
反萃取的原理_______ 。
 )是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物,
)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含Ni、Al、Fe的氧化物, ,C等)制备
,C等)制备 的工艺流程如下所示:
的工艺流程如下所示:
已知:①在该实验条件下
 、
、 不能氧化
不能氧化 。
。②常温下,溶液中0.010 mol/L金属离子形成氢氧化物沉淀的pH如下表所示:
离子 pH |  |  |  |  |
| 开始沉淀pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀pH | 8.7 | 4.7 | 3.2 | 9.0 |
 (水相)
(水相) (有机相)
(有机相)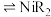 (有机相)
(有机相) (水相)
(水相)回答下列问题:
(1)“预处理”时,可以用
(2)“浸出”时,提高浸出效率可采取的措施有
(3)“氧化”时,加入
 发生反应的离子方程式为
发生反应的离子方程式为(4)若常温下,“调pH”时,溶液中
 浓度为0.1 mol/L,为使
浓度为0.1 mol/L,为使 等杂质离子沉淀完全(
等杂质离子沉淀完全(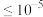 mol/L),经过计算,需控制溶液的pH范围是
mol/L),经过计算,需控制溶液的pH范围是(5)“萃取”时,操作若在实验室进行,需要用到的主要玻璃仪器有
 反萃取的原理
反萃取的原理
您最近一年使用:0次
2023-05-02更新
|
285次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
2 . 工业上铬铁矿主要成分为亚铬酸亚铁[Fe(CrO2)2],还含少量MgCO3、Al2O3、SiO2等杂质。以铬铁矿为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
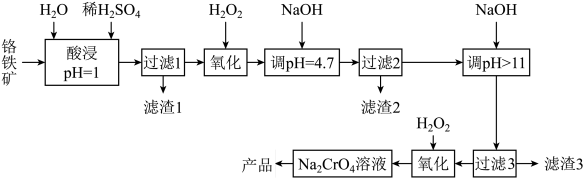
已知:a.+3价Cr在酸性溶液中性质稳定,当pH>9时,以CrO 形式存在且易被氧化。
形式存在且易被氧化。
b.常温下,氢氧化铁的Ksp=4.0×10-38、氢氧化镁的Ksp=1.8×10-11、氢氧化铝的Ksp=3.2×10-34。
(1)为了提高酸浸速率和反应充分,可以采取的措施有_____ (填两条)。
(2)滤渣2的主要成分为______ (写化学式)。
(3)流程中两次使用了H2O2,分别写出两次反应的离子方程式:_____ 。
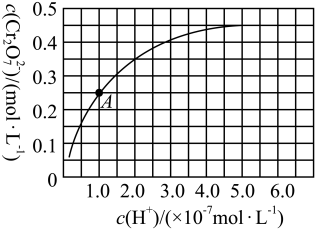
(4)产品铬酸钠溶于水后,CrO 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:
)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:_____ ,根据A点数据计算出该转化反应的平衡常数为_____ ,温度升高,溶液中CrO 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H_____ (填“>”“<”或“=”)0。

已知:a.+3价Cr在酸性溶液中性质稳定,当pH>9时,以CrO
 形式存在且易被氧化。
形式存在且易被氧化。b.常温下,氢氧化铁的Ksp=4.0×10-38、氢氧化镁的Ksp=1.8×10-11、氢氧化铝的Ksp=3.2×10-34。
(1)为了提高酸浸速率和反应充分,可以采取的措施有
(2)滤渣2的主要成分为
(3)流程中两次使用了H2O2,分别写出两次反应的离子方程式:
(4)产品铬酸钠溶于水后,CrO
 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应:
)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应: 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H
您最近一年使用:0次
2023-02-06更新
|
317次组卷
|
5卷引用:湖南省常德市第一中学2023届高三第五次月考化学试题
湖南省常德市第一中学2023届高三第五次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考(六)化学试题湖南省郴州市第一中学2023届高三下学期第七次月考化学试题湖南省衡阳市第一中学2022-2023学年高三第七次月考化学试题(已下线)预测卷04-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
2022·河北·模拟预测
名校
解题方法
3 . 工业上以硼镁矿(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 、
、 和
和 等)为原料生产硼酸晶体的工艺流程如图所示。
等)为原料生产硼酸晶体的工艺流程如图所示。
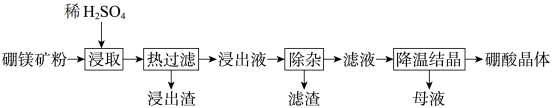
已知:① 的溶解度随温度的升高显著增大;
的溶解度随温度的升高显著增大;
② 、
、 、
、 和
和 以氢氧化物的形式完全沉淀时,溶液的
以氢氧化物的形式完全沉淀时,溶液的 分别为3.2、9.7、5.2和12.4。
分别为3.2、9.7、5.2和12.4。
下列说法错误的是
 ,还含有少量
,还含有少量 、
、 、
、 、
、 和
和 等)为原料生产硼酸晶体的工艺流程如图所示。
等)为原料生产硼酸晶体的工艺流程如图所示。
已知:①
 的溶解度随温度的升高显著增大;
的溶解度随温度的升高显著增大;②
 、
、 、
、 和
和 以氢氧化物的形式完全沉淀时,溶液的
以氢氧化物的形式完全沉淀时,溶液的 分别为3.2、9.7、5.2和12.4。
分别为3.2、9.7、5.2和12.4。下列说法错误的是
| A.“浸取”时要分批慢慢加入稀硫酸 |
B.“热过滤”的目的是防止温度降低时 从溶液中析出 从溶液中析出 |
C.“除杂”时需向“浸出液”中依次加入 和 和 溶液,以除去 溶液,以除去 、 、 、 、 等杂质离子 等杂质离子 |
| D.“母液”中的溶质主要是硫酸镁 |
您最近一年使用:0次
2023-01-20更新
|
656次组卷
|
8卷引用:湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题
湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题(已下线)2022年河北省新高考测评卷(一)(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编超重点7 金属与非金属交界处的3种重要元素湖南省衡阳八中2022-2023学年高三第四次月考化学试题湖南省攸县第一中学2023届高三第七次月考化学试题天津经济技术开发区第一中学(泰达一中)2023-2024学年高三上学期期中考试化学试卷
名校
解题方法
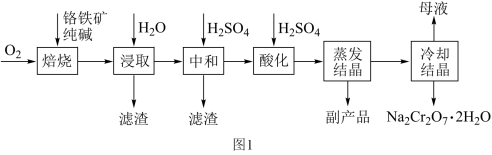
4 . 工业上以铬铁矿(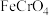 ,含
,含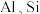 的氧化物等杂质)为主要原料制备红矾钠
的氧化物等杂质)为主要原料制备红矾钠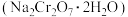 的工艺流程如图1所示(已知:
的工艺流程如图1所示(已知: )。
)。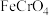 转化为
转化为 ,并将
,并将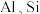 的氧化物转化为可溶性钠盐。
的氧化物转化为可溶性钠盐。 的氧化物转化为可溶性钠盐的化学方程式为
的氧化物转化为可溶性钠盐的化学方程式为___________ ;“焙烧”时气体与矿料逆流而行,目的是___________ 。
(2)“中和”时要保证 完全沉淀,应调节溶液
完全沉淀,应调节溶液 不小于
不小于___________ (保留两位有效数字)。( 时,
时, 的
的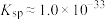 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度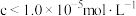 时,可认为已除尽。)
时,可认为已除尽。)
(3)“酸化”的目的是___________ 。
(4)“冷却结晶”所得母液中,除 外还含有
外还含有___________ ,该物质在上述流程中可循环利用。
(5)利用膜电解技术(装置如图2),以 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为:
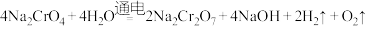 。
。
① 与
与___________ (填“ ”或“
”或“ ”)在同一极室制得。
”)在同一极室制得。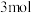 气体,通过阳离子交换膜的离子数为
气体,通过阳离子交换膜的离子数为___________ 。
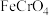 ,含
,含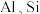 的氧化物等杂质)为主要原料制备红矾钠
的氧化物等杂质)为主要原料制备红矾钠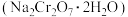 的工艺流程如图1所示(已知:
的工艺流程如图1所示(已知: )。
)。
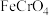 转化为
转化为 ,并将
,并将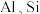 的氧化物转化为可溶性钠盐。
的氧化物转化为可溶性钠盐。 的氧化物转化为可溶性钠盐的化学方程式为
的氧化物转化为可溶性钠盐的化学方程式为(2)“中和”时要保证
 完全沉淀,应调节溶液
完全沉淀,应调节溶液 不小于
不小于 时,
时, 的
的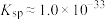 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度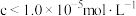 时,可认为已除尽。)
时,可认为已除尽。)(3)“酸化”的目的是
(4)“冷却结晶”所得母液中,除
 外还含有
外还含有(5)利用膜电解技术(装置如图2),以
 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: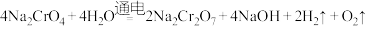 。
。①
 与
与 ”或“
”或“ ”)在同一极室制得。
”)在同一极室制得。
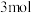 气体,通过阳离子交换膜的离子数为
气体,通过阳离子交换膜的离子数为
您最近一年使用:0次
2023-01-14更新
|
299次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期4月月考化学试题
名校
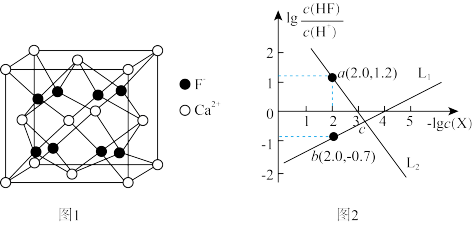
5 .  是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,
是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm, 表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节
表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节 浊液的pH,测得在不同pH条件下,体系中
浊液的pH,测得在不同pH条件下,体系中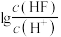 与
与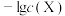 (X为
(X为 或
或 )的关系如图2所示。下列说法错误的是。
)的关系如图2所示。下列说法错误的是。
 是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,
是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm, 表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节
表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节 浊液的pH,测得在不同pH条件下,体系中
浊液的pH,测得在不同pH条件下,体系中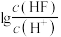 与
与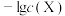 (X为
(X为 或
或 )的关系如图2所示。下列说法错误的是。
)的关系如图2所示。下列说法错误的是。
A.每个氟化钙晶胞中含有 的数目为4个 的数目为4个 |
B.氟化钙的晶体密度为 |
C. 表示 表示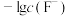 与 与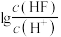 的变化曲线 的变化曲线 |
D.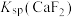 的数量级为 的数量级为 |
您最近一年使用:0次
2022-12-16更新
|
941次组卷
|
8卷引用:湖南省常德市第一中学2023届高三第五次月考化学试题
解题方法
6 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
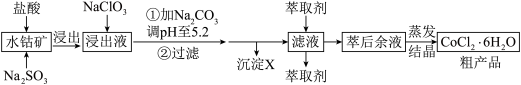
已知:①浸出液含有的阳离子主要有H+、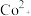 、
、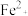 、
、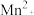 、
、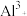 等;
等;
②酸性条件下,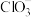 不会氧化
不会氧化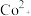 ,
,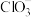 转化为
转化为 ;
;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01 mol/L)
④CoCl2·6H2O熔点为86 ℃,加热至110~120 ℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式_______ 。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式_______ 。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀X成分为_______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是_______ (填选项序号字母)。

A.1.0~2.0 B.2.5~3.5 C.4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是_______ 。

已知:①浸出液含有的阳离子主要有H+、
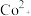 、
、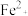 、
、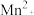 、
、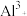 等;
等;②酸性条件下,
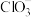 不会氧化
不会氧化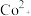 ,
,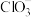 转化为
转化为 ;
;③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01 mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀X成分为
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是

A.1.0~2.0 B.2.5~3.5 C.4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是
您最近一年使用:0次
名校
解题方法
7 . I.回答下列问题:
(1)若在空气中加热MgCl2•6H2O,生成的是Mg(OH)Cl或MgO,写出生成Mg(OH)Cl关反应的化学方程式_______ 。
(2)用电解法制取金属镁时,需要无水氯化镁。需要在干燥的HCl气流中加热MgCl2•6H2O,才能得到无水MgCl2,其原因是_______ 。
II.现有常温下的0.1mol•L-1纯碱溶液。
(3)已知25℃时,Kh1=2×10-4,则当溶液中c(HCO ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=_______ 。
(4)0.1mol•L-1Na2CO3溶液中c(OH﹣)﹣c(H+)=_______ [用含c(HCO )、c(H2CO3)的关系式表示]。
)、c(H2CO3)的关系式表示]。
(5)向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式_______ 。
(6)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl﹣时,采用K2CrO4为指示剂,利用Ag+与CrO 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl﹣恰好沉淀完全(浓度等于1.0×10-5mol•L﹣1)时,溶液中c(Ag+)=
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl﹣恰好沉淀完全(浓度等于1.0×10-5mol•L﹣1)时,溶液中c(Ag+)=_______ mol•L﹣1,c(CrO )=
)=_______ mol•L﹣1。(已知25°C时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)
(1)若在空气中加热MgCl2•6H2O,生成的是Mg(OH)Cl或MgO,写出生成Mg(OH)Cl关反应的化学方程式
(2)用电解法制取金属镁时,需要无水氯化镁。需要在干燥的HCl气流中加热MgCl2•6H2O,才能得到无水MgCl2,其原因是
II.现有常温下的0.1mol•L-1纯碱溶液。
(3)已知25℃时,Kh1=2×10-4,则当溶液中c(HCO
 ):c(CO
):c(CO )=2:1时,溶液的pH=
)=2:1时,溶液的pH=(4)0.1mol•L-1Na2CO3溶液中c(OH﹣)﹣c(H+)=
 )、c(H2CO3)的关系式表示]。
)、c(H2CO3)的关系式表示]。(5)向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式
(6)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl﹣时,采用K2CrO4为指示剂,利用Ag+与CrO
 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl﹣恰好沉淀完全(浓度等于1.0×10-5mol•L﹣1)时,溶液中c(Ag+)=
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl﹣恰好沉淀完全(浓度等于1.0×10-5mol•L﹣1)时,溶液中c(Ag+)= )=
)=
您最近一年使用:0次
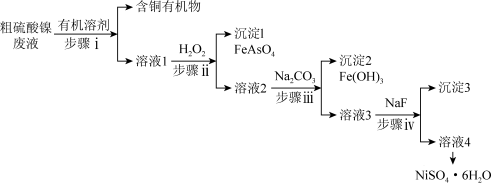
8 . 铜冶炼过程中,产生的粗硫酸镍废液中含有Cu2+、Fe2+、Ca2+、Mg2+、H3AsO3等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如图:
已知:常温下,Fe(OH)3Ksp=2.6×10−39,Ni(OH)2Ksp=5.48×10−16,HFKa=6.3×10−4
(1)步骤i的操作名称是____ 。
(2)①H3AsO3中As的化合价为____ 。
②步骤ii中H2O2的作用是____ 。
(3)步骤iii,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-4mol•L-1,若溶液2中c(Ni2+)=0.0548mol•L-1,则需控制pH的大致范围为____ 。
(4)①步骤iv,沉淀3的主要成分有____ (填化学式)。
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是____ 。
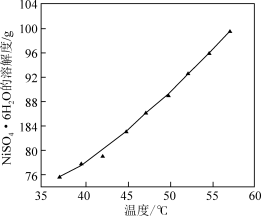
(5)结合图说明由溶液4得到NiSO4•6H2O的操作是____ 。

已知:常温下,Fe(OH)3Ksp=2.6×10−39,Ni(OH)2Ksp=5.48×10−16,HFKa=6.3×10−4
(1)步骤i的操作名称是
(2)①H3AsO3中As的化合价为
②步骤ii中H2O2的作用是
(3)步骤iii,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-4mol•L-1,若溶液2中c(Ni2+)=0.0548mol•L-1,则需控制pH的大致范围为
(4)①步骤iv,沉淀3的主要成分有
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是
(5)结合图说明由溶液4得到NiSO4•6H2O的操作是

您最近一年使用:0次
解题方法
9 . 下列实验操作对应的离子方程式书写正确的是
A.向澄清石灰水中加入足量NaHCO3溶液中: |
B.用碳酸钠溶液浸泡锅炉水垢: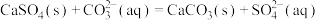 |
C.将四氧化三铁溶于稀硝酸: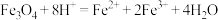 |
D.向 溶液中加入 溶液中加入 : :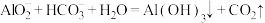 |
您最近一年使用:0次
解题方法
10 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):

25℃时,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)为了提高金属镍废料浸出的速率,在“碱浸”时可采取的措施有①适当升高温度;②搅拌;③_______ 等。
(2)滤液②中含有的金属离子是_______ 。
(3)“转化”中可替代H2O2的物质是_______ 。若工艺流程改为先“调pH”后 “转化”,即
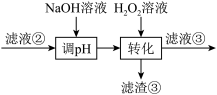 ,
,
则“滤液③”中可能含有的杂质离子为_______ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=_______ (列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0mol/L,则“调pH”应控制的pH范围是_______ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_______ 。

25℃时,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | A13+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)为了提高金属镍废料浸出的速率,在“碱浸”时可采取的措施有①适当升高温度;②搅拌;③
(2)滤液②中含有的金属离子是
(3)“转化”中可替代H2O2的物质是
 ,
,则“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算Ni(OH)2的Ksp=
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
您最近一年使用:0次
2022-10-27更新
|
229次组卷
|
2卷引用:湖南省汉寿县第二中学 2022-2023学年高三上学期期中考试化学试题



