名校
解题方法
1 . 硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25℃时,Ksp[Zn(OH)2]= 1.0 ×10-1 7 ,Ksp[Ag2SO4]=1.2×10-5,则下列说法正确的是
| A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 |
| B.在 ZnSO4 溶液中各离子的浓度关系为: c(Zn2 + )+c(H+ )=c(OH-)+c(SO42-) |
| C.在 0.5L 0.10mol•L-1的 ZnSO4 溶液中加入等体积的0.02 mol⋅L−1的AgNO3溶液,即可生成Ag2SO4沉淀 |
| D.常温下,要除去0.20mol•L-1,ZnSO4 溶液中的Zn2+,至少要调节pH ≥8 |
您最近一年使用:0次
2020-04-02更新
|
384次组卷
|
12卷引用:【全国百强校】河北省武邑中学2019届高三上学期第三次调研考试化学试题
【全国百强校】河北省武邑中学2019届高三上学期第三次调研考试化学试题2016届广东省松山湖学校、东莞一中高三上12月联考理综化学试卷【全国百强校】福建省厦门双十中学2018-2019学年高二下学期第二次月考化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2019-2020学年高三上学期第一次月考理综化学试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过素养 学科素养拓展训练山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题
2020·山东·模拟预测
名校
解题方法
2 . 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可组成一种分子簇,其分子结构如图所示(小球大小表示原子半径相对大小),W、X位于不同周期,X原子的最外层电子数是次外层的3倍,Z的族序数等于周期数。下列说法正确的是( )
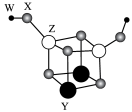

| A.W单质的沸点比X单质的高 |
| B.W、Y组成的化合物为离子化合物 |
| C.Y的最高价氧化物的水化物碱性比Z的弱 |
| D.Y、Z的简单离子均不影响水的电离平衡 |
您最近一年使用:0次
2020·山东·模拟预测
解题方法
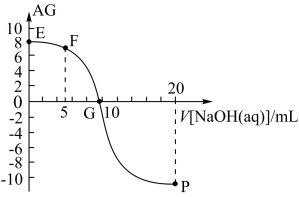
3 . 用AG表示溶液的酸度,其表达式为AG=lg[ ],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
 ],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
],298K时,向10 mL 0.l mol•L﹣1HX溶液中滴加0.1 mol•L﹣1 NaOH溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是( )
| A.溶液pH和AG的关系式为AG=14﹣2pH |
| B.对G点溶液加水稀释,溶液pH增大 |
| C.溶液中水电离的C(OH﹣):F点<P点 |
| D.298K时HX的电离常数Ka≈1.0×10﹣5 |
您最近一年使用:0次
2010·上海奉贤·二模
4 . 下列排列顺序完全正确的组合是( )
①溶解性:Na2CO3>NaHCO3>AgCl>AgI
②氧化性:MnO2>Cl2>Fe3+>Cu2+
③常温下,α1、α2、α3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则α1=α2>α3
④同温下,1L0.5mol·L-1NH4Cl溶液中NH4+数与2L0.25mol·L-1NH4Cl溶液中NH4+数分别为a、b,则a>b
①溶解性:Na2CO3>NaHCO3>AgCl>AgI
②氧化性:MnO2>Cl2>Fe3+>Cu2+
③常温下,α1、α2、α3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则α1=α2>α3
④同温下,1L0.5mol·L-1NH4Cl溶液中NH4+数与2L0.25mol·L-1NH4Cl溶液中NH4+数分别为a、b,则a>b
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
您最近一年使用:0次
2010·上海·二模
解题方法
5 . 在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。则下列叙述正确的是( )
| A.在实验过程中水的电离程度的变化趋势是先减小后增大 |
| B.当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl |
| C.当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)>c(Cl-) |
| D.当滴加盐酸至恰好完全中和时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
您最近一年使用:0次
2010·上海松江·二模
解题方法
6 . 常温下,某溶液中由水电离的c(OH-)=1×10-3mol/L,该溶液可能是( )
①硫化氢的溶液 ②氯化铝溶液 ③硫酸铁的溶液 ④氢氧化钠溶液
①硫化氢的溶液 ②氯化铝溶液 ③硫酸铁的溶液 ④氢氧化钠溶液
| A.①④ | B.①② |
| C.②③ | D.③④ |
您最近一年使用:0次
7 . 水是极弱的电解质,改变外界条件对水的电离有促进或抑制作用,下列说法错误的是
| A.在蒸馏水中加入强酸或强碱对水的电离均有抑制作用;增加水的量,促进水的电离 |
| B.在蒸馏水中加入盐对水的电离可能有抑制作用,也可能有促进作用 |
| C.压强对水的电离影响较小,升高温度对水的电离有促进作用 |
| D.pH=4的某电解质溶液,其溶质可能是酸或者盐 |
您最近一年使用:0次
2012·上海杨浦·二模
解题方法
8 . Ⅰ:SO2 + 2H2O + I2→H2SO4 + 2HI Ⅱ:2HI H2 + I2Ⅲ:2H2SO4→2SO2 + O2 + 2H2O
H2 + I2Ⅲ:2H2SO4→2SO2 + O2 + 2H2O
(1)上述循环反应的总反应可以表示为____________________________ ;反应过程中起催化作用的物质是___________ (选填编号)。
a.SO2 b.I2 c.H2SO4 d.HI
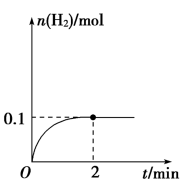
(2)一定温度下,向2 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=_______ 。
(3)对反应Ⅱ,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下________ 也是原来的2倍(选填编号)。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(4)实验室用锌和稀硫酸反应制取H2,反应时溶液中水的电离平衡_____ 移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的____ (选填编号),产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d. NaHCO3
 H2 + I2Ⅲ:2H2SO4→2SO2 + O2 + 2H2O
H2 + I2Ⅲ:2H2SO4→2SO2 + O2 + 2H2O(1)上述循环反应的总反应可以表示为
a.SO2 b.I2 c.H2SO4 d.HI
(2)一定温度下,向2 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2的物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=

(3)对反应Ⅱ,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(4)实验室用锌和稀硫酸反应制取H2,反应时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d. NaHCO3
您最近一年使用:0次
2012·上海浦东新·三模
解题方法
9 . 水的电离平衡曲线如图所示。下列说法正确的是( )
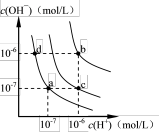

| A.图中对应点的温度关系为:a>b>c |
| B.纯水仅升高温度,可从a点变到c点 |
| C.水的电离常数Kw数值大小关系为:b>c>d |
| D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
您最近一年使用:0次



