名校
解题方法
1 . 下列离子方程式正确的是
A. 水解反应的离子方程式: 水解反应的离子方程式: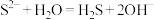 |
B.用氯化铁溶液刻蚀铜电路板: |
C.向硫酸氢钠溶液中滴加氢氧化钡溶液至中性: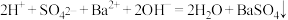 |
D.向 溶液通入少量 溶液通入少量 : : |
您最近一年使用:0次
2023-12-01更新
|
101次组卷
|
2卷引用:河南省驻马店高级中学2023-2024学年高二上学期期中考试化学试题
名校
2 . 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为 ,硼砂的化学式为
,硼砂的化学式为 ,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
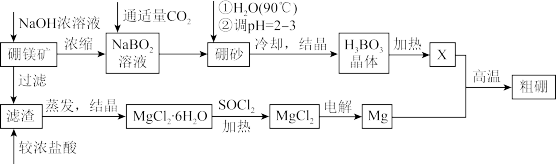
(1)滤渣的主要成分为___________ ,X为 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___________ 。
(2) 是一种一元弱酸,也可写作
是一种一元弱酸,也可写作 ,它与水作用时结合水电离的
,它与水作用时结合水电离的 而呈酸性,这一变化的离子方程式为
而呈酸性,这一变化的离子方程式为___________ 。以硼酸为原料可制得硼氢化钠( ),它是有机合成中的重要还原剂,其电子式为
),它是有机合成中的重要还原剂,其电子式为___________ 。
(3)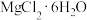 在
在 氛围中加热的化学方程式为
氛围中加热的化学方程式为___________ 。
(4)制得的粗硼在一定条件下可生成 ,
, 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将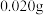 粗硼制成的
粗硼制成的 完全分解,生成的
完全分解,生成的 用
用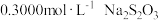 (
( 为弱酸)溶液滴定至终点,消耗
为弱酸)溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为___________ (提示: )。
)。
 ,硼砂的化学式为
,硼砂的化学式为 ,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
(1)滤渣的主要成分为
 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为(2)
 是一种一元弱酸,也可写作
是一种一元弱酸,也可写作 ,它与水作用时结合水电离的
,它与水作用时结合水电离的 而呈酸性,这一变化的离子方程式为
而呈酸性,这一变化的离子方程式为 ),它是有机合成中的重要还原剂,其电子式为
),它是有机合成中的重要还原剂,其电子式为(3)
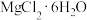 在
在 氛围中加热的化学方程式为
氛围中加热的化学方程式为(4)制得的粗硼在一定条件下可生成
 ,
, 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将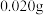 粗硼制成的
粗硼制成的 完全分解,生成的
完全分解,生成的 用
用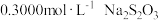 (
( 为弱酸)溶液滴定至终点,消耗
为弱酸)溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为 )。
)。
您最近一年使用:0次
2022-09-12更新
|
231次组卷
|
3卷引用:河南省洛阳市第一高级中学2022~2023学年高三上学期9月月考化学试题
名校
解题方法
3 . 下列事实对应的离子方程式错误的是
A.用石墨作电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
B.碳酸钠溶液显碱性: + 2H2O + 2H2O H2CO3+ 2OH- H2CO3+ 2OH- |
C.用Na2CO3溶液处理含CaSO4的水垢:CaSO4(s)+  CaCO3(s) + CaCO3(s) + |
| D.用铁氰化钾溶液检验Fe2+:3Fe2++ 2[FeCN)6] 3-= Fe3[Fe(CN)6]2↓ |
您最近一年使用:0次
2022-09-06更新
|
120次组卷
|
2卷引用:河南省濮阳市2021-2022学年高二上学期期末学业质量监测化学试题
名校
4 . 下列指定反应的离子方程式书写正确的是
| A.硫化钠溶于水显碱性:S2-+2H2O=H2S+2OH- |
B.AgCl悬浊液与NaI溶液反应:AgCl(s)+I-(aq) Cl-(aq)+AgI(s) Cl-(aq)+AgI(s) |
| C.用稀HNO3溶解铜:Cu+2H+=Cu2++H2↑ |
D.NH4HCO3溶液与足量KOH溶液反应:HCO +OH-=CO +OH-=CO +H2O +H2O |
您最近一年使用:0次
2022-06-14更新
|
112次组卷
|
2卷引用:河南省信阳市浉河区新时代学校2021-2022学年高二下学期期末化学试题
5 . 水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_____ mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
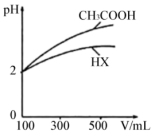
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是___________ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol·L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
7卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
河南省洛阳市2019-2020学年高二上学期期末考试化学试题(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题江西省吉安市2021-2022学年高二上学期期末教学质量检测化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
名校
6 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
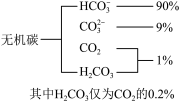
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________ 。已知春季海水pH=8.1,预测冬季海水碱性将会_______ (填“增强”或“减弱”),理由是_________________ 。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
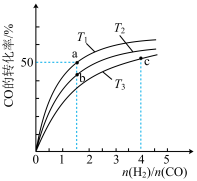
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
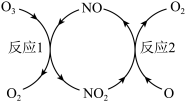
①NO的作用是_________________ 。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为____________________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
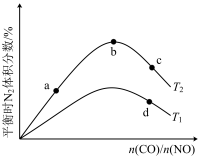
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ 。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____ 。

(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2020-03-05更新
|
448次组卷
|
2卷引用:河南省驻马店市2020年3月高三模拟测试理综化学试题
名校
解题方法
7 . 下列离子方程式与所述事实相符且书写正确的是
A.洪水过后,用明矾净化生活用水: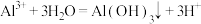 |
B.滴加氨水,除去 溶液中的 溶液中的 : : |
C.用酸性 溶液滴定草酸溶液: 溶液滴定草酸溶液: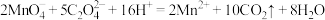 |
D.用惰性电极电解 溶液: 溶液: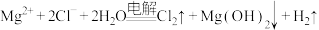 |
您最近一年使用:0次
2024-01-07更新
|
100次组卷
|
2卷引用:河南省驻马店市遂平县第一高级中学2023-2024学年高二上学期期中考试化学试卷
8 . 请预测下列盐溶液的酸碱性,若盐能发生水解反应,请写出水解反应的离子方程式
(1)硫酸钾溶液_________________________________ ;
(2)磷酸钠溶液_________________________________ ;
(3)氯化铁溶液_________________________________ ;
(4)溴化钠溶液__________________________________ ;
(5)硫化钾溶液__________________________________
(1)硫酸钾溶液
(2)磷酸钠溶液
(3)氯化铁溶液
(4)溴化钠溶液
(5)硫化钾溶液
您最近一年使用:0次
2018-01-19更新
|
827次组卷
|
4卷引用:河南正阳县高级中学2020-2021学年高二上学期第三次素质检测化学试题
河南正阳县高级中学2020-2021学年高二上学期第三次素质检测化学试题陕西省黄陵中学2017-2018学年高二(普通班)上学期期末考试化学试题新疆吾尔自治区沙雅县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)3.3.1 盐类的水解反应(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)
名校
9 . 回答下列问题:
(1)砷酸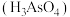 分步电离的平衡常数(25℃)为
分步电离的平衡常数(25℃)为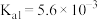 ,
,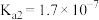 ,
,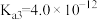 。
。 第一步水解的离子方程式为
第一步水解的离子方程式为___________ ,该步水解的平衡常数(25℃)为___________ 。
(2)以镁铝复合氧化物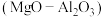 为载体的负载型镍铜双金属催化剂
为载体的负载型镍铜双金属催化剂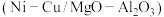 是一种新型高效加氢或脱氢催化剂,其制备流程如下:
是一种新型高效加氢或脱氢催化剂,其制备流程如下:
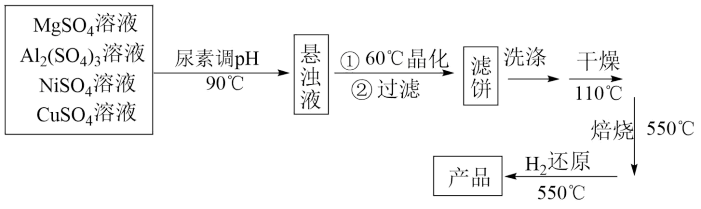
已知:常温下,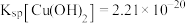 ,
,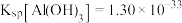 。回答下列问题:
。回答下列问题:
①在加热条件下,尿素 在水中发生水解反应,放出
在水中发生水解反应,放出___________ 和___________ 两种气体(写化学式)。
②“晶化”过程中,需保持恒温60℃,可采用的加热方式为___________
③“洗涤”过程中,检验滤饼是否洗净的方法是___________ 。
④常温下,若“悬浊液”中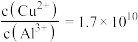 ,则溶液的
,则溶液的
___________ 。
(3)请写出泡沫灭火器灭火的原理___________ (用离子方程式表示)
(1)砷酸
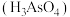 分步电离的平衡常数(25℃)为
分步电离的平衡常数(25℃)为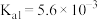 ,
,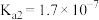 ,
,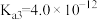 。
。 第一步水解的离子方程式为
第一步水解的离子方程式为(2)以镁铝复合氧化物
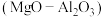 为载体的负载型镍铜双金属催化剂
为载体的负载型镍铜双金属催化剂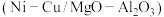 是一种新型高效加氢或脱氢催化剂,其制备流程如下:
是一种新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下,
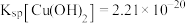 ,
,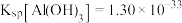 。回答下列问题:
。回答下列问题:①在加热条件下,尿素
 在水中发生水解反应,放出
在水中发生水解反应,放出②“晶化”过程中,需保持恒温60℃,可采用的加热方式为
③“洗涤”过程中,检验滤饼是否洗净的方法是
④常温下,若“悬浊液”中
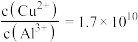 ,则溶液的
,则溶液的
(3)请写出泡沫灭火器灭火的原理
您最近一年使用:0次
名校
解题方法
10 . 将适量NaHCO3粉末投入饱和氯水中,能增加溶液中HClO的浓度,其反应原理为NaHCO3+Cl2=NaCl+CO2↑+HClO。下列化学用语表示正确的是
A.CO2的电子式: |
| B.HClO的结构式:H-Cl-O |
C.NaHCO3的电离方程式:NaHCO3 Na++H++CO Na++H++CO |
D.NaHCO3溶液显碱性: +H2O +H2O H3O++CO H3O++CO |
您最近一年使用:0次
2021-09-11更新
|
232次组卷
|
4卷引用:河南省大联考2022届高三上学期阶段性测试(一)化学试题



