名校
解题方法
1 . I.根据下列图象,进行分析:
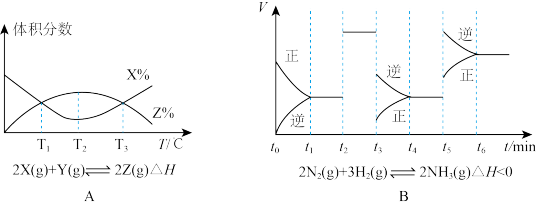
(1)由图A知,该反应的K值随温度的升高而_____ (填“增大”、“减小”或“不变”)。
(2)由图B知,t3时采取的措施为_____ ,t1~t6中,氨气的含量最低的是_____ 。
II.已知H2A在水中电离:H2A=HA-+H+,HA- A2-+H+。
A2-+H+。
(1)常温下NaHA溶液的pH__ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是______ 。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______ 。
A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体

(1)由图A知,该反应的K值随温度的升高而
(2)由图B知,t3时采取的措施为
II.已知H2A在水中电离:H2A=HA-+H+,HA-
 A2-+H+。
A2-+H+。(1)常温下NaHA溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体
您最近一年使用:0次
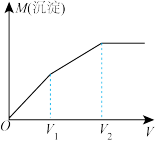
2 . 往含 和
和 的稀溶液中滴入
的稀溶液中滴入 溶液,产生沉淀的质量
溶液,产生沉淀的质量 (沉淀)与加入
(沉淀)与加入 溶液体积的关系如图所示。已知:
溶液体积的关系如图所示。已知: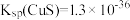 ,
,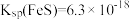 。则原溶液中
。则原溶液中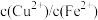 比值为
比值为
 和
和 的稀溶液中滴入
的稀溶液中滴入 溶液,产生沉淀的质量
溶液,产生沉淀的质量 (沉淀)与加入
(沉淀)与加入 溶液体积的关系如图所示。已知:
溶液体积的关系如图所示。已知: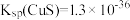 ,
,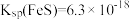 。则原溶液中
。则原溶液中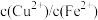 比值为
比值为
A.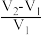 | B.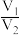 | C.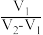 | D.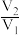 |
您最近一年使用:0次
解题方法
3 . 常温下,向20mL0.1mol·L-1BaCl2溶液中滴加0.2mol·L-1Na2CO3溶液的滴定曲线如图所示。已知:pBa=-lgc(Ba2+),pKa=-lgKa;常温下H2CO3:pKa1=6.4,pKa2=10.3。下列说法正确的是
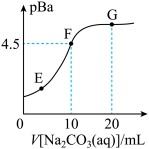

| A.常温下,Na2CO3溶液的pKh1=3.7(Kh1为一级水解常数) |
| B.常温下,Ksp(BaCO3)≈1.0×10-9 |
| C.E、F、G三点的Ksp从大到小的顺序为:G>F>E |
| D.其他条件相同,用MgCl2溶液替代BaCl2溶液,F点向G点迁移 |
您最近一年使用:0次
名校
4 . 用Ksp表示难溶物的溶度积。下列有关沉淀溶解平衡的说法中,正确的是
| A.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp增大 |
| B.在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 |
| C.温度升高,沉淀物的Ksp一定增大 |
| D.25℃时,Ksp(AgCl)> Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
您最近一年使用:0次
2021-04-16更新
|
177次组卷
|
3卷引用:湖南省常德市一中2020-2021学年高二下学期期中考试化学试题
解题方法
5 . 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知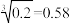 )。下列分析正确的是
)。下列分析正确的是

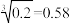 )。下列分析正确的是
)。下列分析正确的是
A.由图可知常温下 |
| B.饱和Ca(OH)2溶液中加入少量CaO,溶液变浑浊,但Ca2+离子数目不变 |
C.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: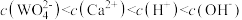 |
| D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液组成沿da线向c点移动(假设混合后溶液体积不变) |
您最近一年使用:0次
解题方法
6 . 根据下列图象分析,下列说法正确的是


A.甲图:一定条件下1mol的 (g)和0.5mol (g)和0.5mol (g)充分反应,放出的热量为98.7kJ (g)充分反应,放出的热量为98.7kJ |
B.乙图: 从11min起其他条件不变,压缩容器的容积使之变为原来的一半,则 从11min起其他条件不变,压缩容器的容积使之变为原来的一半,则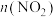 的变化曲线可能为乙图中的b 的变化曲线可能为乙图中的b |
C.丙图:表示在常温下, (指 (指 或 或 )的硫化物的沉淀溶解平衡曲线。则向 )的硫化物的沉淀溶解平衡曲线。则向 浓度为 浓度为 的废水中加入CuS粉末,会有ZnS沉淀析出 的废水中加入CuS粉末,会有ZnS沉淀析出 |
D.丁图:常温下,用 NaOH溶液滴定20.00mL NaOH溶液滴定20.00mL  溶液。则酚酞可作本实验的指示剂,D点为滴定终点 溶液。则酚酞可作本实验的指示剂,D点为滴定终点 |
您最近一年使用:0次
解题方法
7 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的沉淀溶解平衡均属于化学平衡。
I.已知 在水中存在以下平衡:
在水中存在以下平衡: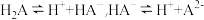 。
。
(1)常温下, 溶液的
溶液的
______ (填字母序号),原因是______ (填离子方程式)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)常温下,若向 的
的 溶液中逐滴滴加
溶液中逐滴滴加
 溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是______ (填字母序号)。
A.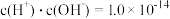 B.
B.
C.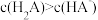 D.
D.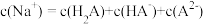
(3)常温下, 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: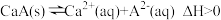 ,若要使该溶液中
,若要使该溶液中 浓度增大,可采取的措施有
浓度增大,可采取的措施有______ (填字母序号)。
A.升高温度 B.降低温度 C.加入少量蒸馏水 D.加入 固体
固体
Ⅱ.化学沉淀法是除去酸性废水中 的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液
的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液 变化的关系如图所示。向含
变化的关系如图所示。向含 的溶液中逐滴滴加
的溶液中逐滴滴加 溶液,溶液变浑浊,继续滴加
溶液,溶液变浑浊,继续滴加 溶液又变澄清。
溶液又变澄清。
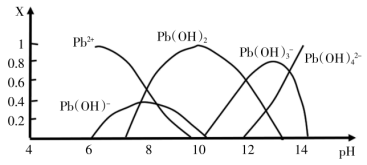
(4)若采用氢氧化物沉淀法除溶液中的 ,应将溶液的
,应将溶液的 调至约为
调至约为______ ; 时,溶液中发生的主要离子方程式为
时,溶液中发生的主要离子方程式为______ 。
(5)向酸性含铅废水中加 可将
可将 转化为
转化为 沉淀除去。若某工厂处理过的废水中
沉淀除去。若某工厂处理过的废水中 浓度为
浓度为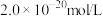 ,则
,则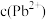 为
为______ 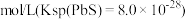 。
。
I.已知
 在水中存在以下平衡:
在水中存在以下平衡: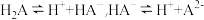 。
。(1)常温下,
 溶液的
溶液的
A.大于7 B.小于7 C.等于7 D.无法确定
(2)常温下,若向
 的
的 溶液中逐滴滴加
溶液中逐滴滴加
 溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是
溶液至溶液呈中性。此时该混合溶液中的下列关系一定正确的是A.
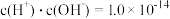 B.
B.
C.
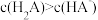 D.
D.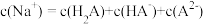
(3)常温下,
 的饱和溶液中存在以下平衡:
的饱和溶液中存在以下平衡: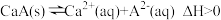 ,若要使该溶液中
,若要使该溶液中 浓度增大,可采取的措施有
浓度增大,可采取的措施有A.升高温度 B.降低温度 C.加入少量蒸馏水 D.加入
 固体
固体Ⅱ.化学沉淀法是除去酸性废水中
 的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液
的主要方法。根据其原理不同可以分为氢氧化物沉淀法、硫化物沉淀法等。水样中各形态铅的百分含量X与溶液 变化的关系如图所示。向含
变化的关系如图所示。向含 的溶液中逐滴滴加
的溶液中逐滴滴加 溶液,溶液变浑浊,继续滴加
溶液,溶液变浑浊,继续滴加 溶液又变澄清。
溶液又变澄清。
(4)若采用氢氧化物沉淀法除溶液中的
 ,应将溶液的
,应将溶液的 调至约为
调至约为 时,溶液中发生的主要离子方程式为
时,溶液中发生的主要离子方程式为(5)向酸性含铅废水中加
 可将
可将 转化为
转化为 沉淀除去。若某工厂处理过的废水中
沉淀除去。若某工厂处理过的废水中 浓度为
浓度为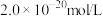 ,则
,则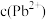 为
为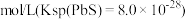 。
。
您最近一年使用:0次
2021-01-30更新
|
398次组卷
|
2卷引用:湖南省怀化市2020-2021学年高二上学期期末考试化学试题
名校
解题方法
8 . 在一定温度下将适量AgBr固体加入水中,存在平衡: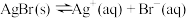 。则下列说法正确的是
。则下列说法正确的是
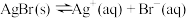 。则下列说法正确的是
。则下列说法正确的是| A.向此体系中滴加足量浓NaCl溶液,发现淡黄色固体转化为白色,说明Ksp(AgCl)<Ksp(AgBr) |
| B.向此体系中加入少量AgBr固体,平衡正向移动,当再次平衡时c(Ag+)、c(Br-)均增大 |
C.此体系中一定存在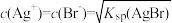 |
D.某溶液中 ,说明此时 ,说明此时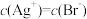 |
您最近一年使用:0次
2021-01-07更新
|
106次组卷
|
3卷引用:湖南省长沙市周南中学2020-2021学年高二下学期入学考试化学试题
名校
9 . 已知:常温下, 溶液的电离平衡常数
溶液的电离平衡常数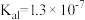 ,
,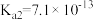 ,
, 、
、 的
的 分别为
分别为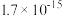 、
、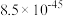 ,
,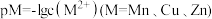 ,
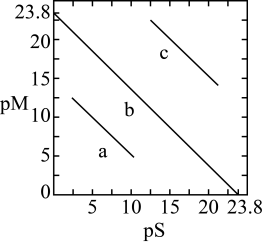
, ,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线
,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线 表示
表示 。下列说法错误的是
。下列说法错误的是
 溶液的电离平衡常数
溶液的电离平衡常数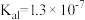 ,
,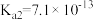 ,
, 、
、 的
的 分别为
分别为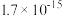 、
、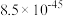 ,
,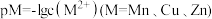 ,
, ,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线
,三种硫化物的沉淀溶解平衡曲线如图所示,其中曲线 表示
表示 。下列说法错误的是
。下列说法错误的是
A.曲线 表示 表示 |
B.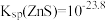 |
C.将浓度均为 的 的 溶液和 溶液和 溶液等体积混合,有沉淀产生 溶液等体积混合,有沉淀产生 |
D.含 和 和 的悬浊液中: 的悬浊液中: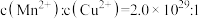 |
您最近一年使用:0次
2020-12-18更新
|
1604次组卷
|
4卷引用:湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题
湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)难点6 水溶液中的四大平衡常数-2021年高考化学专练【热点·重点·难点】福建省莆田市2021届高三毕业班第一次教学质量检测化学试卷
名校
解题方法
10 . 某温度下,Ag2SO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
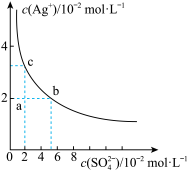

| A.a点表示Ag2SO4的不饱和溶液,加入Na2SO4固体可以使溶液由a点变到b点 |
| B.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到c点 |
| C.0.04mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合有Ag2SO4沉淀生成 |
| D.Ag2SO4的溶度积常数(Ksp)为1×10-3 |
您最近一年使用:0次
2020-11-18更新
|
390次组卷
|
2卷引用:湖南省长沙市明达中学2021-2022学年高二上学期12月月考化学试题



