1 . 锰及其化合物用途广泛,以菱锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐以及SiO2杂质)为原料生产金属锰和高品位MnCO3的工艺流程如图。

已知25℃,部分物质的溶度积常数如表:
(1)“溶浸”时,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件(温度、时间)为______ 。

(2)MnO2主要用于氧化______ 。滤渣1中残余的MnO2可加入葡萄糖一硫酸溶液处理,回收Mn2+,氧化产物为CO2。写出对应的离子方程式______ 。
(3)“除杂”步骤所得滤渣2的主要成分为MnS、______ (填化学式,其中Co、Ni均为+2价)。
(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有______ 作用;“沉锰”的关键操作有两点:①将NH4HCO3溶液加入MnSO4溶液中;②反应终点pH在7附近。如果①中颠倒试剂滴加顺序(反应pH大于7),可能造成的后果是______ ;若反应终点pH低于7,可能的后果是______ 。
(5)以Fe作电极,MnSO4、ZnSO4溶液为电解液,经过一系列步骤制得隐形战机涂料Zn2Mn(1-x)Fe2O4,则电解时阳极生成Zn2Mn(1-x)Fe2O4的总反应为_______ 。

已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 |

(2)MnO2主要用于氧化
(3)“除杂”步骤所得滤渣2的主要成分为MnS、
(4)“沉锰”时NH4HCO3除了作沉淀剂外,还有
(5)以Fe作电极,MnSO4、ZnSO4溶液为电解液,经过一系列步骤制得隐形战机涂料Zn2Mn(1-x)Fe2O4,则电解时阳极生成Zn2Mn(1-x)Fe2O4的总反应为
您最近一年使用:0次
2022-03-23更新
|
894次组卷
|
3卷引用:必刷卷01-2022年高考化学考前信息必刷卷(广东专用)
名校
解题方法
2 . 上饶市正在创建“全国文明城市”,对碳的化合物做广泛深入的研究并妥善处理具有重要意义。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中______ (填字母)的能量变化。
A.•OCH3 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCH
C. •OCH2 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2O
II.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正______ v(H2)逆(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。若平衡时气体的总压强为3×106Pa,求x点对应温度下反应的平衡常数Kp=______ Pa2。
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:______ 。
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为______ 。
(5)每转移0.2mol电子,阳极室溶液质量减少______ g。
I.CO2与H2合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:

(1)容易得到的副产物有CO和CH2O,其中相对较少的副产物为
A.•OCH3
 •CH3OH B.•CO
•CH3OH B.•CO •OCH
•OCHC. •OCH2
 •OCH3 D.•CO + •OH
•OCH3 D.•CO + •OH •CO + •H2O
•CO + •H2OII.天然气一个重要的用途是制取H2,其原理为CO2(g)+ CH4(g)⇌2CO(g)+2H2(g)。
(2)在密闭容器中通入物质的量均为 0.1 mol 的CH4和CO2,在一定条件下发生反应,CH4的平衡转化率与温度及压强(单位Pa)的关系如图所示。

y点:v(CO)正
(3)天然气中少量的杂质通常用氨水吸收,产物为硫氢化铵。一定条件下向硫氢化铵溶液中通入空气,得到单质硫并使吸收液再生。写出再生反应的化学方程式:
III.利用铜基配合1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示。

(4)电池工作过程中,阴极的电极反应式为
(5)每转移0.2mol电子,阳极室溶液质量减少
您最近一年使用:0次
2021-04-04更新
|
169次组卷
|
2卷引用:广东省深圳市龙华中学2021-2022学年高三下学期(二月第一次)半周测化学试题
名校
解题方法
3 . 对氨基苯甲酸(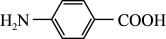 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
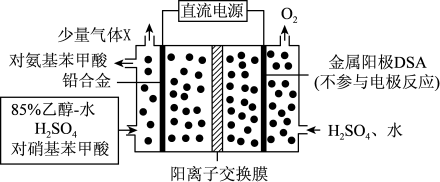
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
 )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
| A.电流由金属阳极DSA经导线流入直流电源 |
B.阴极的主要电极反应式为: +6e- +6H+→ +6e- +6H+→ +2H2O +2H2O |
| C.每转移1mole-时,阳极电解质溶液的质量减少8g |
| D.反应结束后阳极区pH增大 |
您最近一年使用:0次
解题方法
4 . 磷及其化合物在工农业生产中具有重要用途。请回答下列问题:
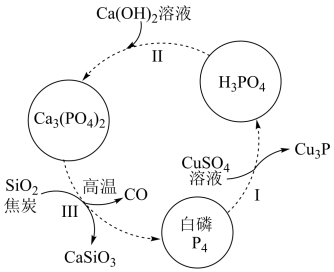
(1)如图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为__________ ,过程Ⅲ的化学方程式为_________ 。
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如下图所示:

①复合材料中加入碳单质的作用是_________ ;
②A的主要成分为V2(C2O4)3,该步反应的化学方程式为_________ ;
③已知常温下,Li2CO3微溶于水, LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,_________ ,得到 LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤,洗涤,干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6,则电池充电时阴极的电极反应式为_________ 。
(1)如图所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如下图所示:

①复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,该步反应的化学方程式为
③已知常温下,Li2CO3微溶于水, LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用LixC6和Li3V2(PO4)3/C作电极,放电时的电池总反应为LixC6+Li3-xV2(PO4)3=Li3V2(PO4)3+C6,则电池充电时阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 环己酮(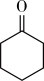 )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是

 )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
| A.a 极与电源负极相连 |
| B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O |
| C.b 极发生氧化反应 |
| D.理论上生成 1mol 环己酮时,有 1molH2生成 |
您最近一年使用:0次
2020-04-01更新
|
735次组卷
|
7卷引用:广东省深圳、汕头、潮州、揭阳名校2021届高三12月联考化学试题
6 . 辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。
I.已知: ①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2 kJ.mol-1
②Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ.mol-1
(1)Cu2S与Cu2O反应生成Cu 和SO2 的热化学方程式为_____________ 。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g) CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g) △H2
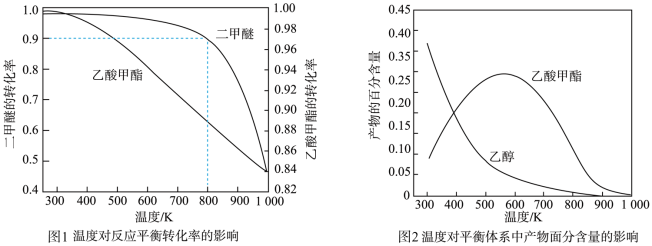
(2)压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图1所示,则△H1____ (填“>”或“<”,下同)0、△H2_____ 0。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示。在300~600K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________ 。
(3)若压强为pkPa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3 和1molCO发生反应①,2 min时达到平衡,则前2 min内CH3COOCH3 的平均生成速率为_________ ,该条件下平衡常数K=_____________ 。
(4)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是_______ 极,电解时阳极的电极反应式为______________ 。

I.已知: ①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2 kJ.mol-1
②Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ.mol-1
(1)Cu2S与Cu2O反应生成Cu 和SO2 的热化学方程式为
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)
 CH3COOCH3(g) △H1
CH3COOCH3(g) △H1反应②:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g) △H2
(2)压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图1所示,则△H1

(3)若压强为pkPa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3 和1molCO发生反应①,2 min时达到平衡,则前2 min内CH3COOCH3 的平均生成速率为
(4)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是

您最近一年使用:0次
2018-03-01更新
|
705次组卷
|
3卷引用:广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题



