解题方法
1 . 下列是元素周期表的一部分:
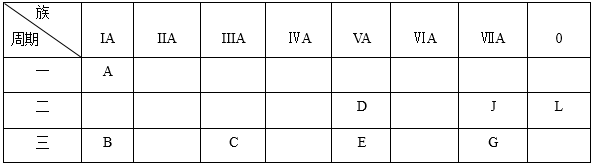
根据以上元素在周期表中的位置,用化学式 填写空白。
(1)非金属性最强的元素是_________ ;化学性质最不活泼的是_________ ;除L外,原子半径最大的是_________ ;A与D形成的10电子离子是_________ 。
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的化学式 排列成序是__________________ ;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式_________ ,_________ 。
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为_________ 。

根据以上元素在周期表中的位置,用
(1)非金属性最强的元素是
(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、D、E四种元素的最高价氧化物对应水化物的
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
(4)B、C、G、J四种元素的简单离子的半径由大到小的顺序为
您最近一年使用:0次
10-11高三·河北衡水·阶段练习
2 . 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
(1)画出B的离子结构示意图______ ;写出D元素最高价氧化物的水化物电子式_________
(2)盐X水溶液显____ (填“酸”“碱”“中”)性,用离子方程式解释其原因________________
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为________
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是________________________________
(5)如右图是一个电解过程示意图。
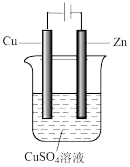
假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)_______________ L
| 元素 | 有关信息 |
| A | 元素主要化合价为—2,原子半径为0.074 n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(2)盐X水溶液显
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是
(5)如右图是一个电解过程示意图。

假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)
您最近一年使用:0次
9-10高一下·广东深圳·期末
3 . a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:

其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式:
①c__________ ;②d__________ ;③e__________ ;④a__________ 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________ >__________ (用化学式表示)。
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:________________ 。

其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式:
①c
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:
您最近一年使用:0次
4 . I.A〜G七种元素中,除F外其他均为短周期主族元素,它们的原子结构或性质如下表所示:
请回答下列问题:
(1)A在元素周期表中的位置是_______ ;F的原子结构示意图是_____________ 。
(2)下列事实能证明C和E的非金属性强弱的是_____ 。(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是______ (填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:_______ 。
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:______ 。已知在25℃、101kPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:_________ 。
Ⅱ.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
(5)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是________ 。写出乙→丙的化学方程式:__________ 。
(6)若丁物成质具有两性,②③反应均要用强碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:__________ 。室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6mol·L-1,则该溶液的pH为______ 。
(丁的Ksp为1.3×10-33)
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素原子在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物具有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
(1)A在元素周期表中的位置是
(2)下列事实能证明C和E的非金属性强弱的是
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的温定性强于E的气态氢化物的温定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:
Ⅱ.甲、乙、丙,丁均为上述元素所形成的物质,甲是单质。它们之间有如下的反应关系:
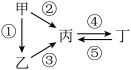
(5)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业。乙所含化学键的类型是
(6)若丁物成质具有两性,②③反应均要用强碱溶液,④反应是通入过量的—种引起温室效应的主要气体。写出丙→丁的离子方程式:
(丁的Ksp为1.3×10-33)
您最近一年使用:0次
解题方法
5 . 甲、乙、丙、丁4种化合物均含有2种或3种元素,分子中均含有18个电子。甲是气态氢化物。在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙和甲中同种元素的质量分数相等,则乙中含有化合价为-1的元素 |
| C.丙与氧气的摩尔质量相同,则丙一定仅由两种元素组成 |
| D.丁中含有第二周期ⅣA族元素,则丁一定是甲烷的同系物 |
您最近一年使用:0次
2016-12-09更新
|
419次组卷
|
6卷引用:2015届江苏常州市高三第一次调研试卷化学试卷
2015届江苏常州市高三第一次调研试卷化学试卷2016届河北省武邑中学高三上学期第四次调研化学试卷(已下线)考点06 原子结构 化学键——备战2019年浙江新高考化学考点2020届高三化学大二轮增分强化练——无机综合推断题2020届高三化学无机化学二轮专题复习——高考常考题型:无机化学推断题型【精编精炼】2012年浙江省高中学生化学竞赛试题
2012·河北石家庄·一模
名校
解题方法
6 . 由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种或两种以上元素,它们分子中质子总数均与氩原子的质子数相同,已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物 |
| D.丁和甲含有某相同元素,且该元素在二者中的百分含量相同,则丁中一定含有-l价元素 |
您最近一年使用:0次
2016-12-09更新
|
370次组卷
|
5卷引用:2012届河北省石家庄市高三补充题、压轴题化学试卷
(已下线)2012届河北省石家庄市高三补充题、压轴题化学试卷2013届河北省衡水中学高三第二次模拟考试化学试卷12013届河北省衡水中学高三第二次模拟考试化学试卷 22017届湖南省衡阳市第八中学高三实验班第三次质检化学试卷安徽省滁州市定远县育才学校2021届高三上学期第三次月考化学试题
解题方法
7 . X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X 的电子式是__________ 。
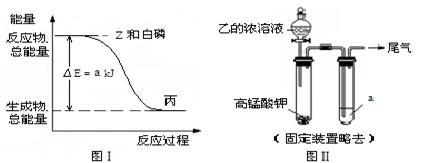
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是__________ 。 白磷固体和 Z 气体反应,生成 1 mol 液态丙时,能量变化如图Ⅰ所示,写出该反应的热化学方程式: _____________________________ 。已知 1 mol 白磷固体和 Z 气体反应,生成固态丁时,放热 b kJ,则 1 mol 固态丁转化为液态丙时的反应热△H =____________________ 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a____ 的水溶液。若仅将 a 换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____________________ 。
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是__________ 。
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。

(1)X 的电子式是
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是
您最近一年使用:0次
真题
名校
8 . 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是
| A.元素丙的单质可用于冶炼金属 |
| B.甲与丁形成的分子中有非极性分子 |
| C.简单离子半径:丁 > 乙 > 丙 |
| D.甲与乙形成的化合物均有氧化性 |
您最近一年使用:0次
2016-12-09更新
|
1411次组卷
|
8卷引用:2015年全国普通高等学校招生统一考试化学(上海卷)
2015年全国普通高等学校招生统一考试化学(上海卷)2016届黑龙江省哈尔滨第六中学高三上期中测试化学试卷2016届山西省山西大学附属中学高三上12月月考化学试卷(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题江苏省南通市2023-2024学年高三下学期化学调研测试卷
9 . 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是_________ ,非金属性最强的是_________ (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是___________ (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为______________ ,其中存在的化学键类型为_______________ ;
(4)比较D、E最高价氧化物的水化物的酸性大小关系_____________________ ; (用化学式表示)
(5)单质E与水反应的离子方程式为_________________________ ;
(6)C最高价氧化物对应水化物与E最高价氧化物对应水化物反应的离子方程式____________ 。
(1)五种元素中,原子半径最大的是
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为
(4)比较D、E最高价氧化物的水化物的酸性大小关系
(5)单质E与水反应的离子方程式为
(6)C最高价氧化物对应水化物与E最高价氧化物对应水化物反应的离子方程式
您最近一年使用:0次
名校
10 . 短周期主族元素X、Y、Z、Q、R的原子序数依次增大,其中X的单质是密度最小的气体,Z是同周期中原子半径最大的元素,Y与Q同主族,且Q的原子序数是Y的两倍。回答下列问题:
(1)Z的原子结构示意图为__________ ,R在元素周期表中的位置是______________ 。
(2)Z的最高价氧化物对应水化物所含化学键类型是_______________ 。Q、R的最高价氧化物对应的水化物酸性较强的是__________ (填化学式)。
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为_______ 。将Q的低价氧化物通入T可以生成一种强酸,反应的化学方程式为___________________ 。
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为______________________ 。
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g) 4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=
4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=_______ ;A在平衡混合物中的体积分数为________ ;从反应开始至平衡时,以C的浓度变化表示该反应的平均速率v(C)=_____________ 。
(1)Z的原子结构示意图为
(2)Z的最高价氧化物对应水化物所含化学键类型是
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g)
 4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=
4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=
您最近一年使用:0次



