解题方法
1 . 回答下列问题:
(1)符号“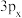 ”没有给出的信息是
”没有给出的信息是___________ 。
A.能层
B.能级
C.电子云在空间的伸展方向
D.电子的自旋方向
(2)将 通入稀NaOH溶液中可生成
通入稀NaOH溶液中可生成 。
。 中氧原子的杂化方式为
中氧原子的杂化方式为___________ 。
(3) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。基态
反应制得。基态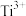 的电子占据的最高能层符号为
的电子占据的最高能层符号为___________ ,该能层具有的原子轨道数为___________ , 的立体结构是
的立体结构是___________ 。
(4)目前发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。氯化铍在气态时存在 分子(a)和二聚分子
分子(a)和二聚分子 (b),a属于
(b),a属于___________ (填“离子”或“共价”)化合物;b中Be原子的杂化方式相同。且所有原子都在同一平面上,则b的结构式为___________ (标出配位键)。
(5)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般 或
或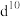 排布无颜色,
排布无颜色, 排布有颜色。如
排布有颜色。如 显粉红色。据此判断:
显粉红色。据此判断: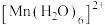
___________ (填“无”或“有”)颜色。
(6)过渡金属易与CO形成羰基配合物,如配合物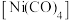 ,常温下为液态,易溶于
,常温下为液态,易溶于 、苯等有机溶剂。
、苯等有机溶剂。
①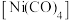 固态时属于
固态时属于___________ 分子(填极性或非极性);
②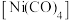 中Ni与CO的
中Ni与CO的___________ 原子形成配位键;
③ 分子中
分子中 键与
键与 键个数比为
键个数比为___________ 。
(1)符号“
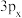 ”没有给出的信息是
”没有给出的信息是A.能层
B.能级
C.电子云在空间的伸展方向
D.电子的自旋方向
(2)将
 通入稀NaOH溶液中可生成
通入稀NaOH溶液中可生成 。
。 中氧原子的杂化方式为
中氧原子的杂化方式为(3)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。基态
反应制得。基态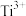 的电子占据的最高能层符号为
的电子占据的最高能层符号为 的立体结构是
的立体结构是(4)目前发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。氯化铍在气态时存在
 分子(a)和二聚分子
分子(a)和二聚分子 (b),a属于
(b),a属于(5)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般
 或
或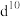 排布无颜色,
排布无颜色, 排布有颜色。如
排布有颜色。如 显粉红色。据此判断:
显粉红色。据此判断: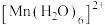
(6)过渡金属易与CO形成羰基配合物,如配合物
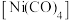 ,常温下为液态,易溶于
,常温下为液态,易溶于 、苯等有机溶剂。
、苯等有机溶剂。①
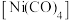 固态时属于
固态时属于②
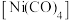 中Ni与CO的
中Ni与CO的③
 分子中
分子中 键与
键与 键个数比为
键个数比为
您最近一年使用:0次
2 . 太阳能电池一共可分为三代,请回答下列问题:
(1)第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为___________ ,电子占据的最高能级的电子云轮廓图为___________ 。
②根据对角线规则,Si的一些化学性质与___________ (填短周期元素名称)相似。
(2)第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:Ga___________ As(填“大于”或“小于”,下同),第一电离能:Ga___________ As。
② 分子含有
分子含有___________ (填“ 键”或“
键”或“ 键”),As的最高价氧化物的化学式为
键”),As的最高价氧化物的化学式为___________ 。
③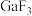 的熔点约为1000℃,
的熔点约为1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是___________ 。
④Ga、F、Cl的电负性由大到小的顺序为___________ 。
(3)第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为 、
、 和有机碱离子
和有机碱离子 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。

①该有机碱离子中,C、N原子的杂化轨道类型分别为___________ 、___________ 。
②若晶胞参数为apm,则晶体密度为___________  。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,列出计算式)
,列出计算式)
(1)第一代太阳能电池为硅基太阳能电池,其中以单晶硅太阳能电池的转化效率最高,技术最为成熟,应用最为广泛。
①在基态Si原子中,电子占据的最高能层符号为
②根据对角线规则,Si的一些化学性质与
(2)第二代太阳能电池是薄膜太阳能电池,如砷化镓电池。
①原子半径:Ga
②
 分子含有
分子含有 键”或“
键”或“ 键”),As的最高价氧化物的化学式为
键”),As的最高价氧化物的化学式为③
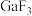 的熔点约为1000℃,
的熔点约为1000℃, 的熔点为77.9℃,其原因是
的熔点为77.9℃,其原因是④Ga、F、Cl的电负性由大到小的顺序为
(3)第三代太阳能电池—钙钛矿型太阳能电池,它利用有机金属卤化物(组成为
 、
、 和有机碱离子
和有机碱离子 )作为吸光材料,其晶胞结构如图所示。
)作为吸光材料,其晶胞结构如图所示。
①该有机碱离子中,C、N原子的杂化轨道类型分别为
②若晶胞参数为apm,则晶体密度为
 。(阿伏加德罗常数的值为
。(阿伏加德罗常数的值为 ,列出计算式)
,列出计算式)
您最近一年使用:0次
3 . 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为___________ 。
(2)均由X、Y、Z三种元素组成的三种常见物质A.、B、C分别属于酸、碱、盐,其化学式依次为___________ 、___________ 、___________ ,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为___________ 。
(3)Z、W两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z两种元素第一电离能的大小关系为___________ (填“大于”“等于”或“小于”)。
(1)W原子的核外电子排布式为
(2)均由X、Y、Z三种元素组成的三种常见物质A.、B、C分别属于酸、碱、盐,其化学式依次为
(3)Z、W两种元素电负性的大小关系为
您最近一年使用:0次
解题方法
4 . 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中 与
与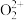 互为等电子体,
互为等电子体,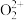 的电子式可表示为
的电子式可表示为___________ ;1 mol 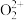 中含有的π键数目为
中含有的π键数目为___________ 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为___________ 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________ ;分子中处于同一直线上的原子数目最多为___________ 。
(1)CaC2中
 与
与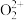 互为等电子体,
互为等电子体,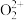 的电子式可表示为
的电子式可表示为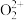 中含有的π键数目为
中含有的π键数目为(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是
您最近一年使用:0次
解题方法
5 . 2020年诺贝尔化学奖正式授予法国科学家Emmanuelle Charpentier和美国科学家Jennifer A.Doudna,以表彰其“开发出一种基因组编辑方法”,利用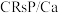 基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的
基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的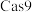 蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。

(1)基态C原子价层电子的轨道表达式为_______ 。基态C原子核外电子占据最高能级的电子云轮廓图为_______ 形。
(2)赖氨酸中N原子的杂化轨道类型为_______ 。
(3)C、N、O三种元素的第一电离能由小到大的顺序为_______ ,原因是_______ 。
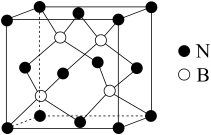
(4)氨硼烷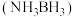 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物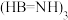 通过反应
通过反应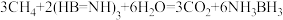 制得。
制得。
①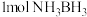 分子中有
分子中有_______  键。
键。
②与 互为等电子体的一种分子为
互为等电子体的一种分子为_______ (填分子式)。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,晶胞结构如图所示。它的硬度比金刚石低,原因是_______ 。设 为阿伏加德罗常数的值,若晶胞参数为
为阿伏加德罗常数的值,若晶胞参数为 ,则晶体密度为
,则晶体密度为_______  (列出计算式)。
(列出计算式)。
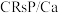 基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的
基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的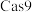 蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
(1)基态C原子价层电子的轨道表达式为
(2)赖氨酸中N原子的杂化轨道类型为
(3)C、N、O三种元素的第一电离能由小到大的顺序为
(4)氨硼烷
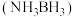 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物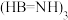 通过反应
通过反应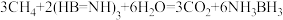 制得。
制得。①
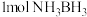 分子中有
分子中有 键。
键。②与
 互为等电子体的一种分子为
互为等电子体的一种分子为③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,晶胞结构如图所示。它的硬度比金刚石低,原因是
 为阿伏加德罗常数的值,若晶胞参数为
为阿伏加德罗常数的值,若晶胞参数为 ,则晶体密度为
,则晶体密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
6 . 金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)钛元素位于元素周期表的___________ 区,其基态原子核外电子有___________ 种空间运动状态。
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO 的空间构型是
的空间构型是___________ ,第一电离能介于Al、P之间的第三周期元素为___________ (填元素符号)。
(3)TiCl4可以与胺形成配合物,如[TiCl4(CH3NH2)2]、[TiCl4(H2NCH2CH2NH2)]等。
①[TiCl4(H2NCH2CH2NH2)]中Ti的配位数是___________ 。
②1 mol H2NCH2CH2NH2中含有的σ键物质的量为___________ 。
③配合物[TiCl4(H2NCH2CH2NH2)]与游离的H2NCH2CH2NH2分子相比,其H-N-H键角___________ (填“较大”,“较小”或“相同”),原因是___________ 。
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为___________ 、___________ 。该晶胞中B、C两个氧原子之间的核间距d=___________ pm。

(1)钛元素位于元素周期表的
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO
 的空间构型是
的空间构型是(3)TiCl4可以与胺形成配合物,如[TiCl4(CH3NH2)2]、[TiCl4(H2NCH2CH2NH2)]等。
①[TiCl4(H2NCH2CH2NH2)]中Ti的配位数是
②1 mol H2NCH2CH2NH2中含有的σ键物质的量为
③配合物[TiCl4(H2NCH2CH2NH2)]与游离的H2NCH2CH2NH2分子相比,其H-N-H键角
(4)TiO2的一种晶胞具有典型的四方晶系结构(如图所示),以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。晶胞中A、B的原子坐标为(0.31,0.31,0),(0.81,0.19,0.5)。已知晶胞含对称中心,则C、D原子坐标为

您最近一年使用:0次
2021-04-07更新
|
419次组卷
|
3卷引用:山西省吕梁市名校金科大联考2021-2022学年高三上学期12月月考化学试题
名校
7 . 顺铂的结构简式为 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题
。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题
(1)下列说法正确的是______
A.碳铂分子中有一个手性碳原子
B.顺铂与反铂化学键类型相同,分子的化学性质相同
C.碳铂的中心原子铂的配位数为4
D.[PtCl(NH3)2(H2O)]+中H2O的H原子与Pt形成配位键
(2)顺铂和反铂的物理性质有很大差异,其中只有_______ 易溶于水,原因是_______ 。
(3)NH3还能与很多化合物通过配位键发生相互作用。一种可作储氢材料的化合物X是NH3与第二周期另一种元素的氢化物通过化合反应形成配位键得到的产物,X是乙烷的等电子体;加热化合物X会缓慢释放出H2,并转化成化合物Y,Y是乙烯的等电子体。
①化合物X的结构式为_______ (必须标明配位键)。
②化合物X、Y中N原子分别采取_______ 杂化和_______ 杂化。
 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题
。顺铂进入人体后,一个氯原子缓慢被水分子取代,形成[PtCl(NH3)2(H2O)]+。请回答下列问题(1)下列说法正确的是
A.碳铂分子中有一个手性碳原子
B.顺铂与反铂化学键类型相同,分子的化学性质相同
C.碳铂的中心原子铂的配位数为4
D.[PtCl(NH3)2(H2O)]+中H2O的H原子与Pt形成配位键
(2)顺铂和反铂的物理性质有很大差异,其中只有
(3)NH3还能与很多化合物通过配位键发生相互作用。一种可作储氢材料的化合物X是NH3与第二周期另一种元素的氢化物通过化合反应形成配位键得到的产物,X是乙烷的等电子体;加热化合物X会缓慢释放出H2,并转化成化合物Y,Y是乙烯的等电子体。
①化合物X的结构式为
②化合物X、Y中N原子分别采取
您最近一年使用:0次
解题方法
8 . 2020年8月中科大在铁基高温超导体研究中取得重要进展,BaFe2As2是一种重要的铁基高温超导体。
(1)基态Fe原子的核外电子排布式为______ ,基态As原子中电子占据能量最高的原子轨道为______ 。
(2)Ni2+和Fe2+可形成如图A所示的配合物离子,该配合物离子中C原子的杂化方式为______ ,Ni2+的配位数为______ ;N、S、O第一电离能由大到小的顺序为______ 。

(3)该配合物离子中Fe2+的一个配体是茂环阴离子(C5H )。已知分子中的大π键可用符号
)。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 ,则C5H
,则C5H 中的大π键可以表示为
中的大π键可以表示为______ 。
(4) BaFe2As2的晶胞结构如图B所示,该晶体的密度是______ g·cm-3(用N、表示阿伏加德罗常数的值)。图C是该晶胞的俯视图,将图补充完整______ 。
(1)基态Fe原子的核外电子排布式为
(2)Ni2+和Fe2+可形成如图A所示的配合物离子,该配合物离子中C原子的杂化方式为

(3)该配合物离子中Fe2+的一个配体是茂环阴离子(C5H
 )。已知分子中的大π键可用符号
)。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大键的电子数(如苯分子中的大π键可表示为 ,则C5H
,则C5H 中的大π键可以表示为
中的大π键可以表示为(4) BaFe2As2的晶胞结构如图B所示,该晶体的密度是
您最近一年使用:0次
解题方法
9 . 据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位化合物(如图a所示),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。

请回答下列问题:
(1)基态Ni原子的价电子轨道表示式为______ ,图a中1mol配合物含σ键数目为______ 。
(2)C、N、O三种元素中电负性最小的是______ (填元素符号),C在形成化合物时,其键型以共价键为主,原因是______ 。
(3)Ni(NO3)2中阴离子的空间构型是______ ,写出与该阴离子互为等电子体的一种分子的化学式:______ 。
(4)图a配合物中,碳原子的杂化类型是______ 。已知:常压下CH3COOH的沸点为117.9℃,甲酸甲酯(HCOOCH3)的沸点为32℃,CH3COOH的沸点高于HCOOCH3的主要原因是______ 。
(5)已知:氧化镍的晶胞结构如图b所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的两个O2-之间的距离为______ pm(用含ρ、NA的代数式表示)。
②一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中,如图c所示。已知O2-的半径为am,阿伏加德罗常数的值为NA,则每平方米上分散的该晶体的质量为______ g。(用含a、NA、的代数式表示,图中大白球表示O2-,小黑球表示Ni2+)

请回答下列问题:
(1)基态Ni原子的价电子轨道表示式为
(2)C、N、O三种元素中电负性最小的是
(3)Ni(NO3)2中阴离子的空间构型是
(4)图a配合物中,碳原子的杂化类型是
(5)已知:氧化镍的晶胞结构如图b所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的两个O2-之间的距离为
②一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中,如图c所示。已知O2-的半径为am,阿伏加德罗常数的值为NA,则每平方米上分散的该晶体的质量为
您最近一年使用:0次
解题方法
10 . 我国云南镍白铜(铜镍合金)闻名中外,曾主要用于制作仿银饰品和造币。请回答:
(1)铜元素在元素周期表中的位置为______ 。
(2)基态镍原子的价层电子排布式为______ ,未成对的电子数为______ ,位于周期表______ 区。
(3)铜元素的第二电离能为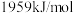 ,镍元素的第二电离能为
,镍元素的第二电离能为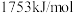 ,铜的第二电离能较大,其主要原因是
,铜的第二电离能较大,其主要原因是______ 。
(4)向硫酸铜溶液逐渐滴加氨水可得到 溶液,
溶液, 中阴离子的立体构型是
中阴离子的立体构型是______ ,NH3中N的杂化方式为______ 。
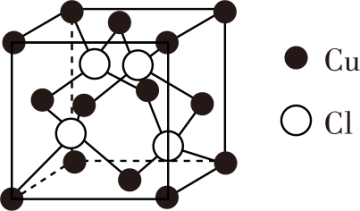
(5)铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为______ ,每个铜原子周围距离最近的铜原子数目为______ 个。已知该晶体的密度为 ,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为______ pm(列出计算式即可)。
(1)铜元素在元素周期表中的位置为
(2)基态镍原子的价层电子排布式为
(3)铜元素的第二电离能为
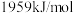 ,镍元素的第二电离能为
,镍元素的第二电离能为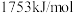 ,铜的第二电离能较大,其主要原因是
,铜的第二电离能较大,其主要原因是(4)向硫酸铜溶液逐渐滴加氨水可得到
 溶液,
溶液, 中阴离子的立体构型是
中阴离子的立体构型是(5)铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为
 ,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次



