1 . I.金(79Au)是一种非常稳定的金属,但也可以形成多种化合物,并在化合物中呈一价或三价。
(1)已知Au的基态原子的价电子排布式为5dl06s1,则Au位于周期表______ 区。基态Au3+的价电子中空间运动状态不同的电子数为______ 种
(2)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大球为Cs,小球为Cl,其余球为Au。
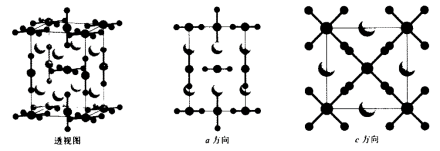
该化合物的化学式为______ ,其中金原子有2种不同的化学环境,形成2种不同的配离子,它们分别是______ 和______ 。
II.过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(3)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]+。己如SzCl2的分子结构与H2O2相似,第一电离能(I1): I1(O)______ I1(S)(填“大于或“小于”),原因是______ ;沸点: H2O2______ S2Cl2(填“>”或“<”),其原因是______ 。
(4)超细铜粉可用作导电材料、催化剂等,制备方法如下:
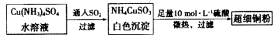
①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为______ 不同之处为______ ( 填标号)
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
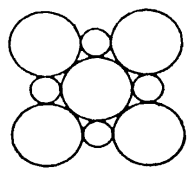
III.(5)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为______ nm(结果保留三位小数)。
(1)已知Au的基态原子的价电子排布式为5dl06s1,则Au位于周期表
(2)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大球为Cs,小球为Cl,其余球为Au。

该化合物的化学式为
II.过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(3)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]+。己如SzCl2的分子结构与H2O2相似,第一电离能(I1): I1(O)
(4)超细铜粉可用作导电材料、催化剂等,制备方法如下:

①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
III.(5)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
解题方法
2 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回 答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]___________ ,有___________ 种不同运动状态的电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________ 。
(3)如下表所示,GeCl4、GeBr4、GeI4的熔沸点依次升高,原因___________ 。
(4)催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn位于周期表___________ 区,Zn、Ge、O电负性由大至小的顺序是___________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为___________ ,微粒之间存在的作用力是___________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2 );C为(1/2,1/2,0)。则D原子的坐标参数为___________ 。
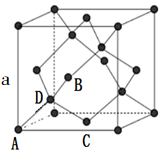
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为___________ g·cm-3(阿佛加的罗常数的值用NA表示。列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)如下表所示,GeCl4、GeBr4、GeI4的熔沸点依次升高,原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/C | -49.5 | 26 | 146 |
| 沸点/C | 83.1 | 186 | 约400 |
(4)催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn位于周期表
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2 );C为(1/2,1/2,0)。则D原子的坐标参数为


②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次
名校
解题方法
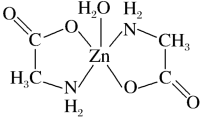
3 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图。 的价电子排布式为
的价电子排布式为_______ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是_______ 。
(2)甘氨酸(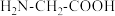 )中N的杂化轨道类型为
)中N的杂化轨道类型为_______ ;甘氨酸易溶于水,试从结构角度解释_______ 。
(3)一水合甘氨酸锌中 的配位数为
的配位数为_______ 。 填入
填入 组成
组成_______ 空隙中;
②由①能否判断出 、
、 相切?
相切?_______ (填“能”或“否”);
③已知晶体密度为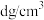 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为_______ pm(写计算表达式)。
 的价电子排布式为
的价电子排布式为(2)甘氨酸(
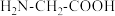 )中N的杂化轨道类型为
)中N的杂化轨道类型为(3)一水合甘氨酸锌中
 的配位数为
的配位数为(4) 是
是 的另一种配合物,IMI的结构为
的另一种配合物,IMI的结构为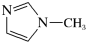 ,常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态。原因是
为液态而非固态。原因是
 填入
填入 组成
组成②由①能否判断出
 、
、 相切?
相切?③已知晶体密度为
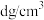 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为
您最近一年使用:0次
2021-01-03更新
|
379次组卷
|
6卷引用:山西省大同市第一中学2020届高三3月月考理综化学试题
解题方法
4 . 锰及其化合物用途非常广泛,请回答下列问题:
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是__ 。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是__ 原子(填写元素名称),该分子中碳原子的杂化方式为__ 。
(3)研究发现,在合成甲醇反应(CO2+3H2=CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为__ 。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是__ 。
A.SO2 B.SO C.H2S D.CS2
C.H2S D.CS2
(5)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),试在小立方体的顶点画出C原子(用○表示)的位置,在大正方体画出相应Si原子的位置___ 。

(6)某锰氧化物的晶胞结构如图所示:

该锰的氧化物的化学式为__ ,该晶体中Mn的配位数为__ ,该晶体中Mn之间的最近距离为__ pm(用a、b来表示)。
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(3)研究发现,在合成甲醇反应(CO2+3H2=CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是
A.SO2 B.SO
 C.H2S D.CS2
C.H2S D.CS2(5)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),试在小立方体的顶点画出C原子(用○表示)的位置,在大正方体画出相应Si原子的位置

(6)某锰氧化物的晶胞结构如图所示:

该锰的氧化物的化学式为
您最近一年使用:0次
5 . 国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
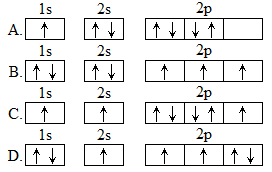
(1)下列氮原子的电子排布图表示的状态中,能量最高的是___________ (填字母标号)。
(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是___________ (填字母标号)。
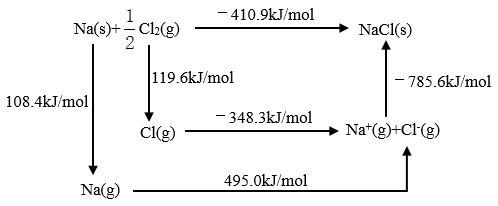
a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为___________ 。
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为___________ (用NA表示阿伏加德罗常数的值)。
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.5g∙cm-3,则CuF的晶胞参数a=___________ nm(列出计算式)。

(1)下列氮原子的电子排布图表示的状态中,能量最高的是

(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
解题方法
6 . A、B、C、D、E为原子序数依次增大的五种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子;E为原子序数最小的ds区元素。回答下列问题:
(1)五种元素中电负性最大的是_____ (填元素符号),其中E原子的价电子排布式为________ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式),原因是________ 。
(3)C和D反应可生成组成比为1∶3的化合物F,F的立体构型为________ ,中心原子的杂化轨道类型为____ ;化合物D2A的立体构型为______ 。
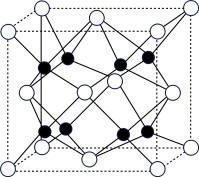
(4)A和B能够形成化合物G,其晶胞结构如图所示,晶胞参数a=0.566 nm,G的化学式为_______ ;晶胞中A原子的配位数为_______ ;已知阿伏加德罗常数的值用NA表示,晶体G的密度为________ g·cm-3(列出计算式)。
(1)五种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1∶3的化合物F,F的立体构型为
(4)A和B能够形成化合物G,其晶胞结构如图所示,晶胞参数a=0.566 nm,G的化学式为

您最近一年使用:0次
2020-12-08更新
|
254次组卷
|
2卷引用:山西省榆社中学2021届高三上学期第六次模块诊断化学试题
解题方法
7 . 我国科学家在水中将N2和CO2进行电化学耦合以合成CO(NH2)2(尿素),其催化剂由TiO2纳米薄片与Pd-Cu合金纳米颗粒组成,其过程如图所示。

(1)基态Ti原子的核外电子排布式为_____ ,Cu在周期表中的位置为______ 。
(2)尿素分子中C和N原子的杂化方式分别是____ ,C、N、O三种元素的第一电离能由大到小的顺序是_____ ,电负性由大到小的顺序是_____ 。
(3)氮化硼晶体具有熔沸点高、耐磨和较高的硬度等性质,则它的晶体类型是_____ ;根据对角线规则,硼的一些化学性质与元素______ 的相似。
(4)在碱性条件下尿素可以被氧化生成碳酸根离子,该离子的空间构型为______ ,其中心原子的价层电子对数是________ 。
(5)已知铁有α、γ、δ三种晶体结构,并且在一定条件下可以相互转化(如图),
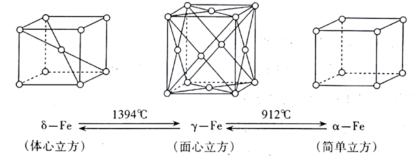
①若α-Fe晶胞边长为acm,δ-Fe晶胞边长为b cm,则两种晶体的密度比为_______ 。(用含a、b的代数式表示)
②Fe3C是工业炼铁生产过程中产生的一种铁合金。在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围形成八面体结构,则铁原子的配位数为________ 。
③事实上,Fe3C是碳与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙)。则形成碳化铁的铁的三种晶体结构中,最有可能的是______ 。(填“α-Fe”、“γ-Fe”或“δ-Fe”)

(1)基态Ti原子的核外电子排布式为
(2)尿素分子中C和N原子的杂化方式分别是
(3)氮化硼晶体具有熔沸点高、耐磨和较高的硬度等性质,则它的晶体类型是
(4)在碱性条件下尿素可以被氧化生成碳酸根离子,该离子的空间构型为
(5)已知铁有α、γ、δ三种晶体结构,并且在一定条件下可以相互转化(如图),

①若α-Fe晶胞边长为acm,δ-Fe晶胞边长为b cm,则两种晶体的密度比为
②Fe3C是工业炼铁生产过程中产生的一种铁合金。在Fe3C晶体中,每个碳原子被6个位于顶角位置的铁原子所包围形成八面体结构,则铁原子的配位数为
③事实上,Fe3C是碳与铁的晶体在高温下形成的间隙化合物(即碳原子填入铁晶体中的某些空隙)。则形成碳化铁的铁的三种晶体结构中,最有可能的是
您最近一年使用:0次
名校
解题方法
8 . 研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。回答下列问题:
(1)铜的晶胞结构如下图所示,铜原子的配位数为____ ,基态铜原子价层电子排布式为____ 。

(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是_______ ,
(3)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是______ , 的空间构型为
的空间构型为__________ 。
(4)氨缩脲( )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为__ ,σ 键与π键的数目之比为___ 。氨缩脲与胆矾溶液反应得到如图所示的紫色物质,1 mol紫色物质中含配位键的数目为____ 。

(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1 ,0)。

①原子B的坐标参数为_______
②)若该晶体密度为dg·cm-3,则铜镍原子间最短距离为______
(1)铜的晶胞结构如下图所示,铜原子的配位数为

(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(3)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),碱式硫酸铜中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为(4)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1 ,0)。

①原子B的坐标参数为
②)若该晶体密度为dg·cm-3,则铜镍原子间最短距离为
您最近一年使用:0次
2020-11-01更新
|
475次组卷
|
4卷引用:山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)
山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)广西南宁市普通高中2021届高三10月摸底测试理科综合化学试题(已下线)2021年秋季高三化学开学摸底考试卷03(山东专用)福建省南平市高级中学2022-2023学年高二下学期期中考试化学试题
9 . ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)基态氮原子的价电子排布图是___ ;基态砷原子的电子排布式为___ 。
(2)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是___ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是___ 。
(4)Na3AsO4可作杀虫剂。AsO 的立体构型为
的立体构型为___ ,与其互为等电子体的一种分子为___ 。
(5)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为___ ,砷原子采取___ 杂化。
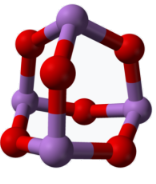
(6)GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与___ 个Ga相连。
(1)基态氮原子的价电子排布图是
(2)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)Na3AsO4可作杀虫剂。AsO
 的立体构型为
的立体构型为(5)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为

(6)GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与
您最近一年使用:0次
名校
解题方法
10 . 氢能作为理想的清洁能源之一,已经受到世界各国的普遍关注。氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢方法有:配位氢化物储氢、碳质材料储氢、合金储氢、多孔材料储氢等。请回答下列问题:
(1)氨硼烷(NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①C、N、O第一电离能由大到小的顺序为___________ ,CH4、H2O、CO2键角由大到小的顺序为___________ ,原因为____________________________________________ 。
②)1 mol(HB=NH)3分子中有_____ 个σ键。与(HB=NH)3互为等电子体的分子为_______ (填分子式)。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是____________________________________________ 。
(2)一种储氢合金由镍和镧(La)组成,其晶胞结构如图所示。

①Ni的基态原子核外电子排布式为___________ 。
②该晶体的化学式为___________ 。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为p g·cm-3;阿伏加 德罗常数的值为NA。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________ 。(储氢能力=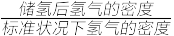 )
)
(1)氨硼烷(NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①C、N、O第一电离能由大到小的顺序为
②)1 mol(HB=NH)3分子中有
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是
(2)一种储氢合金由镍和镧(La)组成,其晶胞结构如图所示。

①Ni的基态原子核外电子排布式为
②该晶体的化学式为
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为p g·cm-3;阿伏加 德罗常数的值为NA。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
 )
)
您最近一年使用:0次
2020-09-24更新
|
112次组卷
|
2卷引用:山西省运城市2021届高三上学期9月调研考试化学试题



