名校
1 .  晶体具有优异的非线性光学性能。我国科学工作者制备的超大
晶体具有优异的非线性光学性能。我国科学工作者制备的超大 晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在 的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是_______ (填离子符号)。
(2)已知有关氨、磷的单键和三键的键能( )如表:
)如表:
从能量角度看,氮以 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是_______ 。
(3)已知 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为_______ ,其中P采取_______ 杂化方式。
(4)磷酸通过分子间脱水缩合形成多磷酸,如:

如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为_______ 。
(5)分别用○、●表示 和
和 ,
, 晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是
晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是 、
、 在晶胞xz面、yz面上的位置:
在晶胞xz面、yz面上的位置:

①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA,晶体的密度_______  (写出表达式)。
(写出表达式)。
②晶胞在x轴方向的投影图为_______ (填标号)。

 晶体具有优异的非线性光学性能。我国科学工作者制备的超大
晶体具有优异的非线性光学性能。我国科学工作者制备的超大 晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:(1)在
 的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(2)已知有关氨、磷的单键和三键的键能(
 )如表:
)如表:| N-N | N≡N | P-P | P≡P |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以
 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是(3)已知
 是次磷酸的正盐,
是次磷酸的正盐, 的结构式为
的结构式为(4)磷酸通过分子间脱水缩合形成多磷酸,如:

如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为
(5)分别用○、●表示
 和
和 ,
, 晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是
晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是 、
、 在晶胞xz面、yz面上的位置:
在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA,晶体的密度
 (写出表达式)。
(写出表达式)。②晶胞在x轴方向的投影图为

您最近一年使用:0次
名校
解题方法
2 . 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为_______ ,基态铁原子的价电子排布式为_______ 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_______ ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为_______ 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型有_______ 。
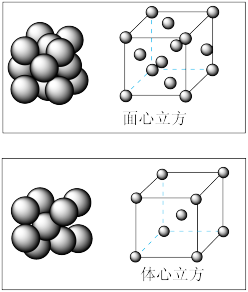
(4)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为_______ ,面心立方堆积(铁原子在面对角线方向相切)与体心立方堆积(铁原子在体对角线方向相切)的两种铁晶体的密度之比为_______ (写出已化简的比例式即可)。
(1)C、N、O的第一电离能由大到小的顺序为
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型有
(4)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为

您最近一年使用:0次
名校
解题方法
3 . 原子序数依次增大且小于36的X、Y、Z、W四种元素,其中X是形成化合物最多的元素之一,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)写出元素名称:X_______ 、Y_______ 。
(2)Y2X2分子中Y原子轨道的杂化类型为_______ ,1mol Y2X2含有σ键的数目为_______ 。
(3)化合物ZX3中Z原子轨道的杂化类型为_______ ,ZX3的沸点比化合物YX4的高,其主要原因是_______ 。
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体(等电子体是指价电子总数和原子总数相等的两种微粒),元素Z的这种氧化物的分子式是_______ 。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是_______ ,它可与浓盐酸发生非氧化还原反应,生成配合物H nWCl3,反应的化学方程式为_______ 。

(1)写出元素名称:X
(2)Y2X2分子中Y原子轨道的杂化类型为
(3)化合物ZX3中Z原子轨道的杂化类型为
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体(等电子体是指价电子总数和原子总数相等的两种微粒),元素Z的这种氧化物的分子式是
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

您最近一年使用:0次
解题方法
4 . 我国科学家研究了具有高稳定性的二维硼烯氧化物(BmOn)的超导电性。回答下列问题:
(1)第一电离能介于B、N之间的第二周期元素为_______ (填元素符号)。
(2)①已知二维硼烯氧化物的部分结构如图所示,则该氧化物的化学式为_____ ,其中硼原子的杂化轨道类型为_____ 。

②键长和键角的数值可通过晶体的X射线衍射实验获得。经过该实验测定,二维硼烯氧化物中B-B键的键长大于B-O键的键长,其原因是_______ 。
(3)硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因_______ 。
(4)LiBH4 -LiI复合材料在低温下表现出较高的离子电导率。BH 离子中H的化合价为-1,其原因可能是
离子中H的化合价为-1,其原因可能是 _______ ,BH 可以被PS
可以被PS 离子部分取代,PS
离子部分取代,PS 离子的空间结构为
离子的空间结构为_______ 。
(5)Fe3O4是电子导体,其导电率显著高于Fe2O3,这归因于Fe2+和Fe3+中心之间的电子交换。如图甲所示, Fe3O4晶体中,O2-围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中, Fe2+和另一半 Fe3+填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为_______ 。FeO 、Fe2O3都具有与Fe3O4相似的立方堆积结构,氧化亚铁晶体的晶胞如图乙所示,已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶体中,与Fe2+紧邻且等距离的Fe2+数目为_______ ;Fe2+与O2-的最短核间距为_______ cm(列出计算式)。

(1)第一电离能介于B、N之间的第二周期元素为
(2)①已知二维硼烯氧化物的部分结构如图所示,则该氧化物的化学式为

②键长和键角的数值可通过晶体的X射线衍射实验获得。经过该实验测定,二维硼烯氧化物中B-B键的键长大于B-O键的键长,其原因是
(3)硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因
(4)LiBH4 -LiI复合材料在低温下表现出较高的离子电导率。BH
 离子中H的化合价为-1,其原因可能是
离子中H的化合价为-1,其原因可能是  可以被PS
可以被PS 离子部分取代,PS
离子部分取代,PS 离子的空间结构为
离子的空间结构为(5)Fe3O4是电子导体,其导电率显著高于Fe2O3,这归因于Fe2+和Fe3+中心之间的电子交换。如图甲所示, Fe3O4晶体中,O2-围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中, Fe2+和另一半 Fe3+填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为

您最近一年使用:0次
解题方法
5 . 汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。很多含巯基(-SH)的有机化合物是重金属元素求的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

(1)汞的原子序数为80,与Zn属于同族元素,Hg价电子排布式为_______ ,位于元素周期表_______ 区。
(2)C、O、S分别形成的简单氢化物的沸点由高到低顺序为_______ ,理由_______ 。
(3)预测化合物I溶解性为_______ (填“难溶于水”或“易溶于水”);1mol化合物I中采取sp3杂化的原子数目是_______ 。
(4)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分锗原子被Hg和Sb取代后形成。

①图b为Ce晶胞中部分锗原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是_______ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;X晶体的化学式为:_______ ;设X的相对分子质量为 ,则X晶体的密度为
,则X晶体的密度为_______ g·cm-3(列出计算式)。

(1)汞的原子序数为80,与Zn属于同族元素,Hg价电子排布式为
(2)C、O、S分别形成的简单氢化物的沸点由高到低顺序为
(3)预测化合物I溶解性为
(4)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分锗原子被Hg和Sb取代后形成。

①图b为Ce晶胞中部分锗原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
 ,则X晶体的密度为
,则X晶体的密度为
您最近一年使用:0次
名校
解题方法
6 . 2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)已知Sn和Si同族,基态Sn原子价层电子的空间运动状态有_______ 种,基态氧原子的价层电子排布式不能表示为2s22p 2p
2p ,因为这违背了
,因为这违背了_______ (填选项)。
A.泡利原理 B.洪特规则 C.能量最低原理
(2)[B(OH)4]-中硼原子的杂化轨道类型为_______ ,[B(OH)4]-的空间构型为_______ 。[Sn(OH)6] 2-中,Sn与O之间的化学键不可能是_______ (填选项)。
A.π键 B. σ键 C.配位键 D.极性键
(3)碳酸钡、碳酸镁分解温度较低的是_______ ,分解得到的金属氧化物中,熔点较低的是BaO,其原因是_______ 。
(4)超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为_______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为_______ g·cm-3(列出含a、NA的计算式即可)。

(1)已知Sn和Si同族,基态Sn原子价层电子的空间运动状态有
 2p
2p ,因为这违背了
,因为这违背了A.泡利原理 B.洪特规则 C.能量最低原理
(2)[B(OH)4]-中硼原子的杂化轨道类型为
A.π键 B. σ键 C.配位键 D.极性键
(3)碳酸钡、碳酸镁分解温度较低的是
(4)超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
2022-04-26更新
|
731次组卷
|
3卷引用:山西省太原市第五中学2022届高三下学期5月阶段性检测理综化学试题
山西省太原市第五中学2022届高三下学期5月阶段性检测理综化学试题四川省遂宁市2021-2022学年高三下学期三诊化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)
名校
解题方法
7 . 硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)氮原子核外有_______ 种不同运动状态的电子。
(2)铵盐大多不稳定。请判断NH4F、NH4I中,谁较易分解并说明理由:_______ 。
(3)经测定发现,N2O5固体由NO 和
和 两种离子组成,该固体中氮原子杂化类型为
两种离子组成,该固体中氮原子杂化类型为_____ 。
(4)第2周期中,第一电离能介于硼元素和氮元素间的元素为_______ (填元素符号)。
(5)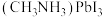 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
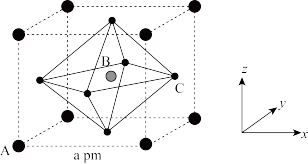
①原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),则C的原子分数坐标为_______ 。
②该晶胞沿体对角线方向的投影图为_______ (填标号)。
a.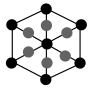 b.
b. 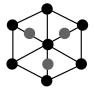 c.
c.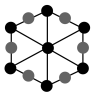 d.
d.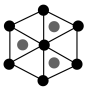
(6)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______ 个硼原子构成。

(7)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,硼、氮原子相互交替排列(见图II),其晶胞结构如图III所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为_______ g/cm3(用含a、b、NA的代数式表示)。
(1)氮原子核外有
(2)铵盐大多不稳定。请判断NH4F、NH4I中,谁较易分解并说明理由:
(3)经测定发现,N2O5固体由NO
 和
和 两种离子组成,该固体中氮原子杂化类型为
两种离子组成,该固体中氮原子杂化类型为(4)第2周期中,第一电离能介于硼元素和氮元素间的元素为
(5)
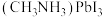 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
①原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),则C的原子分数坐标为
②该晶胞沿体对角线方向的投影图为
a.
 b.
b.  c.
c. d.
d.
(6)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由

(7)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,硼、氮原子相互交替排列(见图II),其晶胞结构如图III所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为
您最近一年使用:0次
解题方法
8 . X、Y、Z、E、F五种元素的原子序数依次递增。已知:F位于周期表中第四周期IB族,其余的均为短周期主族元素,X、E同主族,E的氧化物是光导纤维的主要成分,X是形成化合物种类最多的元素之一,基态Z原子核外p轨道的未成对电子数为2。请回答下列问题:
(1)基态Y原子价层电子排布式为____ 。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ ,表示,则与之相反的用-
,表示,则与之相反的用- 表示,这称为电子的自旋量子数。对于基态的Y原子,其价电子的自旋量子数代数和为
表示,这称为电子的自旋量子数。对于基态的Y原子,其价电子的自旋量子数代数和为____ 。
(2)X、Y、E三种元素的第一电离能由小到大的顺序为____ (填元素符号,下同);电负性由小到大的顺序为____ 。
(3)X、Z和氢元素按原子数目比为1:1:2形成常温下呈气态的物质,其分子中键角约为____ ,其中X原子的杂化轨道类型为____ 。
(4)F2+与NH3能形成[F(NH3)4]2+离子,[F(NH3)4]2+中的配位原子为____ (填元素符号)。若[F(NH3)4]2+离子中2个NH3被2个Cl-替代可以得到2种不同的结构,则[F(NH3)4]2+离子的空间结构名称是____ 。(填“平面四方形”或“正四面体”)。
(5)F2Z的晶胞中(结构如图所示)所包含的F离子数目为____ 。若其晶体密度为ρ g·cm-3,F离子的半径为r1 pm,Z离子的半径为r2 pm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率(即原子的体积占晶胞体积的百分率)为____ 。(用含ρ、r1、r2、NA的代数式表示,列式即可,不需化简)。

(1)基态Y原子价层电子排布式为
 ,表示,则与之相反的用-
,表示,则与之相反的用- 表示,这称为电子的自旋量子数。对于基态的Y原子,其价电子的自旋量子数代数和为
表示,这称为电子的自旋量子数。对于基态的Y原子,其价电子的自旋量子数代数和为(2)X、Y、E三种元素的第一电离能由小到大的顺序为
(3)X、Z和氢元素按原子数目比为1:1:2形成常温下呈气态的物质,其分子中键角约为
(4)F2+与NH3能形成[F(NH3)4]2+离子,[F(NH3)4]2+中的配位原子为
(5)F2Z的晶胞中(结构如图所示)所包含的F离子数目为

您最近一年使用:0次
名校
9 . 太阳能的开发利用在新能源研究中占据重要地位。单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒、钛等。请回答下列问题:
(1)镓与硒相比,电负性更大的是___________ (写元素符号)。
(2)基态 的核外电子排布式为
的核外电子排布式为___________ ;已知高温下 比CuO更稳定,试从铜原子核外电子结构角度解释其原因:
比CuO更稳定,试从铜原子核外电子结构角度解释其原因:___________ 。
(3)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的有___________ (填元素符号)。
(4)在第二周期元素中,第一电离能介于B和N两元素之间的有___________ (写元素符号)。
(5)纳米 是一种应用广泛的催化剂,纳米
是一种应用广泛的催化剂,纳米 催化的一个实例如图所示。甲中所含的化学键种类有
催化的一个实例如图所示。甲中所含的化学键种类有___________ (填字母)。
a.氢键 b.离子键 c.极性键 d.非极性键

(1)镓与硒相比,电负性更大的是
(2)基态
 的核外电子排布式为
的核外电子排布式为 比CuO更稳定,试从铜原子核外电子结构角度解释其原因:
比CuO更稳定,试从铜原子核外电子结构角度解释其原因:(3)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的有
(4)在第二周期元素中,第一电离能介于B和N两元素之间的有
(5)纳米
 是一种应用广泛的催化剂,纳米
是一种应用广泛的催化剂,纳米 催化的一个实例如图所示。甲中所含的化学键种类有
催化的一个实例如图所示。甲中所含的化学键种类有a.氢键 b.离子键 c.极性键 d.非极性键

您最近一年使用:0次
名校
解题方法
10 . 下表是元素周期表的一部分。表中所列的字母分别代表一种元素。

回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式:___________ 。
(2)D的简单气态氢化物的VSEPR模型为___________ ,分子的空间结构为___________ 。
(3)第一电离能H___________ X(填“>”“<”或“=”),其原因是___________ 。
(4)电负性E___________ M(填“>”“<”或“=”)。
(5)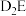 的沸点比
的沸点比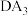 的沸点低,其原因是
的沸点低,其原因是___________ 。
(6) 的空间结构为
的空间结构为___________ ,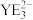 的键角比
的键角比 的键角小的原因是
的键角小的原因是___________ 。

回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式:
(2)D的简单气态氢化物的VSEPR模型为
(3)第一电离能H
(4)电负性E
(5)
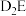 的沸点比
的沸点比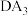 的沸点低,其原因是
的沸点低,其原因是(6)
 的空间结构为
的空间结构为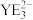 的键角比
的键角比 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
2022-03-24更新
|
240次组卷
|
2卷引用:山西省运城市2021-2022学年高二下学期3月联考化学试题



