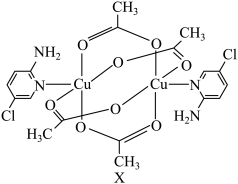
1 . 氨基吡啶与铜等金属离子所形成的配合物具备良好的磁学性质,某氨基吡啶衍生物铜配合物X的结构简式如图所示。
(1)基态氯原子的价层电子排布图为______ ;下列不同状态的氮原子中,能量最高的是______ (填字母)。
A. B.
B.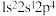 C.
C.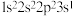 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为______ 。
(3)X中 的配位数是
的配位数是______ ;铜元素有不同价态氧化物,高温下稳定性
______ CuO(填“大于”或“小于”),从离子的电子层结构角度分析,主要原因是______ 。
(4)X中N原子的杂化方式为______ 。
(5)下列关于X的说法中不正确的是______(填字母)。

(1)基态氯原子的价层电子排布图为
A.
 B.
B.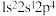 C.
C.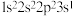 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为
(3)X中
 的配位数是
的配位数是
(4)X中N原子的杂化方式为
(5)下列关于X的说法中不正确的是______(填字母)。
A.存在大π键 |
| B.存在氢键、配位键等化学键 |
| C.碳、氧原子间形成的σ键和π键个数比为2∶1 |
| D.铜属于d区元素 |
您最近一年使用:0次
2023-07-06更新
|
80次组卷
|
2卷引用:山西省怀仁市第十一中学校2022-2023学年高二下学期7月期末化学试题
名校
解题方法
2 . 半导体晶体是半导体工业的主要基础原料,第一代半导体代表材料是锗(Ge)单晶和硅单晶(Si),他们的出现实现了超大规模集成电路,第二代砷化镓(GaAs)等化合物半导体制成的激光器成为光通信系统中的关键器件,氮化硼(BN)、碳化硅(SiC)、金刚石等属于第三代半导体材料,又被称为高温半导体材料。
(1) 的价电子排布式为
的价电子排布式为___________ 。
(2)石墨型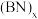 转变为金刚石型
转变为金刚石型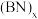 时,
时, 原子的杂化轨道类型由
原子的杂化轨道类型由___________ 变为___________ 。金刚石型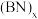 的硬度比金刚石大,推测其原因是
的硬度比金刚石大,推测其原因是___________ 。
(3)磷酸和亚磷酸 是磷元素的两种含氧酸。亚磷酸与
是磷元素的两种含氧酸。亚磷酸与 反应只生成
反应只生成 和
和 两种盐,则
两种盐,则 的结构式为
的结构式为___________ ,其为___________ 元酸
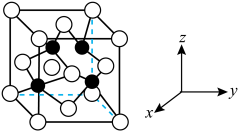
(4)下图为Ga和N形成的某种晶体的晶胞,该晶体也为高温半导体材料。其中黑色的球为Ga,白色球为N,该晶体的化学式为___________ 。若晶胞密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则两个最近的Ga之间的距离为
,则两个最近的Ga之间的距离为___________ 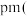 列出计算表达式
列出计算表达式 。
。
(1)
 的价电子排布式为
的价电子排布式为(2)石墨型
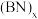 转变为金刚石型
转变为金刚石型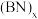 时,
时, 原子的杂化轨道类型由
原子的杂化轨道类型由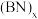 的硬度比金刚石大,推测其原因是
的硬度比金刚石大,推测其原因是(3)磷酸和亚磷酸
 是磷元素的两种含氧酸。亚磷酸与
是磷元素的两种含氧酸。亚磷酸与 反应只生成
反应只生成 和
和 两种盐,则
两种盐,则 的结构式为
的结构式为(4)下图为Ga和N形成的某种晶体的晶胞,该晶体也为高温半导体材料。其中黑色的球为Ga,白色球为N,该晶体的化学式为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则两个最近的Ga之间的距离为
,则两个最近的Ga之间的距离为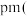 列出计算表达式
列出计算表达式 。
。
您最近一年使用:0次
2023-07-06更新
|
50次组卷
|
2卷引用:山西省应县第一中学校2022-2023学年高二下学期7月期末考试化学试题
名校
解题方法
3 . 砷化镓(GaAs)是当前最重要、技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
(1)GaAs、GaN结构相似,晶体类型都为共价晶体,沸点GaAs___________ GaN(填“>”或“<”,下同),第一电离能Ga___________ As。
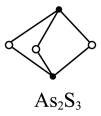
(2)成语“信口雌黄”中雌黄的分子式为As2S3,分子结构如图,As原子的杂化方式为___________ 。
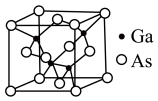
(3)GaAs的晶胞结构如图,在GaAs晶体中,与As原子最近且等距离的As原子数为______ 。
(4)若砷化镓晶胞边长为apm,则Ga与最近As的核间距为___________ cm。
(1)GaAs、GaN结构相似,晶体类型都为共价晶体,沸点GaAs
(2)成语“信口雌黄”中雌黄的分子式为As2S3,分子结构如图,As原子的杂化方式为

(3)GaAs的晶胞结构如图,在GaAs晶体中,与As原子最近且等距离的As原子数为

(4)若砷化镓晶胞边长为apm,则Ga与最近As的核间距为
您最近一年使用:0次
2023-06-23更新
|
77次组卷
|
2卷引用:山西省运城市康杰中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
4 . 过渡金属钛(Ti)性能优越,是继铁、铝之后应用广泛的“第三金属”,被誉为“未来钢铁”、“战略金属”。回答下列问题:
(1)下列Ti 原子电子排布式表示的状态中,电离最外层一个电子所需能量最大的是_______ (填标号)。
(2)TiCl4是氧化法制取钛的中间产物,TiCl4分子结构与TiCl4相同,二者常温下都是无色液体,则TiCl4分子的空间结构为_______ 。TiCl4的稳定性比CCl4差,极易水解,原因是_______ (从原子半径、键长和键能的角度分析)。
(3)六氟合钛酸钾(K2TiF6)可用作钛酸和金属钛的制造。六氟合钛酸钾中存在[TiF6]2-,该晶体中不存在的化学键是 _______ (填标号)。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下:

①有机物甲中标“*”的碳原子的杂化方式为_______ ,1mol甲分子中含有_______ mol σ键。
②有机物乙中,C、N、O三种元素的第一电离能由大到小的顺序是_______ 。
③有机物乙的沸点高于有机物甲,其主要原因是_______ 。
(5)嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛矿的晶胞结构如图所示。
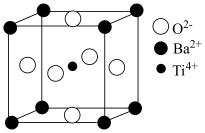
①晶体中一个Ba2+周围距离最近的O2-数目为_______ 。
②已知该晶体的密度为_______ ρg·cm-3,阿伏加德罗常数的值为NA,则该晶体中Ba2+与Ti4+之间的最短距离为 _______ pm (列出计算式)。
(1)下列Ti 原子电子排布式表示的状态中,电离最外层一个电子所需能量最大的是_______ (填标号)。
| A.[Ar]3d²4s¹4p¹ | B.[Ar]3d²4s² |
| C.[Ar]3d³4s²4p¹ | D.[Ar]3d¹4s¹4p² |
(2)TiCl4是氧化法制取钛的中间产物,TiCl4分子结构与TiCl4相同,二者常温下都是无色液体,则TiCl4分子的空间结构为
(3)六氟合钛酸钾(K2TiF6)可用作钛酸和金属钛的制造。六氟合钛酸钾中存在[TiF6]2-,该晶体中不存在的化学键是 _______ (填标号)。
| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下:

①有机物甲中标“*”的碳原子的杂化方式为
②有机物乙中,C、N、O三种元素的第一电离能由大到小的顺序是
③有机物乙的沸点高于有机物甲,其主要原因是
(5)嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛矿的晶胞结构如图所示。

①晶体中一个Ba2+周围距离最近的O2-数目为
②已知该晶体的密度为
您最近一年使用:0次
2023-05-24更新
|
148次组卷
|
2卷引用:山西省怀仁市第一中学校2023-2024学年高三上学期第三次月考理综化学试题
名校
解题方法
5 .  可用于红外光谱分析以及显像管生产等。以某矿渣(主要成分为
可用于红外光谱分析以及显像管生产等。以某矿渣(主要成分为 ,含有少量CuO、
,含有少量CuO、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如下:
的工艺流程如下:

已知:①Sb属于第ⅤA元素,主要化合价为+3、+5价;
② ,
, ;
;
③ 微溶于水,
微溶于水, 难溶于水,它们均为两性氧化物。SbOCl难溶于水;
难溶于水,它们均为两性氧化物。SbOCl难溶于水;
④次磷酸( )为一元中强酸,具有强还原性;
)为一元中强酸,具有强还原性;
⑤“电解”过程中(用惰性电极作电极),被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2。
回答下列问题:
(1)基态As原子的核外电子排布式为___________ 。
(2)“滤渣I”的主要成分是SbOCl,为了提高锑的利用率,将滤渣I用氨水浸取使其转化为 ,转化过程中发生反应的化学方程式为
,转化过程中发生反应的化学方程式为___________ 。
(3)已知“沉淀”阶段溶液中, mol⋅L-1。若当“沉淀”后溶液中
mol⋅L-1。若当“沉淀”后溶液中 mol⋅L-1时,请通过计算说明该阶段是否有
mol⋅L-1时,请通过计算说明该阶段是否有 沉淀生成?
沉淀生成?___________ (简要写出计算过程,不考虑溶液体积的变化)。
(4)“除砷”时,已知 的氧化产物为
的氧化产物为 。
。
① 的化学名称为
的化学名称为___________ 。 的结构简式为
的结构简式为___________ 。
② 中磷原子的杂化轨道类型为
中磷原子的杂化轨道类型为___________ 。“除砷”过程中发生反应的离子方程式为___________ 。
(5)工业上向“电解后溶液”中加入单质Sb的目的是___________ 。
 可用于红外光谱分析以及显像管生产等。以某矿渣(主要成分为
可用于红外光谱分析以及显像管生产等。以某矿渣(主要成分为 ,含有少量CuO、
,含有少量CuO、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如下:
的工艺流程如下:
已知:①Sb属于第ⅤA元素,主要化合价为+3、+5价;
②
 ,
, ;
;③
 微溶于水,
微溶于水, 难溶于水,它们均为两性氧化物。SbOCl难溶于水;
难溶于水,它们均为两性氧化物。SbOCl难溶于水;④次磷酸(
 )为一元中强酸,具有强还原性;
)为一元中强酸,具有强还原性;⑤“电解”过程中(用惰性电极作电极),被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2。
回答下列问题:
(1)基态As原子的核外电子排布式为
(2)“滤渣I”的主要成分是SbOCl,为了提高锑的利用率,将滤渣I用氨水浸取使其转化为
 ,转化过程中发生反应的化学方程式为
,转化过程中发生反应的化学方程式为(3)已知“沉淀”阶段溶液中,
 mol⋅L-1。若当“沉淀”后溶液中
mol⋅L-1。若当“沉淀”后溶液中 mol⋅L-1时,请通过计算说明该阶段是否有
mol⋅L-1时,请通过计算说明该阶段是否有 沉淀生成?
沉淀生成?(4)“除砷”时,已知
 的氧化产物为
的氧化产物为 。
。①
 的化学名称为
的化学名称为 的结构简式为
的结构简式为②
 中磷原子的杂化轨道类型为
中磷原子的杂化轨道类型为(5)工业上向“电解后溶液”中加入单质Sb的目的是
您最近一年使用:0次
2023-05-12更新
|
378次组卷
|
3卷引用:山西省怀仁市第一中学校2023-2024学年高三上学期开学摸底考试理综化学试题
山西省怀仁市第一中学校2023-2024学年高三上学期开学摸底考试理综化学试题辽宁省农村重点高中协作校2023届高三第三次模拟考试化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)
解题方法
6 . 铁、钴均为第四周期第Ⅷ族元素,它们的单质及其化合物均具有广泛用途。
(1)基态Co2+中未成对电子数为_____ ;Fe和Co的第三电离能:I3(Fe)______ I3(Co)(填“>”“<”或“=”)。
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
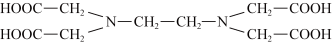
①EDTA中电负性最大的元素是______ (填元素符号),其中C原子的杂化轨道类型为______ 。
②EDTA分子中存在的化学键有_____ (填选项字母)。
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为_____ 。已知孤电子对与成键电子对的排斥作用大于成键电子对的排斥作用,则NH3分子与Co3+形成配合物后,H-N-H键角______ (填“变大”“变小”或“不变”)。
(4)一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA。
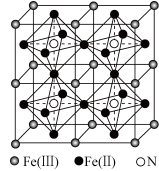
①该铁氮化合物的化学式为______ 。
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为______ cm3。
(1)基态Co2+中未成对电子数为
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
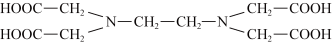
①EDTA中电负性最大的元素是
②EDTA分子中存在的化学键有
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为
(4)一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA。

①该铁氮化合物的化学式为
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为
您最近一年使用:0次
解题方法
7 . X、Y、Z、Q、T为前四周期原子序数依次增大的五种元素。X元素基态原子的L电子层的p能级上有一空轨道,Y元素基态原子的L电子层的p能级上只有1对成对电子,Z元素基态原子的M电子层的p能级有2个未成对电子,Q元素基态原子的M电子层的p轨道半充满,T元素基态原子的价层电子排布式为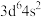 。回答下列问题:
。回答下列问题:
(1)T在周期表中的位置是第___________ 族,___________ 区。
(2)基态Z原子的简化电子排布式为___________ 。
(3)比较第一电离能:Z___________ Q(填“>”“=”或“<”,下同);电负性:X___________ Y。
(4)下列说法不正确的是___________ 。(填字母)
A.键长和键角的数值可以通过晶体的X射线衍射实验获得
B.共价键具有方向性和饱和性
C.键能是衡量化学键稳定性的参数之一
D.X、Y、Z、Q形成的简单氢化物,其中心原子的杂化轨道类型不同
E.Z的氟化物的空间结构为三角锥形
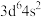 。回答下列问题:
。回答下列问题:(1)T在周期表中的位置是第
(2)基态Z原子的简化电子排布式为
(3)比较第一电离能:Z
(4)下列说法不正确的是
A.键长和键角的数值可以通过晶体的X射线衍射实验获得
B.共价键具有方向性和饱和性
C.键能是衡量化学键稳定性的参数之一
D.X、Y、Z、Q形成的简单氢化物,其中心原子的杂化轨道类型不同
E.Z的氟化物的空间结构为三角锥形
您最近一年使用:0次
8 . 碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲(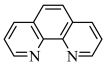 )与
)与 形成的红色配合物(如下图)测定铁的含量。
形成的红色配合物(如下图)测定铁的含量。
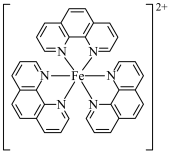
回答下列问题:
(1)基态 原子的价电子占据的能量最高的能级是
原子的价电子占据的能量最高的能级是_______ ,基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有_______ 种, 的价电子轨道表达式为
的价电子轨道表达式为_______ 。
(2)红色配离子的中心原子的配位数为_______ ;
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为_______ 、_______ ;
(4)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为_______ ;
(5)红色配离子中不存在的作用力有_______ ;
A. 键 B.
键 B. 键 C.离子键 D氢键 E.配位键
键 C.离子键 D氢键 E.配位键
(6)临床建议服用维生素 促进“亚铁”的吸收,避免生成
促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ ;
(7)汽车安全气囊产生气体的功臣是叠氮化钠 ,
, 的空间构型为
的空间构型为_______ 。
 )与
)与 形成的红色配合物(如下图)测定铁的含量。
形成的红色配合物(如下图)测定铁的含量。
回答下列问题:
(1)基态
 原子的价电子占据的能量最高的能级是
原子的价电子占据的能量最高的能级是 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有 的价电子轨道表达式为
的价电子轨道表达式为(2)红色配离子的中心原子的配位数为
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为
(4)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为
(5)红色配离子中不存在的作用力有
A.
 键 B.
键 B. 键 C.离子键 D氢键 E.配位键
键 C.离子键 D氢键 E.配位键(6)临床建议服用维生素
 促进“亚铁”的吸收,避免生成
促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(7)汽车安全气囊产生气体的功臣是叠氮化钠
 ,
, 的空间构型为
的空间构型为
您最近一年使用:0次
2023-04-01更新
|
164次组卷
|
3卷引用:山西省太原市第五中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
9 . 回答下列问题
(1)2023年3月16日,最新款内折旗舰华为MateX3发布,该款手机是使屏幕兼顾轻薄和良好的抗冲击性能、耐刮擦性能和弯折性能,同时也是将石墨烯正式应用到手机里,利用石墨烯薄片液冷散热系统成为全球最强散热手机系统,而之前国际化学顶级期刊《Science》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班仅21岁的校友曹原。石墨烯这一人们视为“引领未来”的新材料,享受其广泛应用于蓄电池、智能手机和交通工具等带来的福利,碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:


①在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为___________ 。
②在金刚石晶体中,C原子所连接的最小环中最多有___________ 个C原子在同一平面。
③石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。图甲中,1号C与相邻C形成 键的个数为
键的个数为___________ ;图乙中,1号C的杂化方式是___________ ,该C与相邻C形成的键角___________ (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。若将图乙所示的氧化石墨烯分散到 中,则氧化石墨烯可与
中,则氧化石墨烯可与 形成氢键的原子有
形成氢键的原子有___________ (填元素符号)。
④石墨烯可转化为富勒烯( ),某金属M与
),某金属M与 可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为
可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为___________ ,该材料的化学式为___________ 。

(2)南昌大学的几位本科生连续在国际化学顶级期刊《Advanced Materials》和《Journal of the American Chemical Society》发表两篇关于分子铁电的研究论文,分子铁电为跨学科研究方向,涉及到的学科包括化学、材料、物理、电子等,是目前最热门的研究课题。
① 与
与 核外未成对电子数之比为
核外未成对电子数之比为___________ 。
②奥氏体是碳溶解在 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图丁所示。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图丁所示。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________ pm(阿伏加德罗常数的值用 表示,写出简化后的计算式即可)。
表示,写出简化后的计算式即可)。

(1)2023年3月16日,最新款内折旗舰华为MateX3发布,该款手机是使屏幕兼顾轻薄和良好的抗冲击性能、耐刮擦性能和弯折性能,同时也是将石墨烯正式应用到手机里,利用石墨烯薄片液冷散热系统成为全球最强散热手机系统,而之前国际化学顶级期刊《Science》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班仅21岁的校友曹原。石墨烯这一人们视为“引领未来”的新材料,享受其广泛应用于蓄电池、智能手机和交通工具等带来的福利,碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:


①在石墨烯晶体中,碳原子所形成的六元环数、碳原子数、C-C键数之比为
②在金刚石晶体中,C原子所连接的最小环中最多有
③石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。图甲中,1号C与相邻C形成
 键的个数为
键的个数为 中,则氧化石墨烯可与
中,则氧化石墨烯可与 形成氢键的原子有
形成氢键的原子有④石墨烯可转化为富勒烯(
 ),某金属M与
),某金属M与 可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为
可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为
(2)南昌大学的几位本科生连续在国际化学顶级期刊《Advanced Materials》和《Journal of the American Chemical Society》发表两篇关于分子铁电的研究论文,分子铁电为跨学科研究方向,涉及到的学科包括化学、材料、物理、电子等,是目前最热门的研究课题。
①
 与
与 核外未成对电子数之比为
核外未成对电子数之比为②奥氏体是碳溶解在
 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图丁所示。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图丁所示。若晶体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为 表示,写出简化后的计算式即可)。
表示,写出简化后的计算式即可)。
您最近一年使用:0次
解题方法
10 . 黑火药是我国古代的四大发明之一,距今已有1000多年的历史。黑火药在发生爆炸时发生的反应为: (已配平)。回答下列问题:
(已配平)。回答下列问题:
(1)K原子激发态的电子排布式有_______ ,其中能量较高的是_______ 。(填标号)
a.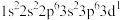 b.
b.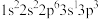
c.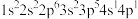 d.
d.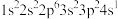
(2)在生成物中,A的电子式为_______ 。
(3)已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(4)第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含第VIA族元素的化合物在研究和生产中有许多重要用途。
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
② 的酸性比
的酸性比 的酸性
的酸性_______ (填“强”或“弱”)。气态 分子中Se的杂化方式为
分子中Se的杂化方式为_______ , 离子的VSEPR模型名称为
离子的VSEPR模型名称为_______ 。
 (已配平)。回答下列问题:
(已配平)。回答下列问题:(1)K原子激发态的电子排布式有
a.
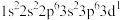 b.
b.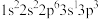
c.
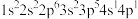 d.
d.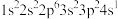
(2)在生成物中,A的电子式为
(3)已知
 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为(4)第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含第VIA族元素的化合物在研究和生产中有许多重要用途。
①O、S、Se原子的第一电离能由大到小的顺序为
②
 的酸性比
的酸性比 的酸性
的酸性 分子中Se的杂化方式为
分子中Se的杂化方式为 离子的VSEPR模型名称为
离子的VSEPR模型名称为
您最近一年使用:0次



