解题方法
1 . 我国科学家研究发现,常温常压下,铁基离子液体 在工业尾气中
在工业尾气中 、
、 等的脱除方面具有良好的性能。
等的脱除方面具有良好的性能。 结构如图所示。
结构如图所示。 中C原子的杂化轨道类型有
中C原子的杂化轨道类型有___________ 。在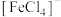 中,配体为
中,配体为___________ ,配位数为___________ 。
(2)在一定条件下 还可以转化为较稳定的
还可以转化为较稳定的
 中σ键与π键的个数比为
中σ键与π键的个数比为___________ , 的电子式为
的电子式为___________ 。
(3) 与
与 反应生成具有特征蓝色的物质X,这是实验室中检验
反应生成具有特征蓝色的物质X,这是实验室中检验 的常用方法。
的常用方法。
①科学家通过最常用的___________ 实验测定了物质X的晶体结构,其晶胞如图b所示(未表示 ),图a表示晶胞的
),图a表示晶胞的 结构(未表示K+)。
结构(未表示K+)。___________ 。
③若A处粒子的坐标参数为(0,0,0),B处粒子为(1,1,1),则C处粒子的坐标为___________ 。
④已知物质X的摩尔质量为 ,晶胞中
,晶胞中 与
与 的最小距离为dnm,阿伏加德罗常数为
的最小距离为dnm,阿伏加德罗常数为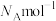 。则该晶胞中两个
。则该晶胞中两个 之间的最短距离为
之间的最短距离为___________ nm,晶体的密度为___________  。
。
 在工业尾气中
在工业尾气中 、
、 等的脱除方面具有良好的性能。
等的脱除方面具有良好的性能。 结构如图所示。
结构如图所示。
 中C原子的杂化轨道类型有
中C原子的杂化轨道类型有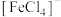 中,配体为
中,配体为(2)在一定条件下
 还可以转化为较稳定的
还可以转化为较稳定的
 中σ键与π键的个数比为
中σ键与π键的个数比为 的电子式为
的电子式为(3)
 与
与 反应生成具有特征蓝色的物质X,这是实验室中检验
反应生成具有特征蓝色的物质X,这是实验室中检验 的常用方法。
的常用方法。①科学家通过最常用的
 ),图a表示晶胞的
),图a表示晶胞的 结构(未表示K+)。
结构(未表示K+)。
③若A处粒子的坐标参数为(0,0,0),B处粒子为(1,1,1),则C处粒子的坐标为
④已知物质X的摩尔质量为
 ,晶胞中
,晶胞中 与
与 的最小距离为dnm,阿伏加德罗常数为
的最小距离为dnm,阿伏加德罗常数为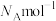 。则该晶胞中两个
。则该晶胞中两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
名校
2 . 某芳香烃A是一种重要的有机化工原料。以它为初始原料经过如下转化可以合成扁桃酸、医药中间体G等多种物质。

已知:①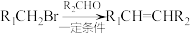
② 为间位定位基团
为间位定位基团
(1)扁桃酸分子中碳原子的杂化类型___________ 。
(2)C→D的化学方程式是___________ 。
(3) 的化学名称是
的化学名称是___________ 。
(4)写出由单体G通过加聚反应所得产物的结构简式___________ 。
(5)G有多种同分异构体,同时满足下列条件的同分异构体有___________ 种(不考虑立体异构)。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)已知 ,某兴趣小组用A为原料合成阿司匹林的前体水杨酸
,某兴趣小组用A为原料合成阿司匹林的前体水杨酸 ,请设计合成路线:
,请设计合成路线:___________ 。

已知:①
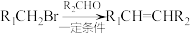
②
 为间位定位基团
为间位定位基团(1)扁桃酸分子中碳原子的杂化类型
(2)C→D的化学方程式是
(3)
 的化学名称是
的化学名称是(4)写出由单体G通过加聚反应所得产物的结构简式
(5)G有多种同分异构体,同时满足下列条件的同分异构体有
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)已知
 ,某兴趣小组用A为原料合成阿司匹林的前体水杨酸
,某兴趣小组用A为原料合成阿司匹林的前体水杨酸 ,请设计合成路线:
,请设计合成路线:
您最近一年使用:0次
名校
解题方法
3 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应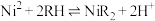 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料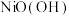 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
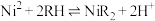 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料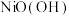 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
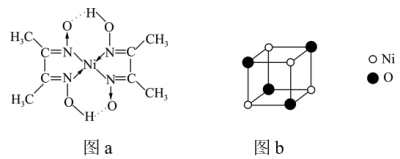
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:山西省运城市新绛县第二中学2023-2024学年高三上学期1月月考理综试题
名校
解题方法
4 . 完成下列问题。
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN中除H外其余三种元素的第一电离能由大到小的顺序为___________ 。1molPAN中含有的σ键数目为___________ 。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_________ ,中心离子的外围电子排布图___________ 。
③相同压强下,HCOOH的沸点比CH3OCH3___________ (填高或低),其原因是___________ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的中心原子轨道采用___________ 杂化,阴离子的空间构型为___________ 。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则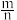 =
=___________ (填数字)。已知:该晶胞边长为bpm,NA代表阿伏伽德罗常数,则该晶体的密度为___________ g/cm3(写出计算式即可)。

(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
 (PAN)等二次污染物。
(PAN)等二次污染物。①PAN中除H外其余三种元素的第一电离能由大到小的顺序为
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为
③相同压强下,HCOOH的沸点比CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的中心原子轨道采用
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则
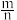 =
=
您最近一年使用:0次
2023-11-21更新
|
125次组卷
|
2卷引用:山西运城新康国际中学2023-2024学年高三上学期一轮复习检测化学试卷
名校
解题方法
5 . 我国科学家发明了高选择性的二氧化碳加氢合成甲醇( )的催化剂,其组成为
)的催化剂,其组成为 固溶体。四方体
固溶体。四方体 晶胞如图所示,回答下列问题:
晶胞如图所示,回答下列问题:
(1)图示晶胞中R代表___________ (填“O”或“ ”)原子,判断的理由为
”)原子,判断的理由为___________ 。
(2)关于 分子:
分子:
①该分子中氧原子采取的杂化类型为___________ 。
②该分子中的碳原子的价层电子对数为___________ 。
③有机物大多难溶于水,而甲醇可以与水互溶,其原因为___________ 。
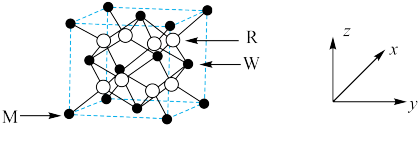
(3)原子坐标参数表示晶胞内部各原子的相对位置,在如上图所示的晶胞中:
①若M原子的坐标参数为 ,W原子的坐标参数为
,W原子的坐标参数为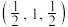 ,则R原子的坐标参数为
,则R原子的坐标参数为___________ 。
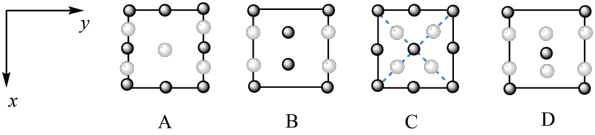
② 晶胞在z轴方向的投影图为
晶胞在z轴方向的投影图为___________ (填标号)。
(4)查阅资料可知: 的熔点为2700℃,沸点为4300℃且熔融状态下可导电。
的熔点为2700℃,沸点为4300℃且熔融状态下可导电。
① 属于
属于___________ (填“分子”、“原子”或“离子”)晶体。
②假设 的密度为
的密度为
 ,摩尔质量为M
,摩尔质量为M ,
, 表示阿伏加德罗常数的值,则晶胞中
表示阿伏加德罗常数的值,则晶胞中 原子和O原子的最短距离为
原子和O原子的最短距离为___________  (列式表示即可)。
(列式表示即可)。
 )的催化剂,其组成为
)的催化剂,其组成为 固溶体。四方体
固溶体。四方体 晶胞如图所示,回答下列问题:
晶胞如图所示,回答下列问题:
(1)图示晶胞中R代表
 ”)原子,判断的理由为
”)原子,判断的理由为(2)关于
 分子:
分子:①该分子中氧原子采取的杂化类型为
②该分子中的碳原子的价层电子对数为
③有机物大多难溶于水,而甲醇可以与水互溶,其原因为
(3)原子坐标参数表示晶胞内部各原子的相对位置,在如上图所示的晶胞中:
①若M原子的坐标参数为
 ,W原子的坐标参数为
,W原子的坐标参数为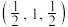 ,则R原子的坐标参数为
,则R原子的坐标参数为②
 晶胞在z轴方向的投影图为
晶胞在z轴方向的投影图为
(4)查阅资料可知:
 的熔点为2700℃,沸点为4300℃且熔融状态下可导电。
的熔点为2700℃,沸点为4300℃且熔融状态下可导电。①
 属于
属于②假设
 的密度为
的密度为
 ,摩尔质量为M
,摩尔质量为M ,
, 表示阿伏加德罗常数的值,则晶胞中
表示阿伏加德罗常数的值,则晶胞中 原子和O原子的最短距离为
原子和O原子的最短距离为 (列式表示即可)。
(列式表示即可)。
您最近一年使用:0次
名校
解题方法
6 . 碳是一种很常见的元素,它能形成多种物质。
(1)碳与铁可以形成合金。基态碳原子的价电子排布图为___________ ;基态铁原子核外共有___________ 种不同空间运动状态的电子。
(2)碳与其他元素一起能形成多种酸或酸根。
① 的空间结构是
的空间结构是___________ 。
②类卤素 分子中σ键与π键的数目比
分子中σ键与π键的数目比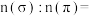
___________ , 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(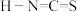 )的沸点,其原因是
)的沸点,其原因是___________ 。
(3)碳也可以形成多种有机化合物。吡咯( )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为___________ ;分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为___________ 。
(1)碳与铁可以形成合金。基态碳原子的价电子排布图为
(2)碳与其他元素一起能形成多种酸或酸根。
①
 的空间结构是
的空间结构是②类卤素
 分子中σ键与π键的数目比
分子中σ键与π键的数目比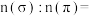
 对应的酸有两种,理论上硫氰酸(
对应的酸有两种,理论上硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸(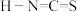 )的沸点,其原因是
)的沸点,其原因是(3)碳也可以形成多种有机化合物。吡咯(
 )结构中N原子的杂化轨道类型为
)结构中N原子的杂化轨道类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则吡咯中的大π键应表示为
),则吡咯中的大π键应表示为
您最近一年使用:0次
2023-09-03更新
|
194次组卷
|
2卷引用:山西省大同市第一中学校2023-2024学年高二下学期3月月考化学试题
解题方法
7 . 钛被称为继铁、铝之后的“第三金属”,钛及其化合物在化工、医药、材料等领域有着广泛的应用,一种制备金属钛的工艺流程如图所示:

回答下列问题:
(1)写出基态钛原子的电子排布式;___________ ,与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的有___________ 种。
(2)金属钛(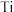 )与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用
)与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用 代替其中部分的
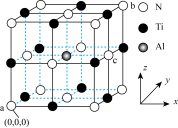
代替其中部分的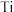 可提升耐磨性5倍以上,掺杂
可提升耐磨性5倍以上,掺杂 后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为
后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为 、b为
、b为 ,则c的原子坐标参数为
,则c的原子坐标参数为___________ 。
(3)纳米 是一种应用广泛的催化剂,其催化作用的一个实例如图所示:
是一种应用广泛的催化剂,其催化作用的一个实例如图所示:
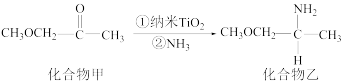
化合物甲中碳原子的杂化方式有___________ ;化合物乙的沸点明显高于化合物甲,主要原因是___________ 。
(4)已知 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ℃,沸点为136℃,结构与
℃,沸点为136℃,结构与 相似,但
相似,但 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因___________ 。

回答下列问题:
(1)写出基态钛原子的电子排布式;
(2)金属钛(
 )与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用
)与氮形成的某种化合物常被用作高温结构材料和超导材料。研究表明,用 代替其中部分的
代替其中部分的 可提升耐磨性5倍以上,掺杂
可提升耐磨性5倍以上,掺杂 后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为
后的晶胞结构如图所示。已知该晶体属立方晶系,其中原子坐标参数a为 、b为
、b为 ,则c的原子坐标参数为
,则c的原子坐标参数为
(3)纳米
 是一种应用广泛的催化剂,其催化作用的一个实例如图所示:
是一种应用广泛的催化剂,其催化作用的一个实例如图所示: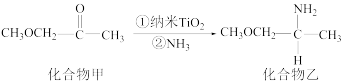
化合物甲中碳原子的杂化方式有
(4)已知
 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ℃,沸点为136℃,结构与
℃,沸点为136℃,结构与 相似,但
相似,但 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因
您最近一年使用:0次
名校
解题方法
8 . 近日,由蒋华良院士和饶子和院士领衔的联合课题组,综合利用虚拟筛选和酶学测试相结合的策略进行药物筛选,发现肉桂硫胺是抗击新型冠状病毒的潜在用药,其合成路线如下:
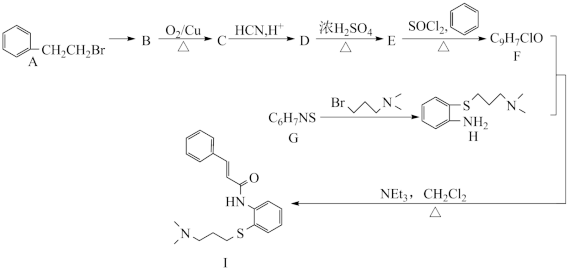

已知:I.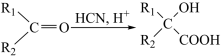
II.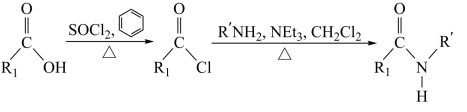
(1)A中碳原子杂化方式为___________ 。
(2)B反应生成C的化学方程式___________
(3)D生成E的反应类型___________ 。
(4)G结构简式为___________ 。
(5)写出符合下列条件的E的任一种 同分异构体的结构简式___________ 。
I.具有两个取代基的芳香族化合物
II.酸性条件下水解,水解产物遇到 溶液显紫色
溶液显紫色
III.核磁共振氢谱显示苯环上有四种化学环境的氢
(6)乙酰苯胺( ),
),参照 I 的上述合成路线 和下面的信息,设计一条由苯和乙酸为起始原料制备乙酰苯胺的合成路线:___________ 。
(已知: ,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)


已知:I.
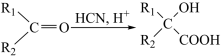
II.

(1)A中碳原子杂化方式为
(2)B反应生成C的化学方程式
(3)D生成E的反应类型
(4)G结构简式为
(5)写出符合下列条件的E的
I.具有两个取代基的芳香族化合物
II.酸性条件下水解,水解产物遇到
 溶液显紫色
溶液显紫色III.核磁共振氢谱显示苯环上有四种化学环境的氢
(6)乙酰苯胺(
 ),
),(已知:
 ,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
解题方法
9 . 第Ⅷ族元素铁、钴、镍性质相似,称为铁系元素。单质及其化合物在生命科学、工业生产等领域有着重要的应用。回答下列问题。
(1)卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心 与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。

卟吩分子中N原子采取___________ 杂化,血红素中心离子的配位数为___________ ,血红素中含有的化学键有___________ (填序号)。
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。

①已知阿伏伽德罗常数为 ,则NiO晶体的摩尔体积
,则NiO晶体的摩尔体积
___________  。(列出算式)
。(列出算式)
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为___________ ;N所替代的O的位置可能是___________ 。
(1)卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心
 与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
卟吩分子中N原子采取
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。

①已知阿伏伽德罗常数为
 ,则NiO晶体的摩尔体积
,则NiO晶体的摩尔体积
 。(列出算式)
。(列出算式)②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,
 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为
您最近一年使用:0次
2023-07-11更新
|
96次组卷
|
2卷引用:山西省运城市2022-2023学年高二下学期期末考试化学试题
名校
解题方法
10 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是___________ 。
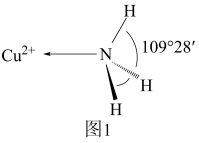
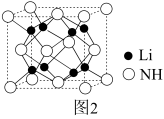
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-07-07更新
|
84次组卷
|
3卷引用:山西省怀仁市第一中学校2022-2023学年高二下学期期末考试理综化学试题



