名校
解题方法
1 . 氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是


| A.S2Cl2含有非极性键,是非极性分子 |
| B.S2Cl2为共价化合物 |
| C.S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2 |
| D.S2Cl2与H2O反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
您最近一年使用:0次
名校
解题方法
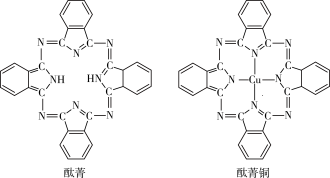
2 . 石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。 制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是_____ 。
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____ 。
②乙醇沸点比氯乙烷高,主要原因是___________________ 。
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。

④含碳源中属于非极性分子的是______________ (填序号)
a 甲烷 b 乙炔 c 苯 d 乙醇
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力_____ ,酞菁铜分子中设计到的元素,电负性由小到大依次为_____

(1)下列有关石墨烯说法正确的是
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:
②乙醇沸点比氯乙烷高,主要原因是
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:

④含碳源中属于非极性分子的是
a 甲烷 b 乙炔 c 苯 d 乙醇
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力

您最近一年使用:0次
2020-05-02更新
|
73次组卷
|
2卷引用:江西省宜春市宜丰县宜丰中学2019-2020学年高二下学期开学考试化学试题
名校
解题方法
3 . Q、R、X、Y、Z为短周期主族元素,且原子序数依次递增。Q的低价氧化物与R单质分子的电子总数相等,X与Q同族,Y和Z的离子与Ar原子的电子结构相同。
(1)Q的最高价氧化物中Q的杂化类型为___ ,分子中含有___ 个σ键,___ 个π键。
(2)X的氢化物分子的立体构型是___ ,属于__ 分子(填“极性”或“非极性”);它与R形成的化合物可作为一种重要的陶瓷材料,其化学式是___ 。
(3)Q分别与Y、Z形成的共价化合物的化学式是___ 和___ ;Q与Y形成的分子的电子式是__ ,属于___ 分子(填“极性”或“非极性”)。
(1)Q的最高价氧化物中Q的杂化类型为
(2)X的氢化物分子的立体构型是
(3)Q分别与Y、Z形成的共价化合物的化学式是
您最近一年使用:0次
2020-04-22更新
|
39次组卷
|
2卷引用:江西省都昌县第三中学2019-2020学年高二下学期4月考试化学试题
4 . 中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的,反应过程示意图如下:
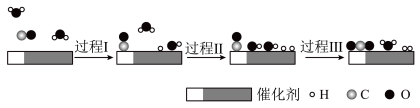
下列说法正确的是

下列说法正确的是
| A.过程Ⅰ和过程Ⅲ均为放热过程 |
| B.图示过程中的H2O均参与了反应过程 |
| C.过程Ⅲ生成了具有极性共价键的H2、CO2 |
| D.使用催化剂降低了水煤气变换反应的ΔH |
您最近一年使用:0次
2020-02-19更新
|
676次组卷
|
25卷引用:【全国区级联考】北京市朝阳区2018届高三二模理综化学试题
【全国区级联考】北京市朝阳区2018届高三二模理综化学试题(已下线)【全国区级联考】北京市朝阳区2018届高三第二次综合练习(二模)理综化学试题(已下线)《考前20天终极攻略》-5月24日 盖斯定律及反应热的有关计算(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)高考母题题源05 化学反应与能量【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题1【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题2湖南省衡阳市第八中学2020届高三模拟检测理科综合化学试题备战2020高考化学二轮专项训练:多角度考查物质变化山西省阳泉市2020届高三上学期期末考试理综化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题05-2020年北京新高考化学模拟试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编湖南省长沙市雅礼中学2021届高三第三次月考化学试题湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题山东黄岛市黄岛区致远中学2021届高三12月模拟化学试题河北省张家口市第一中学2020-2021学年高二上学期10月月考(普实班) 化学试题江西省宜春市上高二中2021-2022学年高二上学期第一次月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期第一次月考化学试题河南省温县第一高级中学2021-2022学年高二上学期10月月考化学试题河南省信阳高级中学2021-2022学年高一下学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题四川省科学城第一中学2022-2023学年高二上学期期中考试化学试题(已下线)题型97 结合能量变化图像或反应历程图像考查能量变化河南省南阳市第一中学校2022-2023学年高一下学期第四次月考化学试题
名校
解题方法
5 . Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______ (填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________ 。
② O3分子中心原子杂化类型为_______ ;O3是极性分子,理由是___________________ 。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________ 。
② 在方法Ⅱ的反应中,形成的化学键有_______ (填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。

①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________ 位置,两个Na之间的最短距离为________ nm。
②用a、d表示阿伏加 德罗常数的值NA=__________________ (列计算式)。
(1)Ca小于Ti的是
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是
② O3分子中心原子杂化类型为
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl
 Na3OCl
Na3OCl方法II 2Na + 2NaOH + 2NaCl
 2Na3OCl + H2↑
2Na3OCl + H2↑① Na2O的电子式为
② 在方法Ⅱ的反应中,形成的化学键有
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。

①Na3OCl晶胞中,Cl位于各顶点位置,Na位于
②用a、d表示阿伏加 德罗常数的值NA=
您最近一年使用:0次
2019-06-11更新
|
598次组卷
|
8卷引用:【校级联考】福建省宁德市高中同心顺联盟校2018-2019学年高二下学期期中考试化学试题
名校
6 . 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
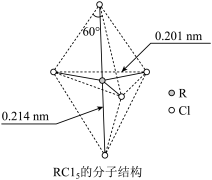

| A.每个原子都达到8电子稳定结构 |
| B.分子中5个R—Cl键键能不相同 |
| C.键角(Cl—R—Cl)有90°、120°、180°几种 |
| D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子 |
您最近一年使用:0次
2019-05-28更新
|
226次组卷
|
11卷引用:江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题
江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题江苏省溧水高级中学2018-2019高二上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期中考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期5月月考化学试题山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题福建省福州市八县一中2019-2020学年高二年下学期适应性考试化学试题山西省朔州市怀仁县怀仁一中云东校区2019-2020学年高二下学期期中考试化学试题河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题福建省厦门英才学校中学部22021-2022学年高二下学期4月月考化学试题福建省厦门市湖滨中学2022-2023学年高二下学期期中考试化学试题
名校
7 . 下列实验事实及理论解释都正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 酸性: H3BO3、 H2SiO3 相近 | B、Si电负性相近,符合“对角线规则” |
| B | 熔点: SiO2> SiCl4 | 键能:Si-O>Si-Cl |
| C | 密度:干冰>冰 | 相对分子质量:CO2>H2O |
| D | 沸点: Cl2> N2>CO | CO为极性分子:且相对分子质量:Cl2>CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-05-18更新
|
196次组卷
|
2卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题
12-13高三·甘肃天水·阶段练习
名校
8 . S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是
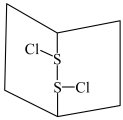

| A.S2Cl2为非极性分子 |
| B.分子中既含有极性键又含有非极性键 |
| C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2 |
| D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl |
您最近一年使用:0次
2019-03-29更新
|
1234次组卷
|
26卷引用:2013届甘肃省甘谷一中高三第五次检测化学试卷
(已下线)2013届甘肃省甘谷一中高三第五次检测化学试卷(已下线)同步君 选修3 第二章 第三节 键的极性和分子的极性高中化学人教版 选修三 第2章 分子结构与性质 键的极性和分子的极性【全国百强校】宁夏银川唐徕回民中学2017-2018学年高二下学期期中考试化学试题河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题江苏省南京市南京师I范大学附属中学 2019-2020 学年高二下学期期中考试化学试题四川省邛崃市高埂中学2019-2020学年度高二下学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题辽宁省开原市第二高级中学2021届高三第三次模拟考试化学试题江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷 福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题吉林省松原市乾安县第七中学2020-2021学年高二下学期第五次质量检测化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题广东省东莞市新世纪英才学校2021-2022学年高二上学期第一次教学质量检测化学试题四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题甘肃省兰州第一中学2021-2022学年高二下学期4月月考化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题河南省驻马店市环际大联考2021-2022学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题福建省龙岩市长汀县第一中学2021-2022学年高二下学期第一次月考化学试题山东省青岛第二中学2020-2021学年高二上学期期末化学试题 四川省广安市第二中学校2022-2023学年高二下学期第一次月考化学试题河南省洛阳市2022-2023学年高二下学期期中考试化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期7月期末化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
名校
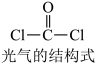
9 . 氯仿 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气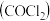 :
: ,下列说法不正确的有
,下列说法不正确的有

 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气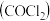 :
: ,下列说法不正确的有
,下列说法不正确的有


A. 分子为含极性键的非极性分子 分子为含极性键的非极性分子 |
B. 分子中含有3个 分子中含有3个 键、一个 键、一个 键,中心C原子采用 键,中心C原子采用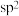 杂化 杂化 |
C. 分子中所有原子的最外层电子都满足8电子稳定结构 分子中所有原子的最外层电子都满足8电子稳定结构 |
| D.使用前可用硝酸银稀溶液检验氯仿是否变质 |
您最近一年使用:0次
2018-07-20更新
|
776次组卷
|
19卷引用:【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期末考试化学试题湖北省黄冈市浠水实验高中2019—2020学年高二上学期12月月考化学试题山西省实验中学2019-2020学年高二下学期第一次月考化学试题贵州省思南中学2019-2020学年高二下学期期中考试化学试题四川省江油市第一中学2020-2021学年高二上学期期中考试化学试题江西省景德镇一中2022-2023学年高二上学期期中考试化学试题黑龙江省大庆中学2020—2021学年高二下学期第一次月考化学试题福建省莆田第二十五中学2020-2021学年高二下学期期中考试化学试题天津市武清区杨村第一中学2021-2022学年高二下学期第一次月考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)重庆市三峡名校联盟2021-2022学年高二下学期春季联考化学试题重庆市三峡名校联盟2021-2022学年高二下学期5月联考化学试题浙江省丽水外国语学校高中部2021-2022学年高二下学期第一次阶段性考试(3月)化学试题河北省衡水市第十四中学2022-2023学年高二下学期第二次考试化学试题广西钦州市第一中学2022-2023学年高二下学期期中考试化学试题广东华侨中学2022-2023学年高二下学期4月期中化学试题广西壮族自治区钦州市第四中学2022-2023学年高二下学期3月月考化学试卷云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题
名校
10 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是
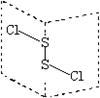

| A.S2Cl2的结构中各原子均达到8电子的稳定结构 |
| B.S2Cl2为含有极性键和非极性键的共价化合物 |
| C.若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2 |
| D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
您最近一年使用:0次
2016-12-09更新
|
260次组卷
|
6卷引用:江西省高安中学2020-2021学年高一上学期期中考试化学试题
江西省高安中学2020-2021学年高一上学期期中考试化学试题2015-2016学年中国石油天然气管道局中学高二下第二次月考化学试卷安徽省铜陵一中、阜阳一中2017-2018学年高一下学期第一次联考化学试题(已下线)考点06 原子结构 化学键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省滁州市定远县育才学校2021-2022学年高二下学期5月月考化学试题



