名校
1 . 某纯碱工业的生产流程图如下

(1)该过程是___________ 由提出的(选填“索尔维”或“侯德榜”),写出Z物质的电子式___________
(2)①将原理中涉及到的第二周期的原子的半径按由大到小的顺序排列___________
②例举一个事实证明N的非金属性大于C___________
(3)先吸氨,后碳酸化的根本原因在于___________
a. 和
和 的极性不同
的极性不同
b. 和
和 的沸点不同
的沸点不同
c. 和
和 溶于水后,溶液的酸碱性不同
溶于水后,溶液的酸碱性不同
(4)析出Z之前通 的目的是
的目的是___________
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的 和
和 等气体。铜液吸收
等气体。铜液吸收 的反应是放热反应,其反应方程式为:
的反应是放热反应,其反应方程式为:
则铜液吸收CO的条件___________ (选填编号,下同),铜液再生条件___________
a.高压 b.低压 c.高温 d.低温

(1)该过程是
(2)①将原理中涉及到的第二周期的原子的半径按由大到小的顺序排列
②例举一个事实证明N的非金属性大于C
(3)先吸氨,后碳酸化的根本原因在于
a.
 和
和 的极性不同
的极性不同b.
 和
和 的沸点不同
的沸点不同c.
 和
和 溶于水后,溶液的酸碱性不同
溶于水后,溶液的酸碱性不同(4)析出Z之前通
 的目的是
的目的是(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的
 和
和 等气体。铜液吸收
等气体。铜液吸收 的反应是放热反应,其反应方程式为:
的反应是放热反应,其反应方程式为:
则铜液吸收CO的条件
a.高压 b.低压 c.高温 d.低温
您最近一年使用:0次
2021-10-08更新
|
232次组卷
|
2卷引用:上海市上海交通大学附属中学2021届高三期中考试化学试题
名校
解题方法
2 . 下列叙述正确的是
| A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 |
| B.CC14是非极性分子,分子中C原子处在4个C1原子所组成的正方形的中心 |
| C.H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央 |
| D.CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央 |
您最近一年使用:0次
2021-03-25更新
|
392次组卷
|
8卷引用:江苏省南京市2019-2020学年高二下学期期末考试化学试卷A卷
名校
解题方法
3 . 下列说法中正确的是( )
| A.CH4、BCl3、SO2都是含有极性键的非极性分子 |
B.甲烷分子失去一个H+,形成 ,其碳原子的杂化类型发生了改变 ,其碳原子的杂化类型发生了改变 |
C.SO2和O3、 和 和 互为等电子体 互为等电子体 |
| D.元素的基态原子核外电子排布都遵循构造原理 |
您最近一年使用:0次
4 . 镍(Ni)、钴(Co) 、钛(Ti)是重要的金属,在材料科学等领域应用广泛。
(1)Ni在元素周期表中的位置是_______ , 其价电子层中有______ 个未成对电子。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于______ ( 填“极性”“非极性”)分子,其立体构型为_______ 。
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有_ (填字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

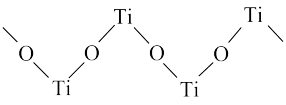
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为____ 。阴离子 中硫原子的杂化方式为
中硫原子的杂化方式为________ ,写出一种与 互为等电子体的分子:
互为等电子体的分子:_______ 。
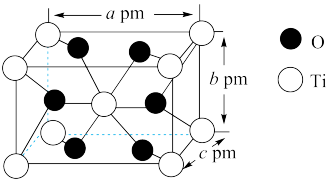
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=______ (用NA表示阿伏加 德罗常数的数值,用含M、a、b、c、NA的代数式表示)g·cm-3。
(1)Ni在元素周期表中的位置是
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为
 中硫原子的杂化方式为
中硫原子的杂化方式为 互为等电子体的分子:
互为等电子体的分子:
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=

您最近一年使用:0次
名校
解题方法
5 . 下列推论正确的是
| A.F2和I2都是非极性分子,I2难溶于水,故F2也难溶于水 |
| B.BF3和NF3都只含极性键,NF3是极性分子,故BF3也是极性分子 |
| C.Li和Na位于同一主族,Na 燃烧生成Na2O2,故Li燃烧也生成Li2O2 |
| D.B3N3H6(硼氮苯)与苯互为等电子体,苯是平面型分子,故硼氮苯也是平面型分子 |
您最近一年使用:0次
2020-09-04更新
|
129次组卷
|
2卷引用:重庆市第八中学2018-2019学年高二下学期期中考试化学试题
6 . 关于化合物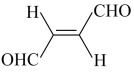 ,下列叙述错误的是
,下列叙述错误的是
 ,下列叙述错误的是
,下列叙述错误的是| A.分子间不能形成氢键 | B.分子中既有极性键又有非极性键 |
| C.分子中有7个σ键和1个π键 | D.该分子在水中的溶解度大于2丁烯 |
您最近一年使用:0次
2020-09-02更新
|
92次组卷
|
2卷引用:湖南省常德市第二中学2021届高三上学期开学考试化学试题
解题方法
7 . 下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式______ 。
(2)D的简单气态氢化物的VSEPR模型的名称为______ 。
(3)由A、C、D形成的ACD分子中,σ键和π键个数=______ 。
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是______ (填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______ 。
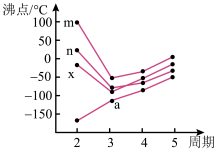
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是______ (填m、n、x或y)。
| A | R | |||||||||||||||||
| B | C | D | E | F | T | |||||||||||||
| G | H | I | J | K | L | |||||||||||||
| M | N | O | ||||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式
(2)D的简单气态氢化物的VSEPR模型的名称为
(3)由A、C、D形成的ACD分子中,σ键和π键个数=
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是

您最近一年使用:0次
名校
解题方法
8 . 科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________________ 。
(2)下列关于CH4和CO2的说法正确的是_______________ (填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”
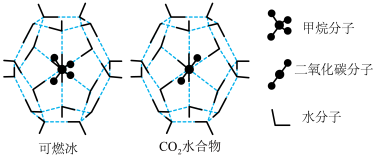
①“可燃冰”中分子间存在的2种作用力是_______________________________________ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____________________________________________________________________ 。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为
(2)下列关于CH4和CO2的说法正确的是
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”

| 分子 | 分子直径 | 分子与H2O 的结合能E(kJ/mol) |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
2020-07-06更新
|
56次组卷
|
2卷引用:安徽省六安市舒城中学2019-2020学年高二下学期第一次月考化学试题
9 . 铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为__________ 。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有______ (填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
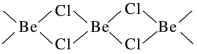
①a属于________ (填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________ (标出配位键)。
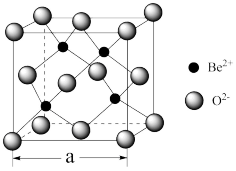
(4)BeO立方晶胞如下图所示,若BeO晶体的密度为d g·cm-3,则晶胞参数a=______ nm。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。

①a属于
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为
(4)BeO立方晶胞如下图所示,若BeO晶体的密度为d g·cm-3,则晶胞参数a=

您最近一年使用:0次
2020-07-02更新
|
208次组卷
|
3卷引用:安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题
名校
10 . 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
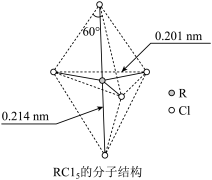

| A.每个原子都达到8电子稳定结构 |
| B.分子中5个R—Cl键键能不相同 |
| C.键角(Cl—R—Cl)有90°、120°、180°几种 |
| D.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子 |
您最近一年使用:0次
2019-05-28更新
|
226次组卷
|
11卷引用:安徽省亳州市第二中学2018-2019学年高二下学期5月月考化学试题
安徽省亳州市第二中学2018-2019学年高二下学期5月月考化学试题安徽省滁州市明光中学2019-2020学年高二下学期开学考试化学试题江苏省溧水高级中学2018-2019高二上学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期中考试化学试题山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题福建省福州市八县一中2019-2020学年高二年下学期适应性考试化学试题山西省朔州市怀仁县怀仁一中云东校区2019-2020学年高二下学期期中考试化学试题河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题福建省厦门英才学校中学部22021-2022学年高二下学期4月月考化学试题福建省厦门市湖滨中学2022-2023学年高二下学期期中考试化学试题



