解题方法
1 . 二氧化锰是实验室常见的氧化剂,在化学领域应用广泛。回答下列问题:
(1)将C和 的混合物在空气中灼烧可发生以下反应:
的混合物在空气中灼烧可发生以下反应:
Ⅰ.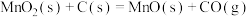
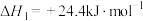
Ⅱ.

Ⅲ.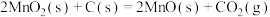

①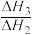 的数值范围是
的数值范围是______ (填标号)。
a.<-l b.-1~0 c.0~1 d.>1
②反应Ⅲ可看成由反应Ⅰ和反应Ⅱ两步进行,画出由原料经两步生皮产物的反应过程能量变化示意图______ 。 可催化分解
可催化分解 :
:
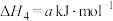 ,其应机理如图:
,其应机理如图: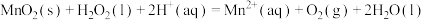
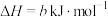 ,写出反应Ⅱ的热化学方程式
,写出反应Ⅱ的热化学方程式______ (焓变数值用a和b表示)。
(3)一种水性电解液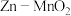 电池如图所示,电池放电时可以制备
电池如图所示,电池放电时可以制备 。已知:KOH溶液中,
。已知:KOH溶液中, 以
以 形式存在。
形式存在。______ (填“阴”或“阳”)离子交换膜。
②电池总反应为______ 。
③放电时,6.5g Zn参加反应,Ⅰ室溶液质量理论上减少______ g。
(1)将C和
 的混合物在空气中灼烧可发生以下反应:
的混合物在空气中灼烧可发生以下反应:Ⅰ.
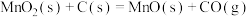
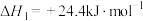
Ⅱ.


Ⅲ.
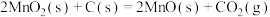

①
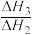 的数值范围是
的数值范围是a.<-l b.-1~0 c.0~1 d.>1
②反应Ⅲ可看成由反应Ⅰ和反应Ⅱ两步进行,画出由原料经两步生皮产物的反应过程能量变化示意图

 可催化分解
可催化分解 :
:
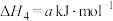 ,其应机理如图:
,其应机理如图: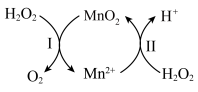
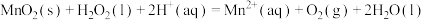
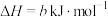 ,写出反应Ⅱ的热化学方程式
,写出反应Ⅱ的热化学方程式(3)一种水性电解液
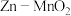 电池如图所示,电池放电时可以制备
电池如图所示,电池放电时可以制备 。已知:KOH溶液中,
。已知:KOH溶液中, 以
以 形式存在。
形式存在。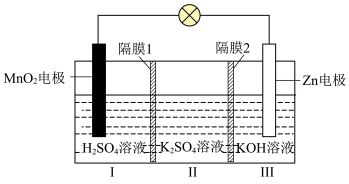
②电池总反应为
③放电时,6.5g Zn参加反应,Ⅰ室溶液质量理论上减少
您最近一年使用:0次
2024-05-28更新
|
176次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
2 . T℃时,2L恒容密闭容器中A、B发生反应: ,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
 ,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是
,A、B物质的最浓度随时间变化如图所示,12s时生成C的物质的量为1.2mol。下列说法中错误的是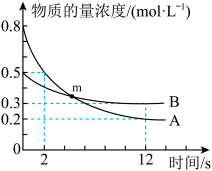
A. , , | B.0~12s,C的平均反应速率为0.05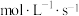 |
C.m点, | D.2s末时,D的物质的量浓度为0.2 |
您最近一年使用:0次
2024-05-28更新
|
412次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
3 . 下列反应中产物总能量大于反应物总能量的是
| A.铝片和稀盐酸反应 | B.甲烷在氧气中的燃烧 |
| C.硫酸与KOH溶液反应 | D.碳酸氢钠与柠檬酸反应 |
您最近一年使用:0次
2024-05-28更新
|
160次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解题方法
4 . 在标准状态下,由最稳定的单质合成1mol某物质的焓变叫做该物质的标准摩尔生成焓,用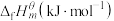 表示,最稳定单质的标准摩尔生成焓为0,有关物质的
表示,最稳定单质的标准摩尔生成焓为0,有关物质的 如图所示。下列说法正确的是
如图所示。下列说法正确的是
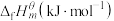 表示,最稳定单质的标准摩尔生成焓为0,有关物质的
表示,最稳定单质的标准摩尔生成焓为0,有关物质的 如图所示。下列说法正确的是
如图所示。下列说法正确的是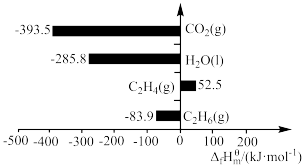
A.标准状态下, 比 比 稳定 稳定 |
B. 的 的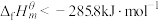 |
C.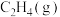 的摩尔燃烧焓为-1411.1 的摩尔燃烧焓为-1411.1 |
D.1mol 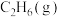 的键能大于2mol 的键能大于2mol  与3mol 与3mol  的键能之和 的键能之和 |
您最近一年使用:0次
2024-05-28更新
|
184次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
解题方法
5 . 天青石主要成分为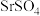 ,含有
,含有 、
、 、FeO等杂质,以天青石为原料生产
、FeO等杂质,以天青石为原料生产 的流程如下:
的流程如下: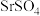 转变为
转变为 。
。
(1)“转化”工序中,为提高速率可采取的措施有______ (任写一条即可)。
(2)“滤液2”的主要成分有NaOH、 和
和______ (写化学式,下同),试剂A为______ 。
(3)“氧化”工序发生反应的离子方程式为______ 。
(4)“调pH”所得溶液含有较多NaCl,为得到更纯净的 溶液.应采取的操作为:蒸发浓缩至有固体析出,
溶液.应采取的操作为:蒸发浓缩至有固体析出,______ 。 的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的
的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的 溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中
溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中______ (填标号), 的纯度是
的纯度是______ (用含m、n的代数式表示)。
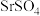 ,含有
,含有 、
、 、FeO等杂质,以天青石为原料生产
、FeO等杂质,以天青石为原料生产 的流程如下:
的流程如下: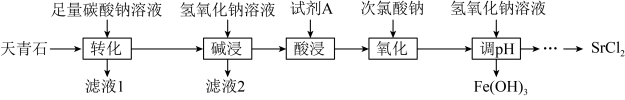
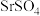 转变为
转变为 。
。(1)“转化”工序中,为提高速率可采取的措施有
(2)“滤液2”的主要成分有NaOH、
 和
和(3)“氧化”工序发生反应的离子方程式为
(4)“调pH”所得溶液含有较多NaCl,为得到更纯净的
 溶液.应采取的操作为:蒸发浓缩至有固体析出,
溶液.应采取的操作为:蒸发浓缩至有固体析出,
 的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的
的纯度,实验步骤如下:①称取产品m g,溶于水,②加足量硝酸酸化的 溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中
溶液,充分反应(杂质不参加反应);③……;④称得固体为n g。步骤③用到下列仪器中 的纯度是
的纯度是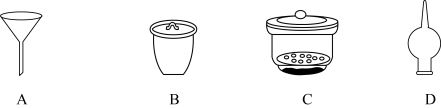
您最近一年使用:0次
2024-05-28更新
|
146次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
6 . 下列化学用语正确的是
A. 的电子式: 的电子式: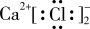 |
B.用原子表示离子键的形成过程: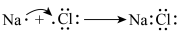 |
C.次氯酸分子的结构式: |
D.熔融 电离: 电离: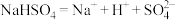 |
您最近一年使用:0次
2024-05-28更新
|
211次组卷
|
2卷引用:山东省潍坊市2023-2024学年高一下学期期中考试化学试题
名校
解题方法
7 . 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 精制含Ca2+、Mg2+、 的食盐水 的食盐水 | 胶头滴管、烧杯、试管、分液漏斗 | 粗盐水、稀盐酸、氯化钡溶液、氢氧化钠溶液、碳酸钠溶液 |
| B | 比较Mg、Al金属性的强弱 | 试管、胶头滴管 | MgCl2、AlCl3溶液、浓NaOH溶液 |
| C | 探究浓度对化学反应速率的影响 | 试管、量筒、胶头滴管 | 氢氧化钠溶液、0.5mol/L盐酸、2mol/L的盐酸 |
| D | 利用反萃取原理从碘的四氯化碳溶液中获取碘单质 | 烧杯、玻璃棒、分液漏斗 | 稀硫酸、氢氧化钠溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . A、B、C、D、E、F、G是元素周期表前四周期中常见的七种元素,其原子序数依次增大,其相关信息如下表:
(1)①下列物质的分子与 分子的空间结构最相似的是
分子的空间结构最相似的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
②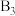 分子是否为极性分子?
分子是否为极性分子?___________ (填“是”或“否”)。
(2)根据等电子体原理,则1mol AB中含有共用电子对的数目为___________ ;
(3)工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式___________ ;若往含有 的溶液中加过量氢氧化钠溶液,可生成
的溶液中加过量氢氧化钠溶液,可生成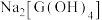 溶液,
溶液,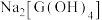 具有的化学键类型有
具有的化学键类型有___________ 。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(4)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
F元素的单质中存在化学键为___________ ;请写出基态 的价电子轨道排布图
的价电子轨道排布图___________ ,比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,请解释原因
再失去1个电子难,请解释原因___________ 。
| 元素 | 相关信息 |
| A | A的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| B | B的某一种单质是大气污染物监测物之一 |
| C | C在组成化合物时没有正价 |
| D | D常温常压下,D单质是淡黄色固体,常在火山口附近沉积 |
| E | E和D同周期,E的电负性大于D |
| F | F的基态原子核外有6个原子轨道处于半充满状态 |
| G | G能形成红色的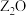 和黑色的ZO两种氧化物。 和黑色的ZO两种氧化物。 |
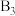 分子的空间结构最相似的是
分子的空间结构最相似的是A.
 B.
B. C.
C. D.
D.
②
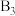 分子是否为极性分子?
分子是否为极性分子?(2)根据等电子体原理,则1mol AB中含有共用电子对的数目为
(3)工业上常通过在空气中煅烧G的低价含硫矿获得G单质,请写出该反应的方程式
 的溶液中加过量氢氧化钠溶液,可生成
的溶液中加过量氢氧化钠溶液,可生成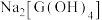 溶液,
溶液,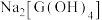 具有的化学键类型有
具有的化学键类型有A.离子键 B.极性共价键 C.非极性共价键 D.配位键
(4)表中F元素与Mn、Fe在工业上统称“黑色金属”,Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 4048 | 2957 | |
 的价电子轨道排布图
的价电子轨道排布图 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,请解释原因
再失去1个电子难,请解释原因
您最近一年使用:0次
解题方法
9 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)C元素和F元素的电负性比较,较小的是___________ 。
(2)B元素与宇宙中含量最丰富的元素形成的含有18 的分子的电子式为
的分子的电子式为___________ 。
(3)实验室用一种黄色溶液检验 时产生蓝色沉淀,该反应的离子方程式为
时产生蓝色沉淀,该反应的离子方程式为___________ ;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式:___________ 。
(4)氮、磷、砷等元素的单质及其化合物在生产生活中应用广泛。回答下列问题:
①处于下列状态的磷原子或离子失去最外层一个电子所需能量最高的是___________ (填标号)。
a. b.
b.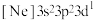 c.
c.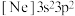 d.
d.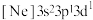
②M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。 键,则该环N原子价层孤对电子填充在
键,则该环N原子价层孤对电子填充在___________ 轨道;M中存在的微粒间作用力有___________ (填标号)。
a.共价键 b.离子键 c.氢键 d.配位键
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 同周期元素原子的简单离子中半径最小 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)C元素和F元素的电负性比较,较小的是
(2)B元素与宇宙中含量最丰富的元素形成的含有18
 的分子的电子式为
的分子的电子式为(3)实验室用一种黄色溶液检验
 时产生蓝色沉淀,该反应的离子方程式为
时产生蓝色沉淀,该反应的离子方程式为(4)氮、磷、砷等元素的单质及其化合物在生产生活中应用广泛。回答下列问题:
①处于下列状态的磷原子或离子失去最外层一个电子所需能量最高的是
a.
 b.
b.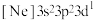 c.
c.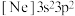 d.
d.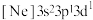
②M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。

 键,则该环N原子价层孤对电子填充在
键,则该环N原子价层孤对电子填充在a.共价键 b.离子键 c.氢键 d.配位键
您最近一年使用:0次
解题方法
10 . 硫代硫酸钠( )可作定影剂,反应的化学方程式为
)可作定影剂,反应的化学方程式为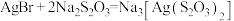
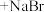 ,产物中的
,产物中的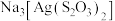 常用于切花保鲜。下列说法错误的是
常用于切花保鲜。下列说法错误的是
 )可作定影剂,反应的化学方程式为
)可作定影剂,反应的化学方程式为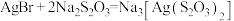
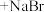 ,产物中的
,产物中的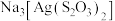 常用于切花保鲜。下列说法错误的是
常用于切花保鲜。下列说法错误的是| A.酸性强弱:三氟乙酸>三氯乙酸>乙酸 |
B. 的空间结构为四面体形,中心原子S的杂化方式为 的空间结构为四面体形,中心原子S的杂化方式为 |
C.欲测定切花保鲜液中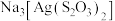 的浓度,可用NaCl标准溶液滴定 的浓度,可用NaCl标准溶液滴定 |
D.基态 的核外电子存在10种空间运动状态 的核外电子存在10种空间运动状态 |
您最近一年使用:0次



