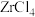1 .  在工业上常作催化剂和刻蚀剂。实验室中,先合成
在工业上常作催化剂和刻蚀剂。实验室中,先合成 ,再与
,再与 反应制备无水
反应制备无水 ,装置如图所示(加热及夹持仪器略)。
,装置如图所示(加热及夹持仪器略)。 的原理为
的原理为 ;
;
② 的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体;
的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体; 沸点为105℃。忽略共沸。
沸点为105℃。忽略共沸。
回答下列问题:
(1)仪器甲的名称为______ ,仪器乙中所装的最佳试剂为______ (填序号)。
a.98% b.70%
b.70% c.36.5%盐酸 d.70%
c.36.5%盐酸 d.70%
(2)打开 ,将三通阀调至
,将三通阀调至 ,接下来进行的操作是
,接下来进行的操作是______ ,一段时间后,加热装置C至60℃。仪器丙的作用为______ 。
(3)当C中出现较多液体后,关闭 、
、 。制得
。制得 的操作为:①调节三通阀的位置为
的操作为:①调节三通阀的位置为______ (填序号);②……;③加热E处硬质玻璃管。②的操作为______ 。 在溶液中的颜色变化,进行以下实验。
在溶液中的颜色变化,进行以下实验。
已知:水溶液中, 几乎无色,
几乎无色, 为黄色;
为黄色; 水解生成
水解生成 (棕黄色)。
(棕黄色)。
①从影响平衡移动因素的角度分析,加热前后,实验I中溶液颜色无明显变化的原因为______ 。
②设计实验证明实验Ⅲ中溶液呈黄色的原因是 :
:______ 。
 在工业上常作催化剂和刻蚀剂。实验室中,先合成
在工业上常作催化剂和刻蚀剂。实验室中,先合成 ,再与
,再与 反应制备无水
反应制备无水 ,装置如图所示(加热及夹持仪器略)。
,装置如图所示(加热及夹持仪器略)。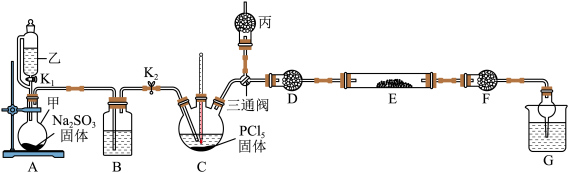
 的原理为
的原理为 ;
;②
 的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体;
的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体; 沸点为105℃。忽略共沸。
沸点为105℃。忽略共沸。回答下列问题:
(1)仪器甲的名称为
a.98%
 b.70%
b.70% c.36.5%盐酸 d.70%
c.36.5%盐酸 d.70%
(2)打开
 ,将三通阀调至
,将三通阀调至 ,接下来进行的操作是
,接下来进行的操作是(3)当C中出现较多液体后,关闭
 、
、 。制得
。制得 的操作为:①调节三通阀的位置为
的操作为:①调节三通阀的位置为
 在溶液中的颜色变化,进行以下实验。
在溶液中的颜色变化,进行以下实验。试剂 | 加热前溶液颜色 | 加热后溶液颜色 | |
实验Ⅰ |
| 棕黄色 | 深棕色 |
实验Ⅱ |
| 几乎无色 | 几乎无色 |
实验Ⅲ |
| 黄色 | 深黄色 |
 几乎无色,
几乎无色, 为黄色;
为黄色; 水解生成
水解生成 (棕黄色)。
(棕黄色)。①从影响平衡移动因素的角度分析,加热前后,实验I中溶液颜色无明显变化的原因为
②设计实验证明实验Ⅲ中溶液呈黄色的原因是
 :
:
您最近一年使用:0次
2024-05-21更新
|
426次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
2 . 锆是一种稀有金属,广泛用在航空航天、军工、核反应、原子能领域。一种以锆英砂(主要含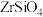 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: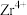 、
、 、
、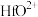 、
、 ;
;
②25℃时, ,
,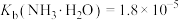 ;
;
③部分氯化物的沸点数据如表所示:
回答下列问题:
(1)“碱熔”时有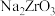 生成,则
生成,则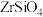 发生反应的化学方程式为
发生反应的化学方程式为______ ,温度和时间对锆英砂碱熔分解率的影响如图所示,应采取的条件为______ 。______ ,流程中可循环利用的物质除TOPO外,还有______ (填化学式)。
(3)“氨沉”时产物为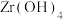 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中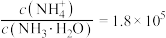 ,则
,则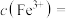
______  ,“滤液2”中主要成分是
,“滤液2”中主要成分是______ (填化学式)。
(4)“煅烧”时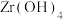 分解生成
分解生成 ,“沸腾氯化”时
,“沸腾氯化”时 发生反应的化学方程式为
发生反应的化学方程式为______ ,氯化反应结束通入 ,目的是
,目的是______ 。
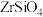 ,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下:
,还含有少量Cr、Fe、Hf等元素)为原料生产金属锆和副产物硅酸钙的工艺流程如下: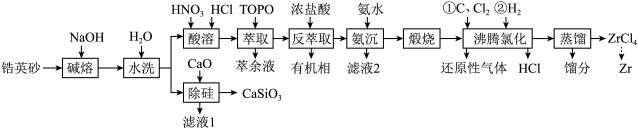
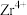 、
、 、
、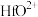 、
、 ;
;②25℃时,
 ,
,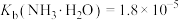 ;
;③部分氯化物的沸点数据如表所示:
物质 |
|
|
|
|
沸点/℃ | 331 | 1300 | 316 | 700 |
(1)“碱熔”时有
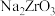 生成,则
生成,则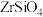 发生反应的化学方程式为
发生反应的化学方程式为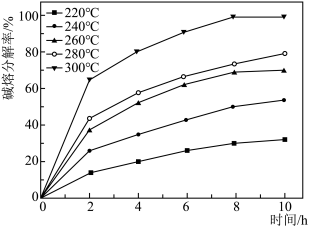
(3)“氨沉”时产物为
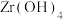 、
、 和
和 ,反应结束后溶液中
,反应结束后溶液中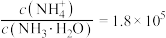 ,则
,则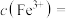
 ,“滤液2”中主要成分是
,“滤液2”中主要成分是(4)“煅烧”时
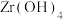 分解生成
分解生成 ,“沸腾氯化”时
,“沸腾氯化”时 发生反应的化学方程式为
发生反应的化学方程式为 ,目的是
,目的是
您最近一年使用:0次
2024-05-21更新
|
432次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
3 .  的水解反应可用于军事工业中烟雾剂的制造,其部分反应机理如图。下列说法错误的是
的水解反应可用于军事工业中烟雾剂的制造,其部分反应机理如图。下列说法错误的是
 的水解反应可用于军事工业中烟雾剂的制造,其部分反应机理如图。下列说法错误的是
的水解反应可用于军事工业中烟雾剂的制造,其部分反应机理如图。下列说法错误的是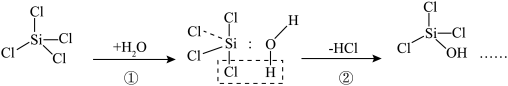
A. 为非极性分子 为非极性分子 |
| B.电负性:O>Cl>H>Si |
C.沸点: 大于 大于 |
D.过程①中Si的 杂化轨道接纳O的孤电子对形成配位键 杂化轨道接纳O的孤电子对形成配位键 |
您最近一年使用:0次
2024-05-21更新
|
340次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
4 . 某化学小组探究 浓硝酸原电池中硝酸浓度对“电极反转”的影响,将规格完全相同的Cu片和Fe片插入9.4
浓硝酸原电池中硝酸浓度对“电极反转”的影响,将规格完全相同的Cu片和Fe片插入9.4 、13.3
、13.3 、13.4
、13.4 、13.7
、13.7 、15.0
、15.0 的硝酸溶液中,组成原电池测试电流变化如图所示。已知:
的硝酸溶液中,组成原电池测试电流变化如图所示。已知: 氧化层比
氧化层比 更致密。
更致密。
 浓硝酸原电池中硝酸浓度对“电极反转”的影响,将规格完全相同的Cu片和Fe片插入9.4
浓硝酸原电池中硝酸浓度对“电极反转”的影响,将规格完全相同的Cu片和Fe片插入9.4 、13.3
、13.3 、13.4
、13.4 、13.7
、13.7 、15.0
、15.0 的硝酸溶液中,组成原电池测试电流变化如图所示。已知:
的硝酸溶液中,组成原电池测试电流变化如图所示。已知: 氧化层比
氧化层比 更致密。
更致密。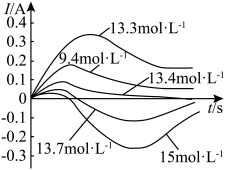
| A.初始阶段,铁做负极 |
B.15 的硝酸溶液中,一段时间后,发生“电极反转” 的硝酸溶液中,一段时间后,发生“电极反转” |
C.硝酸浓度小于13.3 时,硝酸浓度越小,电流强度越大 时,硝酸浓度越小,电流强度越大 |
D.将Fe换为Al后,测得“ 硝酸”原电池电极反转的硝酸溶液浓度的临界值为9.1 硝酸”原电池电极反转的硝酸溶液浓度的临界值为9.1 ,工业上用铝罐储存硝酸更合适 ,工业上用铝罐储存硝酸更合适 |
您最近一年使用:0次
2024-05-21更新
|
310次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
5 . 深入研究碳、氮元素的物质转化有着重要的实际意义,汽车尾气净化装置中CO和NO发生如下反应:
ⅰ.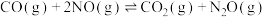
 ,
,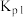
ⅱ.
 ,
,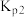
ⅲ.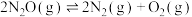
 ,
,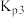
回答下列问题:
(1)上述反应的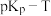 的线性关系如图所示。
的线性关系如图所示。
______ (填“>”或“<”)0,反应 的
的
______ (用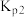 、
、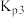 表示)。
表示)。 ,初始总压强为
,初始总压强为 。反应
。反应 的
的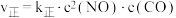 ,
,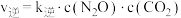 ,
,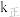 、
、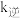 分别为正、逆反应速率常数。充分反应达平衡时压强为
分别为正、逆反应速率常数。充分反应达平衡时压强为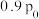 (该温度下忽略反应ⅲ),
(该温度下忽略反应ⅲ), 的物质的量为1.25mol,则
的物质的量为1.25mol,则
______ 。
(3)CO和NO发生上述反应,在不同条件下达到平衡时,在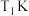 时NO的转化率与
时NO的转化率与 的变化曲线及
的变化曲线及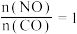 时NO的转化率与T的变化曲线如图所示。将2mol
时NO的转化率与T的变化曲线如图所示。将2mol  和2mol
和2mol  充入1L恒容密闭容器,初始总压强为100kPa,发生上述反应。
充入1L恒容密闭容器,初始总压强为100kPa,发生上述反应。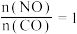 时NO的转化率与T的变化曲线为
时NO的转化率与T的变化曲线为______ 曲线(填“Ⅰ”或“Ⅱ”),A点后NO的平衡转化率增大的原因是______ 。
②已知:反应iii的平衡常数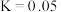 。
。 条件下反应达平衡时,
条件下反应达平衡时,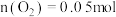 ,则平衡时
,则平衡时 的物质的量
的物质的量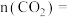
______ mol,反应ii的压强平衡常数
______ (保留两位有效数字)。
ⅰ.
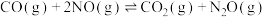
 ,
,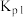
ⅱ.

 ,
,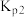
ⅲ.
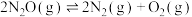
 ,
,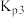
回答下列问题:
(1)上述反应的
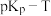 的线性关系如图所示。
的线性关系如图所示。
 的
的
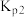 、
、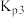 表示)。
表示)。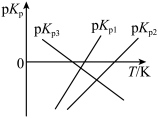
 ,初始总压强为
,初始总压强为 。反应
。反应 的
的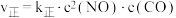 ,
,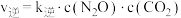 ,
,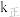 、
、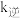 分别为正、逆反应速率常数。充分反应达平衡时压强为
分别为正、逆反应速率常数。充分反应达平衡时压强为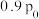 (该温度下忽略反应ⅲ),
(该温度下忽略反应ⅲ), 的物质的量为1.25mol,则
的物质的量为1.25mol,则
(3)CO和NO发生上述反应,在不同条件下达到平衡时,在
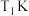 时NO的转化率与
时NO的转化率与 的变化曲线及
的变化曲线及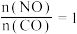 时NO的转化率与T的变化曲线如图所示。将2mol
时NO的转化率与T的变化曲线如图所示。将2mol  和2mol
和2mol  充入1L恒容密闭容器,初始总压强为100kPa,发生上述反应。
充入1L恒容密闭容器,初始总压强为100kPa,发生上述反应。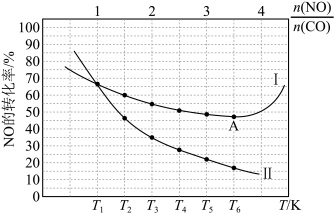
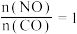 时NO的转化率与T的变化曲线为
时NO的转化率与T的变化曲线为②已知:反应iii的平衡常数
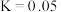 。
。 条件下反应达平衡时,
条件下反应达平衡时,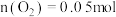 ,则平衡时
,则平衡时 的物质的量
的物质的量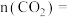

您最近一年使用:0次
2024-05-21更新
|
403次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
6 . 下列分子的空间结构相同的是
A.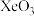 和 和 | B. 和 和 | C. 和 和 | D. 和 和 |
您最近一年使用:0次
2024-05-21更新
|
296次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
7 . 化合物丙为合成药物的中间体,其转化关系如下:
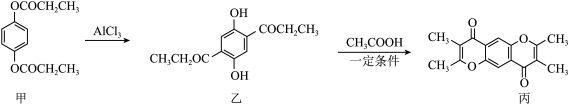
| A.甲和乙都能发生水解反应 |
B.可用 溶液鉴别乙和丙 溶液鉴别乙和丙 |
| C.乙中含碳侧链上的二氯代物有5种 |
D. 换成 换成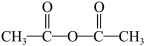 也可得到丙 也可得到丙 |
您最近一年使用:0次
2024-05-21更新
|
322次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
8 . 已知环己胺(液体)微溶于水。实验室分离溴、溴苯、环己胺混合溶液的流程如图。下列说法正确的是
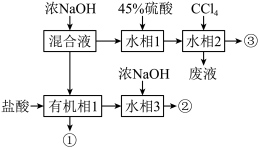
| A.上述过程未发生氧化还原反应 | B.②③均为两相混合体系 |
| C.溴、溴苯、环己胺依次由③②①得到 | D.由②③获得相应产品采取的操作方法不同 |
您最近一年使用:0次
2024-05-21更新
|
362次组卷
|
3卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
9 . 化学与科技密切相关。下列说法正确的是
| A.超分子粘合剂具有很高的粘合强度,超分子以共价键连接其他分子 |
| B.催化电解工业废水中的硝酸盐制取氨气,实现了氮的固定 |
C.弹道二维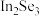 晶体管有优异的光学性能,其成分是一种合金材料 晶体管有优异的光学性能,其成分是一种合金材料 |
| D.全氟磺酸质子膜广泛用于水电解制氢,磺酸基具有很好的亲水性 |
您最近一年使用:0次
2024-05-21更新
|
428次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
名校
解题方法
10 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 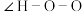 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: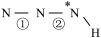 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
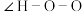 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: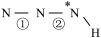 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-05-21更新
|
530次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题

 溶液+蒸馏水
溶液+蒸馏水