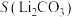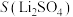名校
1 . 下列有关物质的比较错误的是
A.常压下的沸点:戊烷 2-甲基丁烷 2-甲基丁烷 2,2-二甲基丙烷 2,2-二甲基丙烷 正丁烷 正丁烷 异丁烷 异丁烷 |
B.酸性: 大于 大于 |
C.常温下的密度:己烷 水 水 溴苯 溴苯 |
D.等质量的下列物质燃烧耗 量:乙烷 量:乙烷 乙烯 乙烯 乙炔 乙炔 |
您最近一年使用:0次
2 . 设阿伏加德罗常数的值为 ,下列说法中正确的是
,下列说法中正确的是
 ,下列说法中正确的是
,下列说法中正确的是A.甲烷与氯气反应,生成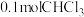 ,转移电子数 ,转移电子数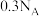 |
B.标准状况下,2.24L己烷在氧气中完全燃烧生成 分子数为 分子数为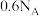 |
C.0.1mol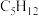 分子中含有的 分子中含有的 键数为 键数为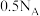 |
D.24g石墨中含有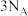 个σ键 个σ键 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法正确的是
| A.质谱法能快速、精确地测定有机物中官能团的种类 |
| B.因HF分子间存在氢键有关,故HF比HCl稳定 |
C.键角: 是由于 是由于 中 中 上孤电子对数比 上孤电子对数比 分中 分中 上的少 上的少 |
D. 、 、 分子中所有原子的最外层电子都满足8电子稳定结构 分子中所有原子的最外层电子都满足8电子稳定结构 |
您最近一年使用:0次
名校
4 . 化学与人们的生产、生活紧密联系。下列对应的化学解读正确的是
| A | B | C | D |
|
|
|
|
| 石墨烯中碳原子存在两种杂化类型 | 冰雪融化时,断开了极性共价键 | 与原子核外电子跃迁释放能量有关 | 干冰是共价晶体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 铁元素在地壳中含量丰富,应用广泛。回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用 ,则与之相反的用
,则与之相反的用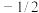 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为___________ 。
(2) 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子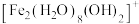 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角___________ (填“大于”、“小于”或“等于”) 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是___________ 键(填“a”或“b”)。 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为___________ , 的空间构型是
的空间构型是___________ ;尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是___________ 。
(4) 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为___________ , 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为___________  (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用
 ,则与之相反的用
,则与之相反的用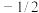 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为(2)
 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子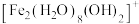 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是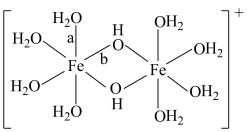
 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为 的空间构型是
的空间构型是(4)
 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为 (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。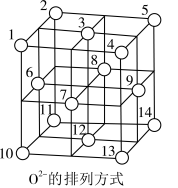
您最近一年使用:0次
6 .  、
、 、
、 三种元素性质非常相似,称铁系元素。请回答下列问题。
三种元素性质非常相似,称铁系元素。请回答下列问题。
(1)三种元素位于周期表中______ 区(填分区),基态 原子的外围电子轨道表达式为
原子的外围电子轨道表达式为______ 。
(2) 成为阳离子首先失去
成为阳离子首先失去______ 轨道电子; 、
、 的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是
的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是______ 的熔点,理由是______ 。
(3) 常作净水剂和补铁剂,
常作净水剂和补铁剂, 空间构型为
空间构型为______ ,与其互为等电子体的分子有______ (写一个)。
(4) 的结构如图1所示(略去
的结构如图1所示(略去 原子)(Y是乙二胺四乙酸,分子式为
原子)(Y是乙二胺四乙酸,分子式为 )。该图中四种元素第一电离能由大到小的顺序为
)。该图中四种元素第一电离能由大到小的顺序为______ (写元素符号),其中 原子的杂化类型为
原子的杂化类型为______ 。 该配合物中配位键有
该配合物中配位键有______ mol。 晶体为
晶体为 型结构(如图2)。其中
型结构(如图2)。其中 可看成填充在由
可看成填充在由 组成的正
组成的正______ 面体空隙中,填充率为 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为 ,成为
,成为 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有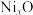 晶胞的质量为
晶胞的质量为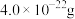 。则分别填充
。则分别填充 、
、 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为______ 。
 、
、 、
、 三种元素性质非常相似,称铁系元素。请回答下列问题。
三种元素性质非常相似,称铁系元素。请回答下列问题。(1)三种元素位于周期表中
 原子的外围电子轨道表达式为
原子的外围电子轨道表达式为(2)
 成为阳离子首先失去
成为阳离子首先失去 、
、 的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是
的熔点是下列两个数值中的一个:1360℃、1565℃,1360℃是(3)
 常作净水剂和补铁剂,
常作净水剂和补铁剂, 空间构型为
空间构型为(4)
 的结构如图1所示(略去
的结构如图1所示(略去 原子)(Y是乙二胺四乙酸,分子式为
原子)(Y是乙二胺四乙酸,分子式为 )。该图中四种元素第一电离能由大到小的顺序为
)。该图中四种元素第一电离能由大到小的顺序为 原子的杂化类型为
原子的杂化类型为 该配合物中配位键有
该配合物中配位键有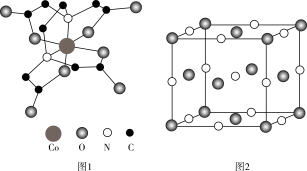
 晶体为
晶体为 型结构(如图2)。其中
型结构(如图2)。其中 可看成填充在由
可看成填充在由 组成的正
组成的正 。将
。将 在空气中加热,部分
在空气中加热,部分 被氧化为
被氧化为 ,成为
,成为 ,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有
,晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有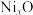 晶胞的质量为
晶胞的质量为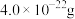 。则分别填充
。则分别填充 、
、 和未填充
和未填充 离子的空隙个数之比为
离子的空隙个数之比为
您最近一年使用:0次
7日内更新
|
241次组卷
|
3卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
名校
7 . 前四周期元素X、Y、Z、W、Q原子序数依次增大,其中Y、Z同周期,Z、W同主族;X、Y、Z是人体内含量最高的三种元素,X、Y、Z、W、Q五原子核外电子数之和为51。下列叙述合理的是
A.原子半径 |
| B.X、Y形成的化合物沸点低于X、Z形成的化合物 |
| C.这些元素组成的三元化合物都可溶于水 |
D. 的一种化合物常加于煤中,避免煤燃烧产生的 的一种化合物常加于煤中,避免煤燃烧产生的 的某种氧化物污染空气 的某种氧化物污染空气 |
您最近一年使用:0次
7日内更新
|
257次组卷
|
3卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
名校
8 . 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器和连接装置)
实验序号 | 实验目的 | 玻璃仪器 | 试剂 |
① | 萃取碘水中的碘单质 | 长颈漏斗、烧杯 |
|
② | 制 | 启普发生器、试管、导管 |
|
③ | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、烧杯、玻璃棒 | 蒸馏水、NaCl固体 |
④ | 葡萄糖的银镜反应实验 | 试管、酒精灯、烧杯、量筒、胶头滴管 | 10%葡萄糖溶液、新制的银氨溶液 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
7日内更新
|
256次组卷
|
3卷引用:2024届四川省仁寿第一中学校南校区高三下学期模拟考试(四)理综试题-高中化学
名校
解题方法
9 . 碳酸锂是制备锂电池的重要原料。一种由α—锂辉石(主要成分可用 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下: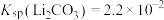 ,各离子沉淀pH范围:
,各离子沉淀pH范围:
回答下列问题:
(1)“煅烧”过程中 转化为
转化为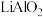 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式_______ 。
(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是_______ ;“调节pH”步骤应当控制的pH范围为_______ ,
(3)写出“除锰”过程中的离子反应方程式_______ 。若“除钙”后滤液中Li+浓度为0.2mol/L,则该步骤后 浓度应该低于
浓度应该低于_______ mol/L。
(4)已知 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:
“沉锂”后应该选择_______ ℃(选填“20”、“50”和“80”)蒸馏水洗涤,写出检验沉淀是否洗涤干净的操作_______ 。
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是_______ 。将碳酸锂与 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式_______ 。
 表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
表示,还含有Al、Fe和Mn元素的氧化物)制备电池级碳酸锂的工艺流程如下:
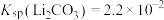 ,各离子沉淀pH范围:
,各离子沉淀pH范围:离子 |
|
|
|
|
开始沉淀pH | 7.6 | 2.7 | 3.8 | 8.3 |
沉淀完全pH | 9.7 | 3.2 | 5.2 | 9.8 |
(1)“煅烧”过程中
 转化为
转化为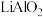 ,写出
,写出 与生石灰反应的化学反应方程式
与生石灰反应的化学反应方程式(2)硫酸作为浸取酸时需要加入少量硝酸,其作用是
(3)写出“除锰”过程中的离子反应方程式
 浓度应该低于
浓度应该低于(4)已知
 、
、 的溶解度(g/100g水)如下表所示:
的溶解度(g/100g水)如下表所示:T/℃ | 20 | 50 | 80 |
| 1.33 | 1.10 | 0.85 |
| 34.2 | 32.5 | 30.7 |
(5)“沉锂”后所得碳酸锂再次经过“碳化”—“热解”步骤的目的是
 混合,在空气中焙烧可制备电池阴极材料
混合,在空气中焙烧可制备电池阴极材料 ,写出其化学反应方程式
,写出其化学反应方程式
您最近一年使用:0次
2024-06-11更新
|
181次组卷
|
3卷引用:2024届四川省眉山市高三下学期第三次诊断考试理科综合试题 -高中化学
名校
解题方法
10 . 丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的 -紫罗兰酮和
-紫罗兰酮和 -紫罗兰酮,转化过程如图所示。下列说法错误的是
-紫罗兰酮,转化过程如图所示。下列说法错误的是
 -紫罗兰酮和
-紫罗兰酮和 -紫罗兰酮,转化过程如图所示。下列说法错误的是
-紫罗兰酮,转化过程如图所示。下列说法错误的是
A. -紫罗兰酮和 -紫罗兰酮和 -紫罗兰酮所有碳原子不可能处于同一平面上 -紫罗兰酮所有碳原子不可能处于同一平面上 |
B.假紫罗兰酮、 -紫罗兰酮和 -紫罗兰酮和 -紫罗兰酮互为同分异构体 -紫罗兰酮互为同分异构体 |
| C.柠檬醛合成假紫罗兰酮的过程中官能团的种类数目不变 |
| D.柠檬醛可以使酸性高锰酸钾溶液和溴水褪色 |
您最近一年使用:0次
2024-06-08更新
|
201次组卷
|
2卷引用:2024届四川省眉山市仁寿县四川省仁寿第一中学校(北校区)模拟预测理综试题-高中化学





 、碘水
、碘水
 固体、浓硫酸(70%)
固体、浓硫酸(70%)