真题
解题方法
1 . 化学用语可以表达化学过程,下列化学用语表达错误的是
A.用电子式表示 的形成: 的形成: |
B.亚铜氨溶液除去合成氨原料气中的 : : |
C.用电子云轮廓图示意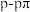 键的形成: 键的形成: |
D.制备芳纶纤维凯芙拉:  |
您最近一年使用:0次
名校
2 . 下列变化过程中,所需克服作用力相同的是
| A.干冰熔化、二氧化硅熔化 |
| B.干冰升华、碘升华 |
| C.过氧化氢分解、碳酸氢钠受热分解 |
| D.氢氧化钠溶于水、氯化氢溶于水 |
您最近一年使用:0次
3 . 近年我国大力加强温室气体 催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:①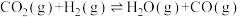
 。
。
②
 。
。
写出 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:_______ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是_______ (填选项字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由 (g)催化氢化合成
(g)催化氢化合成 (g),如图所示为不同投料比[
(g),如图所示为不同投料比[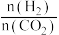 ]时某反应物X平衡转化率变化曲线:反应物X是
]时某反应物X平衡转化率变化曲线:反应物X是_______ (填“ ”或“
”或“ ”)。
”)。 、2mol
、2mol  和催化剂发生合成
和催化剂发生合成 的反应(以总反应方程式计算),10min时反应达到平衡状态,测得
的反应(以总反应方程式计算),10min时反应达到平衡状态,测得 。
。
①0~10min内,用氢气表示的化学反应速率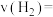
_______  ,化学平衡常数K=
,化学平衡常数K=_______ ;若起始压强为 ,则平衡常数
,则平衡常数
_______ (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②下列条件能说明该反应达到平衡状态的是_______ (填选项字母)。
A.
B.容器内混合气体的总压强不再变化
C.容器内混合气体的密度保持不变
D.容器内各物质的浓度满足
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如表所示:
根据表中所给数据,用 生产甲醇的最优实验为
生产甲醇的最优实验为_______ (填实验编号)。
 催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:①
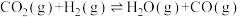
 。
。②

 。
。写出
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由
 (g)催化氢化合成
(g)催化氢化合成 (g),如图所示为不同投料比[
(g),如图所示为不同投料比[ ]时某反应物X平衡转化率变化曲线:反应物X是
]时某反应物X平衡转化率变化曲线:反应物X是 ”或“
”或“ ”)。
”)。
 、2mol
、2mol  和催化剂发生合成
和催化剂发生合成 的反应(以总反应方程式计算),10min时反应达到平衡状态,测得
的反应(以总反应方程式计算),10min时反应达到平衡状态,测得 。
。①0~10min内,用氢气表示的化学反应速率
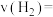
 ,化学平衡常数K=
,化学平衡常数K= ,则平衡常数
,则平衡常数
②下列条件能说明该反应达到平衡状态的是
A.

B.容器内混合气体的总压强不再变化
C.容器内混合气体的密度保持不变
D.容器内各物质的浓度满足

③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如表所示:
| 实验编号 | 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
 生产甲醇的最优实验为
生产甲醇的最优实验为
您最近一年使用:0次
名校
4 . 亚氯酸钠(NaClO2)是高效氧化剂和漂白剂。实验室制备NaClO2的装置图如图所示。 2NaClO3+2NaCl。
2NaClO3+2NaCl。
(1)仪器a的名称为______ 。
(2)补全并配平下列反应的化学方程式______ 。
_______H2O2+_______ +_______NaOH=_______NaClO2+_______
+_______NaOH=_______NaClO2+_______ +_______H2O
+_______H2O
(3)冷水浴的作用不包括______ 。
(4)当试管中有大量晶体析出时,停止反应。获得该晶体所需要操作方法为______ 。
(5)若获得的晶体纯度不符合要求,欲提高其纯度的实验方法为_______ 。
(6)某小组同学欲测定亚氯酸钠晶体(NaClO2•3H2O)中结晶水的数目。甲同学指出NaClO2会分解而无法完成实验,但乙同学却认为可行。简述你的观点和理由_______ 。
(7)上述NaClO2产品的纯度测定实验为:称取mg样品溶解后,加入稍过量的KI,再滴加适量的稀硫酸,充分反应后,稀释为100mL溶液。最后移取25.00mL上述溶液,恰好消耗VmLcmol•L-1Na2S2O3溶液。
有关反应原理如下:ClO +4I-+4H+=2H2O+2I2+Cl-
+4I-+4H+=2H2O+2I2+Cl-
I2+2S2O =2I-+S4O
=2I-+S4O
计算该NaClO2产品的纯度______ 。(用含m、C、V的代数式表示,写出计算过程)。
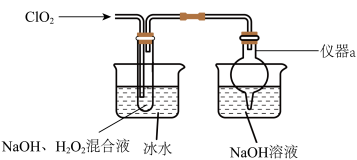
 2NaClO3+2NaCl。
2NaClO3+2NaCl。(1)仪器a的名称为
(2)补全并配平下列反应的化学方程式
_______H2O2+_______
 +_______NaOH=_______NaClO2+_______
+_______NaOH=_______NaClO2+_______ +_______H2O
+_______H2O(3)冷水浴的作用不包括
| A.防止NaClO2分解 | B.防止H2O2分解 |
| C.促进NaClO2析出 | D.提高反应速率 |
(4)当试管中有大量晶体析出时,停止反应。获得该晶体所需要操作方法为
| A.过滤 | B.结晶 | C.蒸馏 | D.分液 |
(5)若获得的晶体纯度不符合要求,欲提高其纯度的实验方法为
(6)某小组同学欲测定亚氯酸钠晶体(NaClO2•3H2O)中结晶水的数目。甲同学指出NaClO2会分解而无法完成实验,但乙同学却认为可行。简述你的观点和理由
(7)上述NaClO2产品的纯度测定实验为:称取mg样品溶解后,加入稍过量的KI,再滴加适量的稀硫酸,充分反应后,稀释为100mL溶液。最后移取25.00mL上述溶液,恰好消耗VmLcmol•L-1Na2S2O3溶液。
有关反应原理如下:ClO
 +4I-+4H+=2H2O+2I2+Cl-
+4I-+4H+=2H2O+2I2+Cl-I2+2S2O
 =2I-+S4O
=2I-+S4O
计算该NaClO2产品的纯度
您最近一年使用:0次
5 . 回答下列问题:
(1)根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中_______ (填“吸收”或“放出”)的能量为_______ kJ。 ,n(NO)随时间变化如下表:
,n(NO)随时间变化如下表:
①0~2s内,用O2表示该反应的反应速率为_______ mol·L-1·s-1。
②下列措施能够使该反应的反应速率加快的是_______ (填字母)。
a.降低温度 b.使用合适的催化剂 c.减小容器容积
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的N2O5。_______ (填“石墨Ⅰ”或“石墨Ⅱ”)。
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2为_______ L。
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图甲所示),该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示,请分析并回答如下问题:_______ (填化学式)。
(5)0~t1时间段的温度为_______ 。
(1)根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中

 ,n(NO)随时间变化如下表:
,n(NO)随时间变化如下表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
②下列措施能够使该反应的反应速率加快的是
a.降低温度 b.使用合适的催化剂 c.减小容器容积
(3)NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的N2O5。

②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的O2为
在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图甲所示),该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示,请分析并回答如下问题:
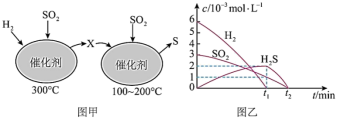
(5)0~t1时间段的温度为
您最近一年使用:0次
名校
6 . 下列生产或实验事实引出的相应结论正确的是
| 选项 | 事实 | 结论 |
| A | 在容积可变的密闭容器中发生反应:2NH3(g) N2H4 (g)+H2 (g),把容器体积缩小一半 N2H4 (g)+H2 (g),把容器体积缩小一半 | 正反应速率加快,逆反应速率也加快 |
| B | 将少量Na2S2O3样品溶于水,滴入过量的稀硝酸后,再滴入BaCl2溶液,有白色沉淀产生 | 说明Na2S2O3已变质 |
| C | 向盛有某溶液的试管中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 与氨溶液中无铵根离子 |
| D | 向鸡蛋清溶液中滴加饱和硫酸铵溶液,振荡,有固体析出 | 硫酸铵溶液能使蛋白质变性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数一定为3NA |
| B.标准状况下,11.2L己烷所含的分子数为0.5NA |
| C.含2mol H2SO4的浓硫酸与足量的铜在加热条件下反应,生成SO2的体积在标准状况下为22.4L |
| D.3mol NO2溶于水,转移的电子数为NA |
您最近一年使用:0次
名校
8 . “碳达峰”“碳中和”“低碳”成为网络热词,其相关内容是二氧化碳导致的温室效应。二氧化碳的转化和利用成为一个重要的研究课题。回答下列问题:
(1)乙烯是一种重要的化工原料,利用 和
和 为原料可生产乙烯。已知相关热化学方程式如下:
为原料可生产乙烯。已知相关热化学方程式如下:
反应Ⅰ: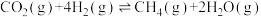
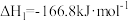 ;
;
反应Ⅱ:
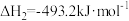 ;
;
反应Ⅲ:
 ;
;
①反应Ⅳ: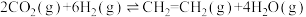

_______  。
。
②在某种催化剂的作用下,在容积为2.0L的恒容密闭容器中充入1mol 和3mol
和3mol  ,体系中主要发生上述反应Ⅰ和反应Ⅳ两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如下图所示,该催化剂在840℃时主要选择
,体系中主要发生上述反应Ⅰ和反应Ⅳ两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如下图所示,该催化剂在840℃时主要选择_______ (填“反应Ⅰ”或“反应Ⅳ”);520℃时,0~t min内用氢气表示反应Ⅳ的平均反应速率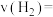
_______  (用含t的代数式表示)。
(用含t的代数式表示)。 反应成功制备了DMC:
反应成功制备了DMC: 。
。
①上述反应达到平衡时,其他条件不变,向恒压密闭容器中充入少量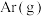 ,甲醇的平衡转化率
,甲醇的平衡转化率____ (填“增大”“减小”或“不变”)。
②温度为T K,按投料比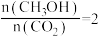 向恒容密闭容器中投料,平衡前后气体的压强之比为6∶5,测得平衡体系中气体的压强为
向恒容密闭容器中投料,平衡前后气体的压强之比为6∶5,测得平衡体系中气体的压强为 kPa,则T K时该反应的压强平衡常数
kPa,则T K时该反应的压强平衡常数
_______  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
(1)乙烯是一种重要的化工原料,利用
 和
和 为原料可生产乙烯。已知相关热化学方程式如下:
为原料可生产乙烯。已知相关热化学方程式如下:反应Ⅰ:
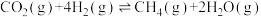
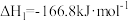 ;
;反应Ⅱ:

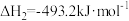 ;
;反应Ⅲ:

 ;
;①反应Ⅳ:
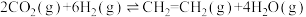

 。
。②在某种催化剂的作用下,在容积为2.0L的恒容密闭容器中充入1mol
 和3mol
和3mol  ,体系中主要发生上述反应Ⅰ和反应Ⅳ两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如下图所示,该催化剂在840℃时主要选择
,体系中主要发生上述反应Ⅰ和反应Ⅳ两个竞争反应。反应进行tmin时测得两种烃的物质的量随温度的变化如下图所示,该催化剂在840℃时主要选择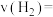
 (用含t的代数式表示)。
(用含t的代数式表示)。
 反应成功制备了DMC:
反应成功制备了DMC: 。
。①上述反应达到平衡时,其他条件不变,向恒压密闭容器中充入少量
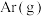 ,甲醇的平衡转化率
,甲醇的平衡转化率②温度为T K,按投料比
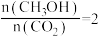 向恒容密闭容器中投料,平衡前后气体的压强之比为6∶5,测得平衡体系中气体的压强为
向恒容密闭容器中投料,平衡前后气体的压强之比为6∶5,测得平衡体系中气体的压强为 kPa,则T K时该反应的压强平衡常数
kPa,则T K时该反应的压强平衡常数
 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
您最近一年使用:0次
名校
9 . “类比”是我们学习化学的重要方法,下列由客观事实类比得到的结论正确的是
| 选项 | 客观事实 | 类比结论 |
| A |  与 与 能直接化合生成 能直接化合生成 |  与 与 可直接化合生成 可直接化合生成 |
| B | 将 放入 放入 溶液中可置换出 溶液中可置换出 | 将 放入 放入 溶液中可置换出 溶液中可置换出 |
| C |  |  |
| D |  的空间构型为正四面体形 的空间构型为正四面体形 |  的空间构型为正四面体形 的空间构型为正四面体形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 氧化石墨烯的结构片段如图所示。一种新的制备方法是用Pt电极,在稀硫酸中对石墨进行电解氧化。电解水产生的大量高活性氧自由基(如:·OH)与石墨反应生成了氧化石墨烯。下列说法不正确的是

| A.石墨烯应该与电源的正极相连 |
B.电解过程中有 产生 产生 |
| C.可用稀盐酸代替稀硫酸进行电解 |
D.“·OH”的生成: |
您最近一年使用:0次



