名校
解题方法
1 . 能正确表示下列反应的离子方程式是
A.向二元弱酸亚磷酸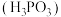 溶液中滴入足量烧碱溶液: 溶液中滴入足量烧碱溶液: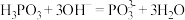 |
B. 与盐酸反应生成白色沉淀: 与盐酸反应生成白色沉淀: |
C. 溶液中滴加 溶液中滴加 溶液至中性: 溶液至中性: |
D.粗铜电解精炼(粗铜作阳极, 溶液作电解液)的总反应:Cu(阳极) 溶液作电解液)的总反应:Cu(阳极) Cu(阴极) Cu(阴极) |
您最近一年使用:0次
2 . 下列有关物质的性质与用途具有对应关系的是
A. 熔点高,可用于电解冶炼铝 熔点高,可用于电解冶炼铝 |
| B.MgO是碱性氧化物,可用作耐高温材料 |
| C.CaO具有吸水性,可用作燃煤中的脱硫剂 |
D. 不溶于盐酸,可用作胃肠道造影检查 不溶于盐酸,可用作胃肠道造影检查 |
您最近一年使用:0次
名校
解题方法
3 . 完成下列问题
(1)甲醇与氧气在氢氧化钾溶液中形成燃料电池,写出负极方程式_______ 。
(2)已知20℃下,饱和食盐水的质量分数为26.5%,密度为1.17 g/mL,则该饱和食盐水的物质的量浓度为_______ mol/L。
(3)向27.2 g由Fe和Fe2O3组成的固体混合物加入2L一定浓度的稀硫酸后固体恰好溶解,可收集到标准状况下气体2.24 L,再向反应后的溶液中滴入KSCN溶液,无明显现象。(忽略反应前后溶液的体积变化),反应后溶液中FeSO4的物质的量浓度为_______ 。
(4) 溶液与1.95g锌粉在量热计中充分反应。已知:反应
溶液与1.95g锌粉在量热计中充分反应。已知:反应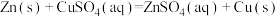 的
的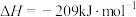 ,反应前后,溶液的比热容均近似为
,反应前后,溶液的比热容均近似为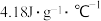 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为_______ ℃。
(1)甲醇与氧气在氢氧化钾溶液中形成燃料电池,写出负极方程式
(2)已知20℃下,饱和食盐水的质量分数为26.5%,密度为1.17 g/mL,则该饱和食盐水的物质的量浓度为
(3)向27.2 g由Fe和Fe2O3组成的固体混合物加入2L一定浓度的稀硫酸后固体恰好溶解,可收集到标准状况下气体2.24 L,再向反应后的溶液中滴入KSCN溶液,无明显现象。(忽略反应前后溶液的体积变化),反应后溶液中FeSO4的物质的量浓度为
(4)
 溶液与1.95g锌粉在量热计中充分反应。已知:反应
溶液与1.95g锌粉在量热计中充分反应。已知:反应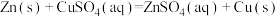 的
的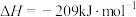 ,反应前后,溶液的比热容均近似为
,反应前后,溶液的比热容均近似为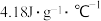 、溶液的密度均近似为
、溶液的密度均近似为 ,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
,忽略溶液体积、质量变化和金属吸收的热量。实验测得反应前温度为20.1℃,请计算反应后测得的最高温度为
您最近一年使用:0次
名校
4 . 二氯化二硫( )可作硫化剂、氯化剂。常温下,
)可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)选用以下装置制取少量 (加热及夹持装置略)。
(加热及夹持装置略)。___________ 。
②装置连接顺序:A→___________ 。
③D中盛放的试剂是___________ 。
(2) 通水会生成
通水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。___________ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液 c.氯水 d.NaOH溶液
溶液 c.氯水 d.NaOH溶液
②计算混合气体中 的体积分数
的体积分数___________ (用含V、m的代数式表示,不要求计算过程)。
 )可作硫化剂、氯化剂。常温下,
)可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)选用以下装置制取少量
 (加热及夹持装置略)。
(加热及夹持装置略)。
②装置连接顺序:A→
③D中盛放的试剂是
(2)
 通水会生成
通水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.酸性
溶液 b.酸性 溶液 c.氯水 d.NaOH溶液
溶液 c.氯水 d.NaOH溶液②计算混合气体中
 的体积分数
的体积分数
您最近一年使用:0次
5 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.标准状况下, 中含有共价键的数目为 中含有共价键的数目为 |
B.常温下,将 投入足量浓硝酸中,转移电子的数目为 投入足量浓硝酸中,转移电子的数目为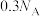 |
C. 溶液中,含有 溶液中,含有 的数目为 的数目为 |
D.高温高压下,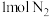 与 与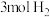 反应生成的 反应生成的 数目为 数目为 |
您最近一年使用:0次
名校
6 . 下列关于有机物的说法正确的是
| A.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
| B.淀粉、纤维素和花生油都是天然有机高分子 |
| C.福尔马林和医用乙醇均能使蛋白质变性 |
| D.丙烯的结构简式为CH2=CHCH3,则聚丙烯的链节为-CH2-CH-CH3- |
您最近一年使用:0次
昨日更新
|
147次组卷
|
2卷引用:湖北省重点高中智学联盟2023-2024学年高一下学期5月联考化学试卷
名校
解题方法
7 . CH4、CH3OH、CO等都是重要的能源,也是重要的化工原料:
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应: 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示:___________ v逆(填“>”、“<”或“=”)。
②从反应开始到平衡,CO2的平均反应速率v(CO2)=___________ 。
③达到平衡时,H2的浓度为___________ mol⋅L-1。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为: ,在一定温度下,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________(填字母序号)。
,在一定温度下,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________(填字母序号)。
(3)某种甲烷燃料电池的工作原理如图所示。___________ 极,将上图中的甲烷改为二甲醚(CH3OCH3)就构成了碱性二甲醚燃料电池,通CH3OCH3的电极的电极反应式为:___________________ 。当电路中有2mol电子通过时,消耗标准状况下氧气的体积为___________ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量、有效地开发利用CO2,工业上可以用CO2来生产甲醇。在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
 。测得
。测得 和CO2的物质的量随时间变化如图所示:
和CO2的物质的量随时间变化如图所示: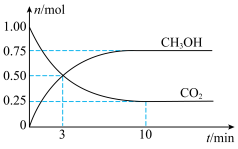
②从反应开始到平衡,CO2的平均反应速率v(CO2)=
③达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应的化学方程式为:
 ,在一定温度下,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________(填字母序号)。
,在一定温度下,在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是___________(填字母序号)。| A.反应体系中CO与CH3OH的物质的量之比为1∶1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1molCO、同时生成lmol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(3)某种甲烷燃料电池的工作原理如图所示。

您最近一年使用:0次
昨日更新
|
89次组卷
|
2卷引用:山东省泰安市新泰第一中学老校区(新泰中学)2023-2024学年高一下学期期中考试化学试题
名校
解题方法
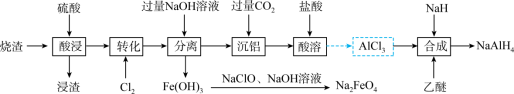
8 . NaAlH4是常用的还原剂;Na2FeO4常做净水剂和消毒剂。工业上以制备硫酸的烧渣(主要成分为Fe3O4、Fe2O3和Al2O3含少量SiO2)为原料制备NaAlH4和Na2FeO4的流程如下:
(1)NaAlH4中氢的化合价为___________ 。
(2)浸渣的主要成分是___________ (填化学式);“转化”中Cl2的作用是___________ (用离子方程式表示)。
(3)由Fe(OH)3制备Na2FeO4的离子方程式为___________ ;“分离”中铝元素转化成___________ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是___________ 。
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为___________ 。
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为___________ (计算结果保留三位有效数字)。
(1)NaAlH4中氢的化合价为
(2)浸渣的主要成分是
(3)由Fe(OH)3制备Na2FeO4的离子方程式为
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,该过程发生反应的化学方程式为
(6)“有效氢”指单位质量(1 g)含氢还原剂的还原能力相当于多少克氢气的还原能力,一般含氢还原剂的氢被氧化成H2O。则NaAlH4有效氢含量为
您最近一年使用:0次
昨日更新
|
65次组卷
|
2卷引用:重庆市万州二中2023-2024学年高一下学期期中考试化学试题
名校
9 . Ⅰ.某同学完成了如下系列实验,探究元素周期表中元素性质的递变规律.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:___________ 与硫酸反应速率最慢,___________ 与硫酸反应产生的气体最多;(填元素符号)
(2)向 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为___________ 。
Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证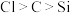 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为___________ 、___________ .该实验采用的理论依据为___________ ;
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:___________ ;
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂 .
. 为
为___________ (填“一”、“二”或“三”)元酸.
(6)不考虑产物的损失,标准状况下若有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成___________ 升 气体.
气体.
(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:
(2)向
 溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为
溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为Ⅱ.验证主族元素非金属性的变化规律设计了如图装置
(3)某研究小组想用该装置一次性验证
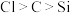 的非金属性的变化规律,则装置A、C中所装药品分别为
的非金属性的变化规律,则装置A、C中所装药品分别为
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂
 .
.
 为
为(6)不考虑产物的损失,标准状况下若有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成 气体.
气体.
您最近一年使用:0次
昨日更新
|
24次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一下学期5月期中考试化学试题
名校
10 . 几种含硫物质的转化如下图(部分反应条件略去),下列判断不正确的是
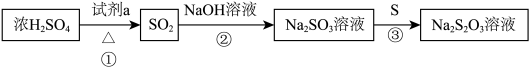
| A.①中,试剂a可以是Na2SO3固体 |
| B.②中,需要确保NaOH溶液足量,否则将得到NaHSO3溶液 |
C.③中,将S换为 ,氧化产物为 ,氧化产物为 |
D.③中,生成1mol  时,转移4mol电子 时,转移4mol电子 |
您最近一年使用:0次
昨日更新
|
52次组卷
|
2卷引用:云南省泸西县第一中学2023-2024学年高一下学期期中考试化学试题



