名校
1 . 人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【配制KMnO4标准溶液】如图是配制50mL KMnO4标准溶液的过程示意图。
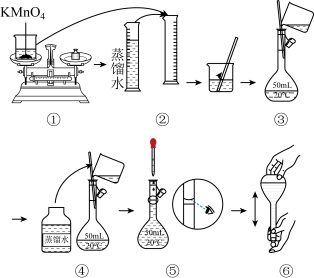
(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)如果用图示的操作配制溶液,所配制的溶液浓度将__________ (填“偏大”或“偏小”)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)已知草酸跟KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则方程式中的x=__________ 。
(4)经过计算,血液样品中Ca2+的浓度为__________ mg·cm-3。
【配制KMnO4标准溶液】如图是配制50mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有
(2)如果用图示的操作配制溶液,所配制的溶液浓度将
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)已知草酸跟KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则方程式中的x=
(4)经过计算,血液样品中Ca2+的浓度为
您最近一年使用:0次
2019-10-22更新
|
841次组卷
|
4卷引用:天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题
解题方法
2 . 通常电动汽车使用的是锂电池,制备锂电池正极材料的主要原料为四氧化三钴,工业上用CoCl2·6H2O制备四氧化三钴。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:
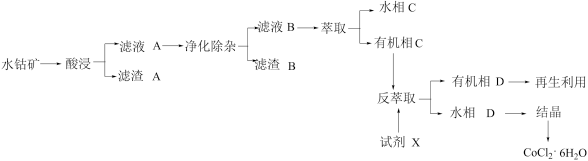
回答下列问题:
(1)“酸浸”
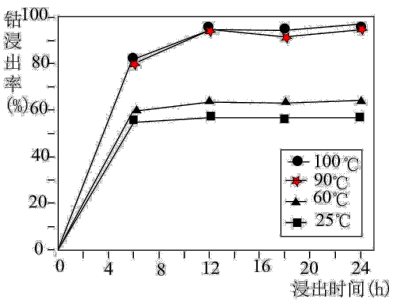
①写出滤渣A主要成分的一种用途________ 。钴的浸出率随酸浸时间、温度的变化关系如图所示。综合考虑,应选择的最佳工艺条件为________ 。
②Co2O3与浓硫酸反应除生成CoSO4和H2O外,还生成的一种物质是________ 。
(2)“净化除杂”过程包括除铁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式____________________________________ 。
②除铜:加入适量Na2S2O3,发生反应2Cu2++2S2O +2H2O=Cu2S↓+S↓+4H++2SO
+2H2O=Cu2S↓+S↓+4H++2SO ,其中氧化产物为
,其中氧化产物为___________ 。
(3)“萃取和反萃取”
①试剂X的名称为_____________ 。
②实验室称取100 g原料(含钴11.80%),反萃取时得到浓度为0.036 mol·L-1的CoCl2溶液5 L,忽略损耗,钴的产率=_____________ 。
(4)以CoCl2·6H2O与NH4HCO3为原料,经两步经典反应合成四氧化三钴,第一步在80℃条件下二者生成Co2(OH)2CO3;第二步在600~820℃下Co2(OH)2CO3在空气中转化生成四氧化三钴,写出第二步反应的化学方程式_______________ 。

回答下列问题:
(1)“酸浸”
①写出滤渣A主要成分的一种用途

②Co2O3与浓硫酸反应除生成CoSO4和H2O外,还生成的一种物质是
(2)“净化除杂”过程包括除铁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式
②除铜:加入适量Na2S2O3,发生反应2Cu2++2S2O
 +2H2O=Cu2S↓+S↓+4H++2SO
+2H2O=Cu2S↓+S↓+4H++2SO ,其中氧化产物为
,其中氧化产物为(3)“萃取和反萃取”
①试剂X的名称为
②实验室称取100 g原料(含钴11.80%),反萃取时得到浓度为0.036 mol·L-1的CoCl2溶液5 L,忽略损耗,钴的产率=
(4)以CoCl2·6H2O与NH4HCO3为原料,经两步经典反应合成四氧化三钴,第一步在80℃条件下二者生成Co2(OH)2CO3;第二步在600~820℃下Co2(OH)2CO3在空气中转化生成四氧化三钴,写出第二步反应的化学方程式
您最近一年使用:0次
名校
3 . 常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
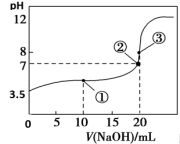

| A.常温下,HA电离常数为1.0×10-6 |
| B.点②所示溶液中:c(Na+)< c(HA)+c(A-) |
| C.点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+) |
| D.从点①到点③的滴定过程中,水的电离程度不变 |
您最近一年使用:0次
2019-01-20更新
|
554次组卷
|
2卷引用:【区级联考】天津市蓟州等部分区2019届高三上学期期末联考化学试题
名校
4 . 以下物质之间的每步转化中,都能通过一步实现的是
① Fe→FeCl2→Fe(OH)2→Fe(OH)3
② Na→Na2O→Na2CO3→NaHCO3→NaOH
③ Mg→MgCl2→Mg(OH)2
④ Al→Al2O3→Al(OH)3
⑤ Al→NaAlO2→Na2CO3
① Fe→FeCl2→Fe(OH)2→Fe(OH)3
② Na→Na2O→Na2CO3→NaHCO3→NaOH
③ Mg→MgCl2→Mg(OH)2
④ Al→Al2O3→Al(OH)3
⑤ Al→NaAlO2→Na2CO3
| A.②③④ | B.①③④⑤ | C.①②③⑤ | D.①②③④⑤ |
您最近一年使用:0次
2017-10-13更新
|
3843次组卷
|
16卷引用:天津市蓟州区马伸桥中学2018-2019学年高一上学期12月联考化学试题
天津市蓟州区马伸桥中学2018-2019学年高一上学期12月联考化学试题湖北省荆州中学2018届高三上学期第二次双周考化学试题河北省石家庄市第二中学2017-2018学年高一12月月考化学试题(已下线)2018年11月11日 ——《每日一题》人教必修1 每周一测(已下线)2019年1月6日 《每日一题》人教必修1- 每周一测(已下线)2019年1月5日 《每日一题》人教必修1- 周末培优【全国百强校】河南省信阳高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】河北省武邑中学2018-2019学年高一下学期开学考试化学试题人教版(2019)高一必修第一册 第三章素养检测河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题黑龙江省实验中学2020-2021学年高一上学期期末考试化学试题贵州省贵阳市清镇养正学校2021届高三上学期第二次月考化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期第三次月考化学试题河南省洛阳市第二中学2022-2023学年高一上学期期末达标考试化学试题章末检测卷(三) 铁 金属材料山西省大同市第一中学校2022-2023学年高一上学期1月期末考试化学试题
名校
5 . 关于氢键,下列说法正确的是
| A.所有含氢元素的化合物中都存在氢键,氢键比范德华力强 |
| B.H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 |
| C.氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 |
| D.分子间形成的氢键通常会使相应物质的熔点和沸点升高,氢键也可存在于分子内 |
您最近一年使用:0次
2017-04-28更新
|
1451次组卷
|
12卷引用:天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题
天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题湖北省宜昌市部分示范高中教学协作体2016-2017学年高二下学期期中考试化学试题湖北省宜昌市示范高中协作体2016-2017学年高二下学期期中考试化学试题安徽省阜阳市临泉县第一中学2016-2017学年高一下学期学科竞赛化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期中考试化学试题高二选择性必修2(人教版2019)第二章 分子结构与性质 第三节 分子结构与物质的性质 课时2 分子间的作用力 分子的手性(已下线)第二章 分子结构与性质【过关测试基础卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)第二章 分子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)吉林省松原市乾安县第七中学2020-2021学年高二下学期第五次质量检测化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测内蒙古通辽市重点学校2022-2023学年高二下学期3月质量检测化学试题四川省自贡市2022-2023学年高二下学期期末考试化学试题



