解题方法
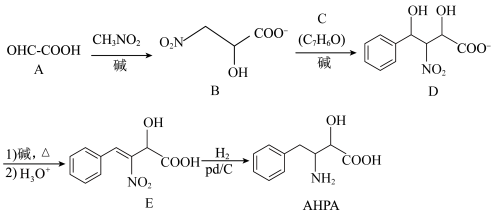
1 . 非天然氨基酸AHPA是一种重要的药物中间体,其合成路线之一如下: 氧化得到,
氧化得到, 的化学名称是
的化学名称是_______ ;关于 ,下列说法不正确的是
,下列说法不正确的是_______ 。
A.能发生取代反应 B.能发生消去反应 C.能与 反应 D.能进行缩取反应反应
反应 D.能进行缩取反应反应
(2)C的结构简式为_______ 。
(3)D中手性碳原子数目为_______ 。
(4)E转化为AHPA的反应类型为_______ 。
(5)AHPA中酸性官能团名称为_______ ,碱性官能团名称为_______ 。
(6)写出同时满足下列条件的AHPA的同分异构体的结构简式_______ 。
①含苯环且苯环只有一个取代基;
②红外光谱显示含氧官能团只有—OH和 ;
;
③核磁共振氢谱显示有6组峰,峰面积:4∶2∶2∶2∶2∶1。
(7)参照上述合成路线,补全下面的合成路线__________ (填写反应条件或结构简式)。
 氧化得到,
氧化得到, 的化学名称是
的化学名称是 ,下列说法不正确的是
,下列说法不正确的是A.能发生取代反应 B.能发生消去反应 C.能与
 反应 D.能进行缩取反应反应
反应 D.能进行缩取反应反应(2)C的结构简式为
(3)D中手性碳原子数目为
(4)E转化为AHPA的反应类型为
(5)AHPA中酸性官能团名称为
(6)写出同时满足下列条件的AHPA的同分异构体的结构简式
①含苯环且苯环只有一个取代基;
②红外光谱显示含氧官能团只有—OH和
 ;
;③核磁共振氢谱显示有6组峰,峰面积:4∶2∶2∶2∶2∶1。
(7)参照上述合成路线,补全下面的合成路线

您最近一年使用:0次
名校
解题方法
2 . 在 时,对
时,对 浓度均为
浓度均为 盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是
盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是
 时,对
时,对 浓度均为
浓度均为 盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是
盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是A.加入少量 固体,溶液中 固体,溶液中 将减小 将减小 |
B.加入 相同浓度的 相同浓度的 溶液,所得溶液 溶液,所得溶液 |
C.加入 溶液,若所得溶液 溶液,若所得溶液 ,则水电离的 ,则水电离的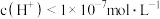 |
D.加入 相同浓度的 相同浓度的 溶液,若忽略混合时的体积变化,此时溶液中: 溶液,若忽略混合时的体积变化,此时溶液中: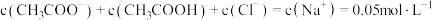 |
您最近一年使用:0次
2024-01-22更新
|
853次组卷
|
6卷引用:天津市河东区2024年高三下学期一模考试化学试题
天津市河东区2024年高三下学期一模考试化学试题2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)选择题11-14(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)重庆市第八中学2023-2024学年高二下学期第一次月考化学试卷
3 . 硫酸铵焙烧浸出液水解制备偏钛酸 可回收钛。
可回收钛。
已知:i.一定条件下,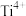 水解方程式:
水解方程式: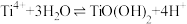
ⅱ.一定温度下: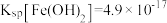 ;
;
I.水解制备偏钛酸:浸出液中含 、
、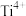 等,先向其中加入还原铁粉,然后控制水解条件实现
等,先向其中加入还原铁粉,然后控制水解条件实现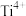 水解制备偏钛酸。
水解制备偏钛酸。
(1)用化学用语表示 溶液呈酸性的原因
溶液呈酸性的原因_______ 。
(2)浸出液( )时:
)时:
① 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为_______  ;
; 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为_______  ;
;
②若杂质离子沉淀会降低钛水解率。从定量角度解释加入还原铁粉的目的_______ 。
(3)一定条件下,还原铁粉添加比对钛水解率的影响如图1所示。当还原铁粉添加比大于1时,钛水解率急剧下降,解释其原因_______ 。

已知:还原铁粉添加比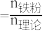 ;
;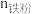 为还原铁粉添加量,
为还原铁粉添加量,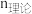 验为浸出液中
验为浸出液中 全部还原为
全部还原为 所需的还原铁粉理论量。
所需的还原铁粉理论量。
(4)一定条件下,温度对钛水解率的影响如图2所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因_______ 。

Ⅱ.电解制备钛:偏钛酸煅烧得到二氧化钛( ),运用电化学原理在无水
),运用电化学原理在无水 熔盐电解质中电解
熔盐电解质中电解 得到海绵钛,装置如图3所示。
得到海绵钛,装置如图3所示。
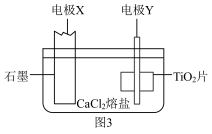
(5)电极X连接电源_______ (填“正”或“负”)极;写出电极Y上发生的电极反应式_______ 。
 可回收钛。
可回收钛。已知:i.一定条件下,
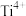 水解方程式:
水解方程式: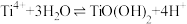
ⅱ.一定温度下:
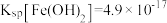 ;
;
I.水解制备偏钛酸:浸出液中含
 、
、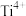 等,先向其中加入还原铁粉,然后控制水解条件实现
等,先向其中加入还原铁粉,然后控制水解条件实现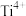 水解制备偏钛酸。
水解制备偏钛酸。(1)用化学用语表示
 溶液呈酸性的原因
溶液呈酸性的原因(2)浸出液(
 )时:
)时:①
 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为 ;
; 转化为
转化为 沉淀需要的浓度为
沉淀需要的浓度为 ;
;②若杂质离子沉淀会降低钛水解率。从定量角度解释加入还原铁粉的目的
(3)一定条件下,还原铁粉添加比对钛水解率的影响如图1所示。当还原铁粉添加比大于1时,钛水解率急剧下降,解释其原因

已知:还原铁粉添加比
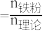 ;
;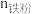 为还原铁粉添加量,
为还原铁粉添加量,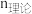 验为浸出液中
验为浸出液中 全部还原为
全部还原为 所需的还原铁粉理论量。
所需的还原铁粉理论量。(4)一定条件下,温度对钛水解率的影响如图2所示。结合化学平衡移动原理解释钛水解率随温度升高而增大的原因

Ⅱ.电解制备钛:偏钛酸煅烧得到二氧化钛(
 ),运用电化学原理在无水
),运用电化学原理在无水 熔盐电解质中电解
熔盐电解质中电解 得到海绵钛,装置如图3所示。
得到海绵钛,装置如图3所示。
(5)电极X连接电源
您最近一年使用:0次
名校
4 .  是一种重要的化工原料,被广泛应用在工农业生产中。已知反应:
是一种重要的化工原料,被广泛应用在工农业生产中。已知反应:
I.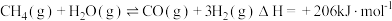
II.
III.
(1)请写出甲烷裂解制取炭黑的热化学方程式_______ 。
(2)根据反应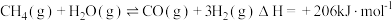 ,回答下列问题:
,回答下列问题:
①800 时,平衡常数
时,平衡常数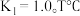 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为: ,则T℃
,则T℃____ 800℃(填“ ”、“
”、“ ”或“
”或“ ”),判断依据是
”),判断依据是_____ 。
②下列措施有利于提高反应混合气中 含量的是
含量的是_______ 。
A.使用催化剂 B.升高温度
C.及时导出CO D.增大反应体系的压强
③一定条件下,将 与
与 按物质的量之比
按物质的量之比 ∶
∶ 置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是
置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是_______ 。
A.体系中混合气体密度不变 B. 与
与 的转化率相等
的转化率相等
C.反应体系压强不再改变 D. 与
与 物质的量之比不再改变
物质的量之比不再改变
(3)以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。
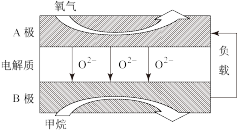
①B极上的电极反应式为_______ 。
②以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到112L(标准状况)气体时,消耗甲烷的体积为_______ L(标准状况)。
 是一种重要的化工原料,被广泛应用在工农业生产中。已知反应:
是一种重要的化工原料,被广泛应用在工农业生产中。已知反应:I.
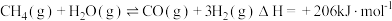
II.

III.

(1)请写出甲烷裂解制取炭黑的热化学方程式
(2)根据反应
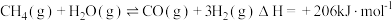 ,回答下列问题:
,回答下列问题:①800
 时,平衡常数
时,平衡常数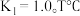 测得密闭容器中各物质达到平衡时物质的量浓度分别为:
测得密闭容器中各物质达到平衡时物质的量浓度分别为: ,则T℃
,则T℃ ”、“
”、“ ”或“
”或“ ”),判断依据是
”),判断依据是②下列措施有利于提高反应混合气中
 含量的是
含量的是A.使用催化剂 B.升高温度
C.及时导出CO D.增大反应体系的压强
③一定条件下,将
 与
与 按物质的量之比
按物质的量之比 ∶
∶ 置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是
置于恒容密闭容器中反应,下列能说明该反应达到平衡状态的是A.体系中混合气体密度不变 B.
 与
与 的转化率相等
的转化率相等C.反应体系压强不再改变 D.
 与
与 物质的量之比不再改变
物质的量之比不再改变(3)以甲烷为燃料的新型电池得到广泛应用。下图是甲烷燃料电池工作原理的示意图。

①B极上的电极反应式为
②以该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到112L(标准状况)气体时,消耗甲烷的体积为
您最近一年使用:0次
2022-09-08更新
|
362次组卷
|
3卷引用:天津市河东区2021-2022学年高二上学期期末质量检测化学试题
天津市河东区2021-2022学年高二上学期期末质量检测化学试题安徽省萧城一中2023届高三上学期期末考试化学试题(已下线)专项04 原电池与电解池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(天津专用)
5 . 部分弱电解质的电离常数如下表:
下列说法错误的是
| 弱电解质 |  |  |  |
| 电离常数(25℃) | 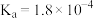 | 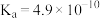 | 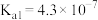  |
A.结合 的能力: 的能力: |
B.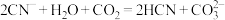 |
C.中和等体积、等 的 的 和 和 消耗 消耗 的量前者小于后者 的量前者小于后者 |
D.25℃时,反应 的化学平衡常数为 的化学平衡常数为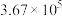 |
您最近一年使用:0次
2022-09-08更新
|
1971次组卷
|
13卷引用:天津市河东区2021-2022学年高二上学期期末质量检测化学试题
天津市河东区2021-2022学年高二上学期期末质量检测化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期期中考试化学试题【全国百强校】黑龙江省鹤岗市第一中学2019届高三上学期第三次月考化学试题湖南省湘潭凤凰中学2022-2023学年高二上学期10月月考化学试题辽宁省昌图县第一高级中学2022-2023学年高二10月月考化学试题吉林省长春市第二中学2022-2023学年高二上学期11月期中考试化学试题广东省广州市三校(广附,铁一,广外)2022-2023学年高二上学期期末联考化学试题北京师范大学附属实验中学2023-2024学年高二上学期10月月考化学试题辽宁省建平县实验中学2023-2024学年高二上学期10月月考化学试题广东实验中学2023-2024学年高二上学期期中考试化学试题 内蒙古呼和浩特市第一中学2023-2024学年高二上学期期中考试化学试题内蒙古呼和浩特市回民区2023-2024学年高二上学期期中考试化学试题福建省莆田五中2023-2024学年高二上学期第三次月考化学试卷
解题方法
6 . 元素的性质与其在周期表中的位置密切相关,回答下列问题:
(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是____ 。
(2)如表是Fe和Cu的部分数据,I2(Cu)____ I2(Fe)(填“>”或“<”)。
(3)磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺 为原料制磷酸亚铁锂电池材料。NH
为原料制磷酸亚铁锂电池材料。NH 的空间构型为
的空间构型为____ ;PO 中P的杂化轨道类型是
中P的杂化轨道类型是____ ;O、P、Cl原子的半径最大的是____ 。(填元素符号)
(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是____ 。
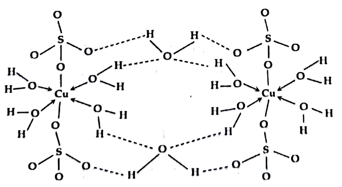
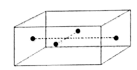
(5)如图是CuSO4•5H2O晶胞的结构图,一个晶胞中有____ 个CuSO4•5H2O。
(6)用硫酸铜晶体(CuSO4•5H2O相对分子质量为250)配制0.10mol/L的硫酸铜溶液1000mL时,应称取晶体____ g。
(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是
| A.Fe | B.Cu | C.Ba | D.Ca |
| 元素 | 核外电子排布式 | 第一电离能I1(kJ·mol-1) | 第二电离能I2(kJ·mol-1) |
| Fe | [Ar]3d64s2 | 762 | |
| Cu | [Ar]3d104s1 | 746 |
 为原料制磷酸亚铁锂电池材料。NH
为原料制磷酸亚铁锂电池材料。NH 的空间构型为
的空间构型为 中P的杂化轨道类型是
中P的杂化轨道类型是(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是

(5)如图是CuSO4•5H2O晶胞的结构图,一个晶胞中有

(6)用硫酸铜晶体(CuSO4•5H2O相对分子质量为250)配制0.10mol/L的硫酸铜溶液1000mL时,应称取晶体
您最近一年使用:0次
名校
解题方法
7 . 异甘草素(Ⅶ)具有抗肿瘤、抗病毒等药物功效。合成路线如下,回答下列问题

已知:①氯甲基甲醚结构简式为:
②RCH2CHO+R’CHO


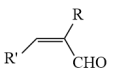
(1)有机物Ⅱ的分子式是___________ ;化合物Ⅳ所含官能团的名称是___________ 。
(2)下列说法不正确 的是___________。
(3)写出Ⅱ转化为Ⅲ的化学反应方程式___________ ;反应类型___________
(4)写出2种符合下列条件的Ⅴ的同分异构体的结构简式(不包括立体异构体)___________
①含有苯环且苯环上有两个取代基;
②与 溶液反应显紫色;
溶液反应显紫色;
③不能发生银镜反应。
(5)设计由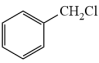 和
和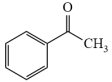 为原料制备
为原料制备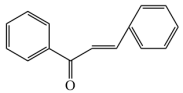 的合成路线(其他无机试剂任选)
的合成路线(其他无机试剂任选) ___________ 。

已知:①氯甲基甲醚结构简式为:

②RCH2CHO+R’CHO




(1)有机物Ⅱ的分子式是
(2)下列说法
A.Ⅰ不易与 溶液反应 溶液反应 | B.Ⅱ中碳的杂化方式有两种 |
| C.Ⅳ的核磁共振氢谱有4组峰 | D.Ⅵ和Ⅶ都存在顺反异构体 |
(4)写出2种符合下列条件的Ⅴ的同分异构体的结构简式(不包括立体异构体)
①含有苯环且苯环上有两个取代基;
②与
 溶液反应显紫色;
溶液反应显紫色;③不能发生银镜反应。
(5)设计由
 和
和 为原料制备
为原料制备 的合成路线(其他无机试剂任选)
的合成路线(其他无机试剂任选)
您最近一年使用:0次
2022-05-01更新
|
397次组卷
|
2卷引用:天津市河东区2022届高三一模化学试题
名校
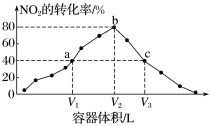
8 . 温度为T ℃,向体积不等的密闭容器中分别加入足量活性炭和1 mol ,发生反应:
,发生反应: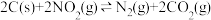 。反应相同时间,测得各容器中
。反应相同时间,测得各容器中 的转化率与容器体积的关系如图所示(
的转化率与容器体积的关系如图所示(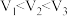 )。下列说法正确的是
)。下列说法正确的是
 ,发生反应:
,发生反应: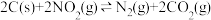 。反应相同时间,测得各容器中
。反应相同时间,测得各容器中 的转化率与容器体积的关系如图所示(
的转化率与容器体积的关系如图所示(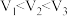 )。下列说法正确的是
)。下列说法正确的是
A.对c点容器加压,缩小容器体积,则此时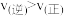 |
B.T ℃时,a、b两点时反应的平衡常数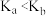 |
C.向a点体系中充入一定量 ,达到新平衡时, ,达到新平衡时, 转化率将减小 转化率将减小 |
D.图中c点所示条件下 |
您最近一年使用:0次
2022-03-20更新
|
885次组卷
|
6卷引用:天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题
名校
解题方法
9 . Ⅰ.常温下, 的水溶液中存在的离子有:
的水溶液中存在的离子有: 、
、 、
、 、
、 ,存在的分子有
,存在的分子有 、
、 。根据题意回答下列问题:
。根据题意回答下列问题:
(1)写出酸 的电离方程式
的电离方程式___________ 。
(2)某温度下,纯水的 ,则此时
,则此时 为
为___________  ;该温度下向纯水中滴入NaOH溶液得到
;该温度下向纯水中滴入NaOH溶液得到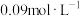 氢氧化钠溶液,则溶液的pH为
氢氧化钠溶液,则溶液的pH为___________ ,此时温度___________ (填“高于”、“低于”或“等于”)25℃。
(3)常温下,将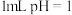 的
的 溶液加水稀释到100mL,稀释后的溶液中
溶液加水稀释到100mL,稀释后的溶液中
___________ ∶___________ 。
Ⅱ.常温下,有pH相同、体积相同的醋酸和盐酸两种溶液。采取以下措施:
(4)加水稀释10倍后,醋酸溶液中的
___________ (填“>”“=”或“<”)盐酸中的 ;
;
(5)使温度都升高30℃(不考虑HCl挥发),溶液中 :醋酸
:醋酸___________ (填“>”“=”或“<”)盐酸。
(6)加水稀释至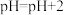 分别加水a mL和b mL,则a
分别加水a mL和b mL,则a___________ b(填“>”“=”或“<”)。
Ⅲ.电离平衡常数是衡量弱电解质电离程度的量,已知下表数据(25℃):
(7)25℃时,向NaCN溶液中通入少量 ,所发生反应的化学方程式为
,所发生反应的化学方程式为___________ 。
 的水溶液中存在的离子有:
的水溶液中存在的离子有: 、
、 、
、 、
、 ,存在的分子有
,存在的分子有 、
、 。根据题意回答下列问题:
。根据题意回答下列问题:(1)写出酸
 的电离方程式
的电离方程式(2)某温度下,纯水的
 ,则此时
,则此时 为
为 ;该温度下向纯水中滴入NaOH溶液得到
;该温度下向纯水中滴入NaOH溶液得到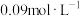 氢氧化钠溶液,则溶液的pH为
氢氧化钠溶液,则溶液的pH为(3)常温下,将
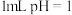 的
的 溶液加水稀释到100mL,稀释后的溶液中
溶液加水稀释到100mL,稀释后的溶液中
Ⅱ.常温下,有pH相同、体积相同的醋酸和盐酸两种溶液。采取以下措施:
(4)加水稀释10倍后,醋酸溶液中的

 ;
;(5)使温度都升高30℃(不考虑HCl挥发),溶液中
 :醋酸
:醋酸(6)加水稀释至
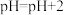 分别加水a mL和b mL,则a
分别加水a mL和b mL,则aⅢ.电离平衡常数是衡量弱电解质电离程度的量,已知下表数据(25℃):
| 化学式 | 电离平衡常数 |
| HCN |  |
 | 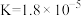 |
 | 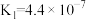  |
 ,所发生反应的化学方程式为
,所发生反应的化学方程式为
您最近一年使用:0次
名校
10 . 今有一混合物的水溶液,只可能含有以下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 、
、 ,现取三份100mL溶液进行实验,三次实验的主要现象和数据如下:
,现取三份100mL溶液进行实验,三次实验的主要现象和数据如下:
①第一份加入 溶液有沉淀产生;
溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.04mol;
③第三份加足量 溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。
溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。
根据上述实验,以下推测不正确的是
 、
、 、
、 、
、 、
、 、
、 、
、 ,现取三份100mL溶液进行实验,三次实验的主要现象和数据如下:
,现取三份100mL溶液进行实验,三次实验的主要现象和数据如下:①第一份加入
 溶液有沉淀产生;
溶液有沉淀产生;②第二份加足量NaOH溶液加热后,收集到气体0.04mol;
③第三份加足量
 溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。
溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g。根据上述实验,以下推测不正确的是
A. 可能存在 可能存在 | B.溶液中含 且浓度为0.2mol/L 且浓度为0.2mol/L |
C. 可能存在 可能存在 | D. 、 、 一定不存在 一定不存在 |
您最近一年使用:0次
2021-07-16更新
|
870次组卷
|
2卷引用:天津市第七中学2022-2023学年高一下学期期中考试化学试题



