名校
1 . 氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇和水蒸气重整制氢的部分反应过程如下图所示:
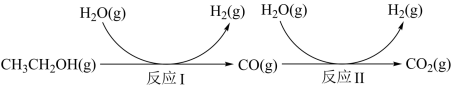
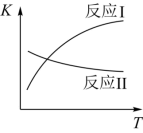
已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。
(1)反应Ⅰ中,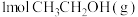 参与反应后的热量变化是
参与反应后的热量变化是 。
。
①反应Ⅰ的热化学方程式是___________ 。
②反应Ⅰ在较高温度下能够自发进行的原因是___________ 。
③已知绝热恒压下,下列说法能够判断反应Ⅰ达到化学平衡状态的是___________ (填字母)。
A 的含量保持不变 B.容器中压强保持不变
的含量保持不变 B.容器中压强保持不变
C.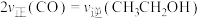 D.体系的温度保持不变
D.体系的温度保持不变
(2)反应Ⅱ中
①某温度下,已知 和
和 的起始浓度总和为
的起始浓度总和为 ,且
,且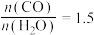 的投料比下,
的投料比下, 的平衡转化率为40%,该温度下反应平衡常数的值为
的平衡转化率为40%,该温度下反应平衡常数的值为___________ 。
②当不同的进气比[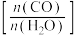 达到相同的
达到相同的 平衡转化率时,对应的反应温度和进气比的关系是
平衡转化率时,对应的反应温度和进气比的关系是___________ 。
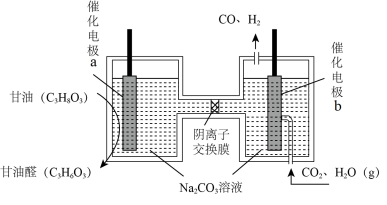
(3)我国科学家设计了一种电解装置如图所示,能将二氧化碳转化成合成气 和
和 ,同时获得甘油醛
,同时获得甘油醛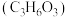 。a极接电源的
。a极接电源的___________ 极;若阴离子交换膜只允许 离子通过,当有
离子通过,当有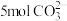 通过时,理论上可制得甘油醛
通过时,理论上可制得甘油醛___________ g。


已知:反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。
(1)反应Ⅰ中,
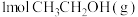 参与反应后的热量变化是
参与反应后的热量变化是 。
。①反应Ⅰ的热化学方程式是
②反应Ⅰ在较高温度下能够自发进行的原因是
③已知绝热恒压下,下列说法能够判断反应Ⅰ达到化学平衡状态的是
A
 的含量保持不变 B.容器中压强保持不变
的含量保持不变 B.容器中压强保持不变C.
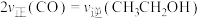 D.体系的温度保持不变
D.体系的温度保持不变(2)反应Ⅱ中
①某温度下,已知
 和
和 的起始浓度总和为
的起始浓度总和为 ,且
,且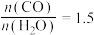 的投料比下,
的投料比下, 的平衡转化率为40%,该温度下反应平衡常数的值为
的平衡转化率为40%,该温度下反应平衡常数的值为②当不同的进气比[
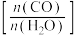 达到相同的
达到相同的 平衡转化率时,对应的反应温度和进气比的关系是
平衡转化率时,对应的反应温度和进气比的关系是(3)我国科学家设计了一种电解装置如图所示,能将二氧化碳转化成合成气
 和
和 ,同时获得甘油醛
,同时获得甘油醛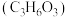 。a极接电源的
。a极接电源的 离子通过,当有
离子通过,当有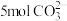 通过时,理论上可制得甘油醛
通过时,理论上可制得甘油醛
您最近一年使用:0次
名校
2 . 实验室利用 和亚硫酰氯
和亚硫酰氯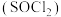 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
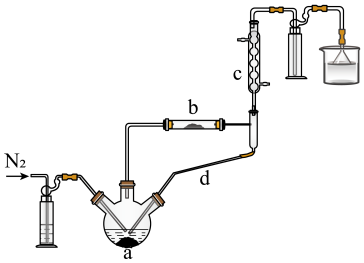
(1)实验开始先通 。一段时间后,先加热装置
。一段时间后,先加热装置___________ (填“a”或“b”)。装置b内发生反应的化学方程式为___________ 。装置c的名称是___________ ,装置c、d共同起到的作用是___________ 。
(2)现有含少量杂质的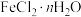 ,为测定n值进行如下实验:
,为测定n值进行如下实验:
实验Ⅰ:称取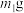 样品,用足量稀硫酸溶解后,用
样品,用足量稀硫酸溶解后,用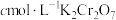 标准溶液滴定
标准溶液滴定 达终点时消耗
达终点时消耗 (滴定过程中
(滴定过程中 转化为
转化为 ,
, 不反应)。
不反应)。
实验Ⅱ:另取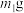 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为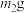 。
。
则
___________ ;滴定时发生的离子方程式为___________ 。下列情况会导致n测量值偏小的是___________ (填标号)。
A.样品中含少量 杂质
杂质
B.样品与 反应时失水不充分
反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)用上述装置、根据反应 制备
制备 。已知
。已知 与
与 分子结构相似,与
分子结构相似,与 互溶,但极易水解。选择合适仪器并组装蒸馏装置对
互溶,但极易水解。选择合适仪器并组装蒸馏装置对 、
、 混合物进行蒸馏蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号),先馏出的物质为___________ 。
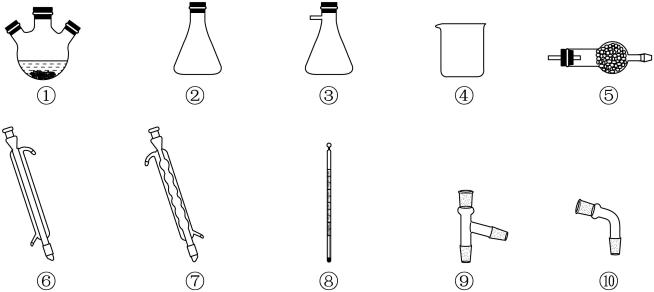
 和亚硫酰氯
和亚硫酰氯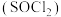 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)实验开始先通
 。一段时间后,先加热装置
。一段时间后,先加热装置(2)现有含少量杂质的
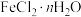 ,为测定n值进行如下实验:
,为测定n值进行如下实验:实验Ⅰ:称取
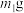 样品,用足量稀硫酸溶解后,用
样品,用足量稀硫酸溶解后,用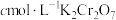 标准溶液滴定
标准溶液滴定 达终点时消耗
达终点时消耗 (滴定过程中
(滴定过程中 转化为
转化为 ,
, 不反应)。
不反应)。实验Ⅱ:另取
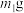 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为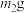 。
。则

A.样品中含少量
 杂质
杂质B.样品与
 反应时失水不充分
反应时失水不充分C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3)用上述装置、根据反应
 制备
制备 。已知
。已知 与
与 分子结构相似,与
分子结构相似,与 互溶,但极易水解。选择合适仪器并组装蒸馏装置对
互溶,但极易水解。选择合适仪器并组装蒸馏装置对 、
、 混合物进行蒸馏蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
您最近一年使用:0次
名校
3 . 新型半导体材料如碳化硅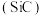 、氮化镓
、氮化镓 等在国防技术、航空航天及5G技术等领域扮演着重要的角色。回答下列问题:
等在国防技术、航空航天及5G技术等领域扮演着重要的角色。回答下列问题:
(1)基态 原子中,核外电子占据的最高能层的符号为
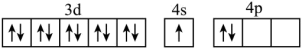
原子中,核外电子占据的最高能层的符号为___________ ,占据最高能级的电子的电子云轮廓图形状为___________ ;基态 原子的核外电子排布为
原子的核外电子排布为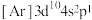 ,其转化为下列激发态时,吸收能量最少的是
,其转化为下列激发态时,吸收能量最少的是___________ (填选项字母)。
A.
B.
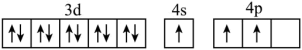
C.
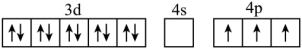
D.
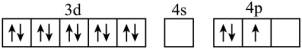
(2)硼(B)与 是同主族元素,硼氢化钠
是同主族元素,硼氢化钠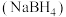 是有机合成中重要的还原剂,基态B原子核外电子有
是有机合成中重要的还原剂,基态B原子核外电子有___________ 种不同的空间运动状态,其阴离子 的立体构型为
的立体构型为___________ ;另一种含硼阴离子的结构如图所示,其中B原子的杂化方式为___________ 。
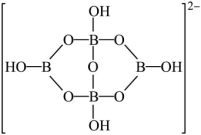
(3) 中,除磷元素外,其余三种元素电负性由大到小的顺序是
中,除磷元素外,其余三种元素电负性由大到小的顺序是___________ (填元素符号),N、P和S第一电离能由大到小的顺序是___________ (填元素符号)。
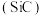 、氮化镓
、氮化镓 等在国防技术、航空航天及5G技术等领域扮演着重要的角色。回答下列问题:
等在国防技术、航空航天及5G技术等领域扮演着重要的角色。回答下列问题:(1)基态
 原子中,核外电子占据的最高能层的符号为
原子中,核外电子占据的最高能层的符号为 原子的核外电子排布为
原子的核外电子排布为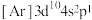 ,其转化为下列激发态时,吸收能量最少的是
,其转化为下列激发态时,吸收能量最少的是A.


B.


C.


D.


(2)硼(B)与
 是同主族元素,硼氢化钠
是同主族元素,硼氢化钠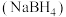 是有机合成中重要的还原剂,基态B原子核外电子有
是有机合成中重要的还原剂,基态B原子核外电子有 的立体构型为
的立体构型为
(3)
 中,除磷元素外,其余三种元素电负性由大到小的顺序是
中,除磷元素外,其余三种元素电负性由大到小的顺序是
您最近一年使用:0次
名校
4 . 室温下,通过下列实验探究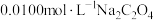 溶液的性质。
溶液的性质。
实验1:实验测得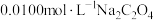 溶液
溶液 为8.6。
为8.6。
实验2:向溶液中滴加等体积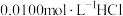 溶液,
溶液, 由8.6降为4.8。
由8.6降为4.8。
实验3:向溶液中加入等体积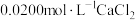 溶液,出现白色沉淀。
溶液,出现白色沉淀。
实验4:向稀硫酸酸化的 溶液中滴加
溶液中滴加 溶液至溶液褪色。
溶液至溶液褪色。
已知室温时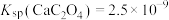 ,下列说法正确的是
,下列说法正确的是
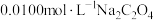 溶液的性质。
溶液的性质。实验1:实验测得
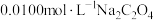 溶液
溶液 为8.6。
为8.6。实验2:向溶液中滴加等体积
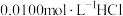 溶液,
溶液, 由8.6降为4.8。
由8.6降为4.8。实验3:向溶液中加入等体积
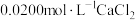 溶液,出现白色沉淀。
溶液,出现白色沉淀。实验4:向稀硫酸酸化的
 溶液中滴加
溶液中滴加 溶液至溶液褪色。
溶液至溶液褪色。已知室温时
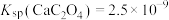 ,下列说法正确的是
,下列说法正确的是A.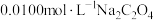 溶液中满足: 溶液中满足: |
B.实验2滴加盐酸后离子浓度关系满足: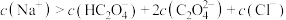 |
C.实验3所得上层清液中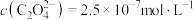 |
D.实验4发生反应的离子方程式为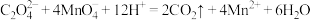 |
您最近一年使用:0次
名校
解题方法
5 . 苯达莫司汀(Bendamustine)是一种抗癌药物。苯达莫司汀的一种合成路线如下:

(1)B→C的反应类型为_______ 。
(2)F中含氧官能团的名称_______ 。
(3)E的结构简式为:_______ 。
(4)C→D的方程式为_______ 。
(5)下列关于上述流程中的物质说法正确的是_______ 。
a.A物质易溶于水
b.C物质的核磁共振氢谱有6组峰
c.在一定条件下,1mol苯达莫司汀与足量的氢气反应,最多能消耗5mol H2
d.一定条件下,F物质能够发生还原、加成、取代等类型的反应
(6)链状有机物G是 的同分异构体,并且G能发生水解反应,1mol G发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有
的同分异构体,并且G能发生水解反应,1mol G发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有_______ 种(不考虑立体异构)
(7)参照题干中的信息及已学知识请写出以甲苯和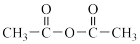 为原料,制
为原料,制 的合成路线流程图。
的合成路线流程图。_______

(1)B→C的反应类型为
(2)F中含氧官能团的名称
(3)E的结构简式为:
(4)C→D的方程式为
(5)下列关于上述流程中的物质说法正确的是
a.A物质易溶于水
b.C物质的核磁共振氢谱有6组峰
c.在一定条件下,1mol苯达莫司汀与足量的氢气反应,最多能消耗5mol H2
d.一定条件下,F物质能够发生还原、加成、取代等类型的反应
(6)链状有机物G是
 的同分异构体,并且G能发生水解反应,1mol G发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有
的同分异构体,并且G能发生水解反应,1mol G发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有(7)参照题干中的信息及已学知识请写出以甲苯和
 为原料,制
为原料,制 的合成路线流程图。
的合成路线流程图。
您最近一年使用:0次
2022-12-22更新
|
365次组卷
|
2卷引用:天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题
6 . 用 表示阿伏加德罗常数的值,,下列有关叙述错误的是
表示阿伏加德罗常数的值,,下列有关叙述错误的是
 表示阿伏加德罗常数的值,,下列有关叙述错误的是
表示阿伏加德罗常数的值,,下列有关叙述错误的是| A.含有3molC-C键的石墨中含有的碳原子数为2 NA |
B.标准状况下,22.4L 与22.4L 与22.4L 充分反应,生成的气体分子数大于NA 充分反应,生成的气体分子数大于NA |
| C.分别向含0.1mol氯化铁的溶液中加入足量镁粉和铜粉,转移的电子数目均为0.1 NA |
D.用铅蓄电池电解氯化钠溶液,当消耗4mol硫酸时,产生 分子数目为2NA 分子数目为2NA |
您最近一年使用:0次
2022-05-24更新
|
1161次组卷
|
3卷引用:天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题
天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题河北省石家庄市第二中学2022届高三下学期5月模拟考试化学试题(已下线)第01讲 物质的量 气体摩尔体积(讲)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
7 . 已知苯并唑酮(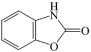 )可转化为X(
)可转化为X(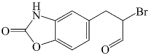 ),下列说法正确的是
),下列说法正确的是
 )可转化为X(
)可转化为X( ),下列说法正确的是
),下列说法正确的是| A.1mol苯并唑酮完全燃烧需要消耗6.25mol氧气 |
| B.X能使酸性高锰酸钾溶液褪色,但不能使溴水褪色 |
| C.X与足量H2加成后所得有机物分子中手性碳原子数目为3个 |
| D.1molX与足量NaOH溶液充分反应,最多可消耗4molNaOH |
您最近一年使用:0次
2022-04-16更新
|
1335次组卷
|
4卷引用:天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题
天津市宝坻区第一中学2022-2023学年高三上学期线上期末训练化学试题浙江省宁波市2022届高三下学期高考模拟考试(二模)化学试题(已下线)化学(重庆B卷)-学易金卷:2023年高考第一次模拟考试卷河北省邯郸市第一中学2022-2023学年高三上学期一轮复习收官考试(二)化学试题
名校
解题方法
8 . 运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=–41.2kJ/mol
CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g)∆H=
CO2(g)+4H2(g)∆H=__ 。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
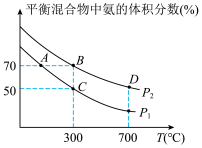
①恒压时,反应一定达到平衡状态的标志是__ (填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C. 保持不变
保持不变
D. =2
=2
②P1__ P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__ D点。
③C点H2的转化率为__ ;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___ v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__ 。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__ L。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/molb.CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H2=–41.2kJ/mol
CO2(g)+H2(g) ∆H2=–41.2kJ/mol则反应CH4(g)+2H2O(g)
 CO2(g)+4H2(g)∆H=
CO2(g)+4H2(g)∆H=(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.
 保持不变
保持不变D.
 =2
=2②P1
③C点H2的转化率为
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为
您最近一年使用:0次
2020-06-30更新
|
838次组卷
|
6卷引用:天津市宝坻一中2020届高三第二次适应性测化学试题
天津市宝坻一中2020届高三第二次适应性测化学试题天津市实验中学高三热身训练化学试题重庆市凤鸣山中学2020届高三上学期第一次月考化学试题内蒙古自治区集宁一中2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第六中学校2020届高三第三次模拟考试理综化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)
名校
解题方法
9 . [Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
| A.Zn2+基态核外电子排布式为[Ar]3d10 |
| B.1mol HCHO分子中含有σ键的数目为1.806×1024 |
| C.HOCH2CN分子中碳原子轨道的杂化类型是sp3 |
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为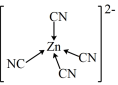 |
您最近一年使用:0次
2020-05-02更新
|
814次组卷
|
18卷引用:天津市宝坻一中2020届高三第二次适应性测化学试题
天津市宝坻一中2020届高三第二次适应性测化学试题天津市南开中学2020届高三第四次月考(线上考试) 化学试题天津市大港油田实验中学2020届高三开学考试化学试题福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题天津市南开中学2021届高三上学期第四次月考化学试题(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练福建省龙岩市武平县第一中学2020-2021学年高二下学期化学月考试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高二下学期期中考试化学试题安徽省淮北市树人高级中学2020-2021学年高二下学期期末考试化学试题吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题新疆新源县第二中学2020-2021学年高二下学期期末联考化学试题四川省南充市南部县第二中学2021-2022学年高二上学期11月月考化学试题 陕西省宝鸡市金台区2021-2022学年高二下学期期末考试化学试题湖南省岳阳市岳阳县第一中学2021-2022学年高二下学期期末考试试题湖南省岳阳市岳阳县第一中学2021-2022学年高二下学期期末考试试题新疆乌鲁木齐市第七十中学2021-2022学年高二下学期期中考试化学试题(已下线)第7讲 配合物与超分子
名校
解题方法
10 . 某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+、Na+、Cl-、CO32-、OH-和NO3-中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是______ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是______ ,有关的离子方程式______ 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有______ ,有关的离子方程式为______ 。
(4)综上所述,原溶液中一定存在的离子有______ ,可能存在的离子是______ 。
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有
(4)综上所述,原溶液中一定存在的离子有
您最近一年使用:0次
2019-10-18更新
|
1048次组卷
|
7卷引用:天津市宝坻区第一中学2023-2024学年高一上学期10月月考化学试题



