名校
解题方法
1 . 完成下列问题
(1)用“>”“<”或“=”填空:
①相同条件下,1mol S(s)与1molO2(g)的总能量_______ 1molSO2 (g)的能量。
②现有常温下甲、乙两种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,甲溶液中的c(OH—)_______ 乙溶液中的c(OH—),甲溶液中水电离出的c(OH—)_______ 乙溶液中水电离出的c(OH—)。
③现有常温下pH=1的盐酸溶液和醋酸溶液,均稀释1000倍后pH分别变为a和b,则a_______ b。
(2)在一定条件下,醋酸溶液中存在电离平衡: ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中
ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中 电离平衡向左移动的是
电离平衡向左移动的是_______ 。
a.加入少量0.10mol/L的稀盐酸 b.加热 c.加入醋酸钠固体 d.加入少量冰醋酸
(3)已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:HClO: ,
, :
: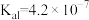 ,
,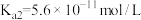 ;
; :
: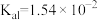 ,
,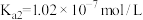 。则①HClO、②
。则①HClO、② 、③
、③ 、④
、④ 四种物质按酸性由强到弱排序(填序号)
四种物质按酸性由强到弱排序(填序号)_______ 。
(4)某温度下纯水中的c(H+)=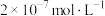 ,则此时溶液中的c(OH—)=
,则此时溶液中的c(OH—)=_______ ;若温度不变,滴入稀盐酸,使c(H+)= ,则此时溶液中由水电离产生的c(H+)=
,则此时溶液中由水电离产生的c(H+)=_______ 。
(5)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
① 爆炸:
爆炸: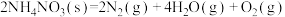
_______
②水煤气转化: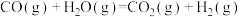
_______
③臭氧的生成: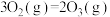
_______
A.熵增大 B.熵减小 C.熵变很小
(1)用“>”“<”或“=”填空:
①相同条件下,1mol S(s)与1molO2(g)的总能量
②现有常温下甲、乙两种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,甲溶液中的c(OH—)
③现有常温下pH=1的盐酸溶液和醋酸溶液,均稀释1000倍后pH分别变为a和b,则a
(2)在一定条件下,醋酸溶液中存在电离平衡:
 ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中
ΔH>0,下列方法中,可以使0.10mol/L醋酸溶液中 电离平衡向左移动的是
电离平衡向左移动的是a.加入少量0.10mol/L的稀盐酸 b.加热 c.加入醋酸钠固体 d.加入少量冰醋酸
(3)已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:HClO:
 ,
, :
: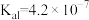 ,
,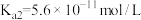 ;
; :
: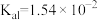 ,
,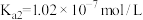 。则①HClO、②
。则①HClO、② 、③
、③ 、④
、④ 四种物质按酸性由强到弱排序(填序号)
四种物质按酸性由强到弱排序(填序号)(4)某温度下纯水中的c(H+)=
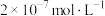 ,则此时溶液中的c(OH—)=
,则此时溶液中的c(OH—)= ,则此时溶液中由水电离产生的c(H+)=
,则此时溶液中由水电离产生的c(H+)=(5)估计下列各变化过程是熵增加还是熵减小。(用A、B、C填空)
①
 爆炸:
爆炸: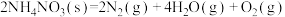
②水煤气转化:
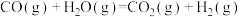
③臭氧的生成:
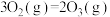
A.熵增大 B.熵减小 C.熵变很小
您最近一年使用:0次
名校
2 . 全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
Ⅰ.氮氧化物的研究
(1)一定条件下,将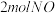 与
与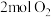 置于恒容密闭容器中发生反应:
置于恒容密闭容器中发生反应: ,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
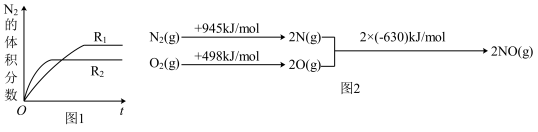
(2)已知反应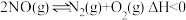 ,在不同条件时
,在不同条件时 的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线
的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线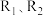 表示的是
表示的是_______ (填字旺序号)。
A.压强B.温度C.催化剂
根据图2中的能量变化数据,计算反应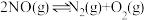 的
的
_______ 。
Ⅱ.碳氧化物研究
(3)图3甲为恒温恒容装置,乙为恒温恒压装置。已知CO和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: 。
。
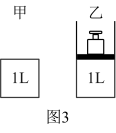
相同温度下,将 和
和 分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲
分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲_______ 乙(填“<”、“>”或“=”);若再向乙容器中通入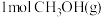 ,重新达到平衡后,
,重新达到平衡后, 在体系中的百分含量
在体系中的百分含量_______ (填“变大”或“变小”或“不变”)。
Ⅰ.氮氧化物的研究
(1)一定条件下,将
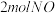 与
与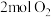 置于恒容密闭容器中发生反应:
置于恒容密闭容器中发生反应: ,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。| A.混合气体的密度保持不变 | B.NO的转化率保持不变 |
C.NO和 的物质的量之比保持不变 的物质的量之比保持不变 | D. 的消耗速率和 的消耗速率和 的消耗速率相等 的消耗速率相等 |
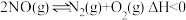 ,在不同条件时
,在不同条件时 的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线
的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线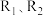 表示的是
表示的是A.压强B.温度C.催化剂
根据图2中的能量变化数据,计算反应
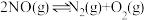 的
的

Ⅱ.碳氧化物研究
(3)图3甲为恒温恒容装置,乙为恒温恒压装置。已知CO和
 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: 。
。
相同温度下,将
 和
和 分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲
分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲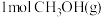 ,重新达到平衡后,
,重新达到平衡后, 在体系中的百分含量
在体系中的百分含量
您最近一年使用:0次
名校
3 . 苯达莫司汀(Bendamustine)是一种抗癌药物。苯达莫司汀的一种合成路线如下:
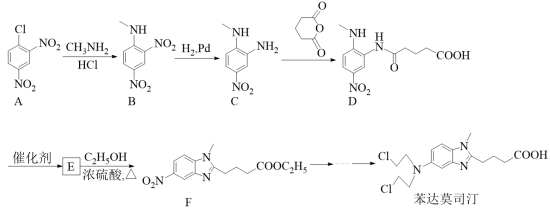
(1)A的分子式是_______ ,B→C的反应类型为_______ 。
(2)1molD物质在碱性条件下反应,最多消耗NaOH的物质的量为_______ 。F中含氧官能团的名称_______ 。
(3)E的结构简式为:_______ 。
(4)C→D的方程式为_______ 。
(5)下列关于上述流程中的物质说法正确的是_______ 。
a.A物质易溶于水
b.C物质的核磁共振氢谱有6组峰
c.在一定条件下,1mol苯达莫司汀与足量的氢气反应,最多能消耗5mol
d.一定条件下,F物质能够发生还原、加成、取代等类型的反应
(6)链状有机物G是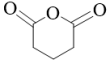 的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有
的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有_______ 种(不考虑立体异构)
(7)参照题干中的信息及已学知识请写出以甲苯和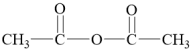 为原料,制
为原料,制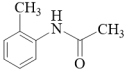 的合成路线流程图。
的合成路线流程图。_______

(1)A的分子式是
(2)1molD物质在碱性条件下反应,最多消耗NaOH的物质的量为
(3)E的结构简式为:
(4)C→D的方程式为
(5)下列关于上述流程中的物质说法正确的是
a.A物质易溶于水
b.C物质的核磁共振氢谱有6组峰
c.在一定条件下,1mol苯达莫司汀与足量的氢气反应,最多能消耗5mol

d.一定条件下,F物质能够发生还原、加成、取代等类型的反应
(6)链状有机物G是
 的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有
的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有(7)参照题干中的信息及已学知识请写出以甲苯和
 为原料,制
为原料,制 的合成路线流程图。
的合成路线流程图。
您最近一年使用:0次
2022-10-29更新
|
1121次组卷
|
3卷引用:天津市西青区杨柳青第一中学2022-2023学年高三上学期第一次适应性测试化学试题
天津市西青区杨柳青第一中学2022-2023学年高三上学期第一次适应性测试化学试题(已下线)2022年河北省高考真题变式题(14-18)天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题
4 . 铁及其化合物在生活、生产中有着重要作用。请按要求回答下列问题。
(1)基态Fe原子的简化电子排布式为____ 。
(2)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同。
①用____ 实验测定铁晶体,测得A、B两种晶胞,其晶胞结构如图:
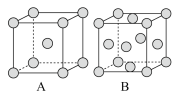
②A、B两种晶胞中含有的铁原子个数比为____ 。
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有____ 个。
(3)常温下,铁不易和水反应,而当撕开暖贴(内有透气的无纺布袋,袋内装有铁粉、活性炭、无机盐、水、吸水性树脂等)的密封外包装时,即可快速均匀发热。利用所学知识解释暖贴发热的原因:___ 。
(4)工业盐酸因含有[FeCl4]—而呈亮黄色,在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
①[FeCl4]—的中心离子是____ ,配体是____ ;其中的化学键称为____ 。
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有____ ,由此可知在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
(1)基态Fe原子的简化电子排布式为
(2)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同。
①用

②A、B两种晶胞中含有的铁原子个数比为
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有
(3)常温下,铁不易和水反应,而当撕开暖贴(内有透气的无纺布袋,袋内装有铁粉、活性炭、无机盐、水、吸水性树脂等)的密封外包装时,即可快速均匀发热。利用所学知识解释暖贴发热的原因:
(4)工业盐酸因含有[FeCl4]—而呈亮黄色,在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
①[FeCl4]—的中心离子是
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有
您最近一年使用:0次
2022-06-01更新
|
763次组卷
|
3卷引用:天津西青区2022-2023学年高三上学期期末考试化学试题
5 . 氢气作为清洁能源有着广泛的应用前景,请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30 ℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
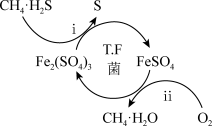
(1)过程ⅰ中H2S发生了_______ (填“氧化”或“还原”)反应。
(2)过程ⅱ的离子方程式是_______ 。
(3)已知:①Fe3+在pH为1.9时开始沉淀,3.2时沉淀完全。②30 ℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
请结合以上信息,判断工业脱硫应选择的最佳pH范围为_______ ,并说明原因:_______ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合图回答问题。
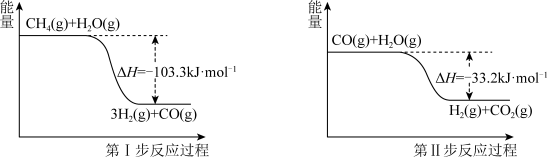
(4)写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:_______ 。
(5)第Ⅱ步为可逆反应。在800 ℃时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数为_______ 。
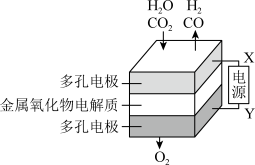
(6)在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO,基本原理如图所示,阴极的反应式是_______ 和CO2+2e—=CO+O2—。
Ⅰ.转化脱硫:将天然气压入吸收塔,30 ℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。

(1)过程ⅰ中H2S发生了
(2)过程ⅱ的离子方程式是
(3)已知:①Fe3+在pH为1.9时开始沉淀,3.2时沉淀完全。②30 ℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
| pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
| Fe2+氧化速率/(g·L-1·h-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合图回答问题。

(4)写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:
(5)第Ⅱ步为可逆反应。在800 ℃时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数为
(6)在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO,基本原理如图所示,阴极的反应式是

您最近一年使用:0次
名校
6 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组在实验室制备(NH4)2Fe(SO4)2·6H2O,探究其分解产物,并定量测定样品的质量分数。
Ⅰ.按以下流程制备硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]:

(1)铁屑溶于稀硫酸过程中,适当加热的目的是_______ 。
(2)流程中,需将滤液转移到_______ (填写仪器名称)中,迅速加入饱和硫酸铵溶液,经_______ 、_______ 操作,再过滤、洗涤、干燥得到硫酸亚铁铵晶体。
Ⅱ.查阅资料可知硫酸亚铁铵晶体加热主要发生反应:_______(NH4)2Fe(SO4)2 _______Fe2O3+_______SO2↑+_______NH3↑+_______N2↑+_______H2O,但伴有副反应发生,生成少量SO3和O2。设计以下实验探究分解的产物:
_______Fe2O3+_______SO2↑+_______NH3↑+_______N2↑+_______H2O,但伴有副反应发生,生成少量SO3和O2。设计以下实验探究分解的产物:
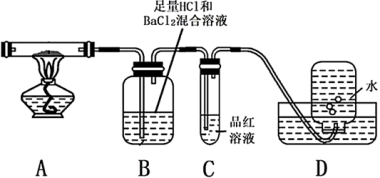
(3)配平上述分解反应的化学方程式_______ 。
(4)加热过程,A中固体逐渐变为_______ 色。待晶体完全分解后,为验证A中残留物是否含有FeO,需选用的试剂有_______ (填字母)。
A.KSCN溶液 B.稀硫酸 C.新制氯水 D.铁氰化钾溶液
(5)B中有白色沉淀生成,写出生成该白色沉淀的离子方程式:_______ 。
(6)C的作用是_______ 。
Ⅲ.为测定某硫酸亚铁铵晶体样品的质量分数,先称取样品1.600 g,加水溶解,配成100 mL溶液,移取25.00 mL待测溶液于锥形瓶中,再用硫酸酸化的0.010 0 mol/L KMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00 mL。
(7)样品中硫酸亚铁铵晶体的质量分数为_______ 。(已知硫酸亚铁铵晶体的摩尔质量为392 g/mol)
Ⅰ.按以下流程制备硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]:

(1)铁屑溶于稀硫酸过程中,适当加热的目的是
(2)流程中,需将滤液转移到
Ⅱ.查阅资料可知硫酸亚铁铵晶体加热主要发生反应:_______(NH4)2Fe(SO4)2
 _______Fe2O3+_______SO2↑+_______NH3↑+_______N2↑+_______H2O,但伴有副反应发生,生成少量SO3和O2。设计以下实验探究分解的产物:
_______Fe2O3+_______SO2↑+_______NH3↑+_______N2↑+_______H2O,但伴有副反应发生,生成少量SO3和O2。设计以下实验探究分解的产物:
(3)配平上述分解反应的化学方程式
(4)加热过程,A中固体逐渐变为
A.KSCN溶液 B.稀硫酸 C.新制氯水 D.铁氰化钾溶液
(5)B中有白色沉淀生成,写出生成该白色沉淀的离子方程式:
(6)C的作用是
Ⅲ.为测定某硫酸亚铁铵晶体样品的质量分数,先称取样品1.600 g,加水溶解,配成100 mL溶液,移取25.00 mL待测溶液于锥形瓶中,再用硫酸酸化的0.010 0 mol/L KMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00 mL。
(7)样品中硫酸亚铁铵晶体的质量分数为
您最近一年使用:0次
名校
7 . 有机物J用于治疗心血管、高血压。以A为起始原料制备J合成路线如下:
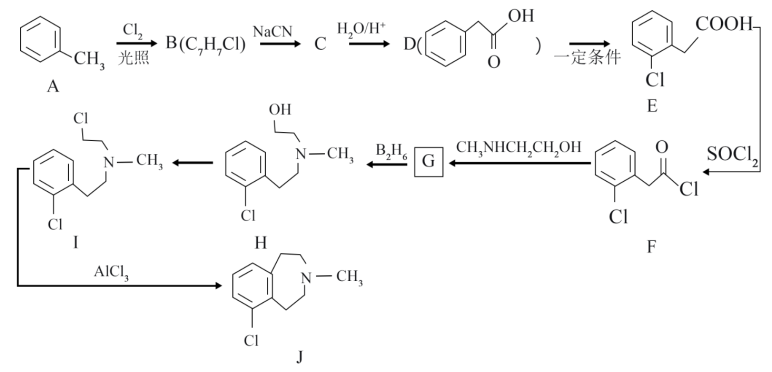
已知:(i)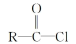 +R1—NH—R2→
+R1—NH—R2→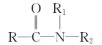
(ii)RX+NaCN→RCN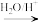 RCOOH
RCOOH
回答下列问题:
(1)E的官能团名称为_______ ,D的化学名称是_______ ,反应I→J的反应类型是_______ 。
(2)H的分子式为_______ ,反应D→E的试剂为_______ 。
(3)写出E与足量氢气反应生成产物的结构简式,并用*标出其中的手性碳_______ 。
(4)反应F→G化学方程式是_______ 。
(5)X与F是同分异构体,写出符合下列条件的所有同分异构体的结构简式:_______ 。
①能使FeCl3溶液显色
②苯环上有两个取代基且苯环上一氯代物只有两种
(6)已知苯的同系物能被酸性高锰酸钾溶液氧化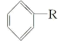

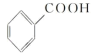 参照题中合成路线,在方框中设计以甲苯和二甲胺(CH3NHCH3)为原料合成
参照题中合成路线,在方框中设计以甲苯和二甲胺(CH3NHCH3)为原料合成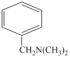 的路线
的路线_______ 。

已知:(i)
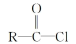 +R1—NH—R2→
+R1—NH—R2→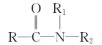
(ii)RX+NaCN→RCN
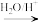 RCOOH
RCOOH回答下列问题:
(1)E的官能团名称为
(2)H的分子式为
(3)写出E与足量氢气反应生成产物的结构简式,并用*标出其中的手性碳
(4)反应F→G化学方程式是
(5)X与F是同分异构体,写出符合下列条件的所有同分异构体的结构简式:
①能使FeCl3溶液显色
②苯环上有两个取代基且苯环上一氯代物只有两种
(6)已知苯的同系物能被酸性高锰酸钾溶液氧化


 参照题中合成路线,在方框中设计以甲苯和二甲胺(CH3NHCH3)为原料合成
参照题中合成路线,在方框中设计以甲苯和二甲胺(CH3NHCH3)为原料合成 的路线
的路线
您最近一年使用:0次
2022-03-14更新
|
482次组卷
|
3卷引用:天津市西青区杨柳青第一中学2020-2021学年高三下学期模拟考试化学试题
天津市西青区杨柳青第一中学2020-2021学年高三下学期模拟考试化学试题(已下线)三轮冲刺卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)湖南省岳阳市华容县普通高中2023届高三新高考适应性考试化学试题
名校
解题方法
8 . 常温下,向100 mL 0.01 mol/L HA的溶液中逐滴加入0.02 mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
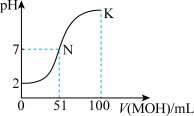
| A.HA为一元弱酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 减小 减小 |
| D.K点对应的溶液中有c(MOH)+c(OH-)-c(H+)=0.005 mol/L |
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的ⅥB族,F的基态原子中有4个未成对电子。
(1)A元素单质的结构式为_______ ;基态E元素原子价层电子排布图为_______ 。
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是_______ ;A与B形成的A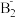 的立体构型为
的立体构型为_______ 。
(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:_______ 。
(4)写出酸性条件下,E元素的离子E2 和D元素的阴离子反应的离子方程式:
和D元素的阴离子反应的离子方程式:_______ 。
(5)基态F3+未成对电子数为_______ 个;F3+与SCN—络合得到多种配合物,其中配位数为5的配合物的阴离子为_______ (填化学式)。
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为_______ g·cm-3。

(1)A元素单质的结构式为
(2)在A的氢化物A2H4分子中,A原子轨道的杂化类型是
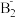 的立体构型为
的立体构型为(3)火箭推动剂由A2H4和H2B2组成,加热反应时有A元素的单质生成,写出该化学反应方程式:
(4)写出酸性条件下,E元素的离子E2
 和D元素的阴离子反应的离子方程式:
和D元素的阴离子反应的离子方程式:(5)基态F3+未成对电子数为
(6)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数为a pm,NA为阿伏加德罗常数的值,则该晶胞的密度为

您最近一年使用:0次
名校
解题方法
10 . 临床试验表明,磷酸氯喹( )对治疗新冠肺炎具有一定疗效。氯喹(J)是制备磷酸氯喹的重要中间产物,其合成路线如图所示:
)对治疗新冠肺炎具有一定疗效。氯喹(J)是制备磷酸氯喹的重要中间产物,其合成路线如图所示:
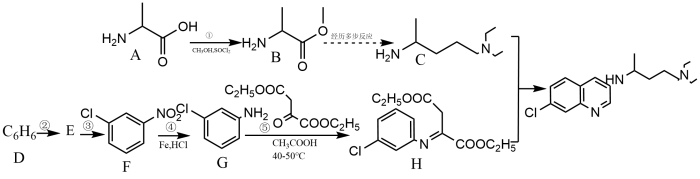
回答下列问题:
(1)A的化学名称为____ ,C的核磁共振氢谱有____ 组峰。
(2)反应④的反应类型为____ 。
(3)I的分子式为_____ ,H中含氧官能团名称为____ 。
(4)写出一定条件下反应⑥的化学方程式____ 。
(5)L是B的同分异构体,与A互为同系物的结构有____ 种,其中核磁共振氢谱有三组峰,且峰面积比为6:2:1的结构简式为____ 。
(6)根据已有知识并结合题中相关信息,设计由苯和丙酮为原料制备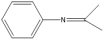 的合成路线
的合成路线____ (和合成路线流程图示例参考本题题干)。
 )对治疗新冠肺炎具有一定疗效。氯喹(J)是制备磷酸氯喹的重要中间产物,其合成路线如图所示:
)对治疗新冠肺炎具有一定疗效。氯喹(J)是制备磷酸氯喹的重要中间产物,其合成路线如图所示:
回答下列问题:
(1)A的化学名称为
(2)反应④的反应类型为
(3)I的分子式为
(4)写出一定条件下反应⑥的化学方程式
(5)L是B的同分异构体,与A互为同系物的结构有
(6)根据已有知识并结合题中相关信息,设计由苯和丙酮为原料制备
 的合成路线
的合成路线
您最近一年使用:0次



