名校
1 . I、常温下,有浓度均为 的下列4种溶液:
的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(1)这4种溶液pH由大到小的顺序是______ (填序号)
(2)若分别向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_____ ④(填“>”“<”或“=”)。
(3)向NaCN溶液中通入少量 ,则发生反应的离子方程式为
,则发生反应的离子方程式为______ 。
(4)泡沫灭火器中通常装有 溶液和
溶液和 溶液,请写出这两种溶液混合时反应的离子方程式:
溶液,请写出这两种溶液混合时反应的离子方程式:______ 。
(5)已知25℃时, 第一步水解的平衡常数
第一步水解的平衡常数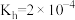 ,当溶液中
,当溶液中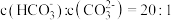 时,溶液的pH=
时,溶液的pH=________ 。
II、某同学用酸性 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:请回答下列问题:
含量:请回答下列问题:
反应原理为: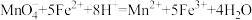 (
( 在溶液中为无色)
在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L 溶液滴定至终点
溶液滴定至终点
(6)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_________ mL。

(7)此滴定实验达到终点的颜色变化为______ 。
(8)重复滴定4次,每次消耗酸性 标准溶液的体积如表所示:
标准溶液的体积如表所示:
计算上述样品中 的质量分数为
的质量分数为______ 。( ,
,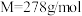 ,小数点后保留一位)
,小数点后保留一位)
(9)若滴定前平视读数,滴定终点时仰视读数,则所测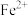 含量:
含量:______ 。(填“无影响”、“偏高”或“偏低”)。
 的下列4种溶液:
的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③
 溶液 ④
溶液 ④ 溶液
溶液| HCN |  |  |
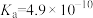 | 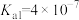 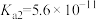 | 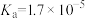 |
(2)若分别向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(3)向NaCN溶液中通入少量
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为(4)泡沫灭火器中通常装有
 溶液和
溶液和 溶液,请写出这两种溶液混合时反应的离子方程式:
溶液,请写出这两种溶液混合时反应的离子方程式:(5)已知25℃时,
 第一步水解的平衡常数
第一步水解的平衡常数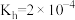 ,当溶液中
,当溶液中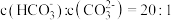 时,溶液的pH=
时,溶液的pH=II、某同学用酸性
 溶液测定绿矾产品中
溶液测定绿矾产品中 含量:请回答下列问题:
含量:请回答下列问题:反应原理为:
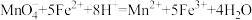 (
( 在溶液中为无色)
在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L
 溶液滴定至终点
溶液滴定至终点(6)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为

(7)此滴定实验达到终点的颜色变化为
(8)重复滴定4次,每次消耗酸性
 标准溶液的体积如表所示:
标准溶液的体积如表所示:| 第一次 | 第二次 | 第三次 | 第四次 | |
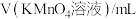 | 17.10 | 19.98 | 20.00 | 20.02 |
 的质量分数为
的质量分数为 ,
,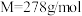 ,小数点后保留一位)
,小数点后保留一位)(9)若滴定前平视读数,滴定终点时仰视读数,则所测
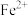 含量:
含量:
您最近一年使用:0次
名校
2 . 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
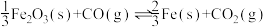
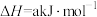
I、已知:①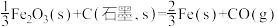
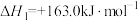
②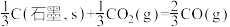
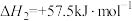
(1)
______
II、该反应在不同温度下的平衡常数如下。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、 、CO和
、CO和 各1.0mol,此时
各1.0mol,此时
______  (填>、<或=);反应经过10min后达到平衡,该时间范围内反应的平均反应速率
(填>、<或=);反应经过10min后达到平衡,该时间范围内反应的平均反应速率
______ 。
(3)下列叙述中能表示该反应达到平衡状态的是_____
(4)欲提高高炉中CO的平衡转化率,可采取的措施是_____
III、已知化学反应:
①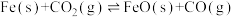

②

③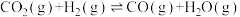
三个反应的平衡常数分别为K1、K2和K3。
(5)
______ 0(填“>”或“<”)。
(6)根据反应 ①和反应 ②可推导出K1、K2和K3的关系式:______ 。
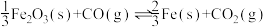
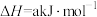
I、已知:①
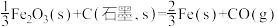
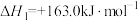
②
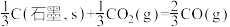
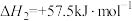
(1)

II、该反应在不同温度下的平衡常数如下。
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
 、CO和
、CO和 各1.0mol,此时
各1.0mol,此时
 (填>、<或=);反应经过10min后达到平衡,该时间范围内反应的平均反应速率
(填>、<或=);反应经过10min后达到平衡,该时间范围内反应的平均反应速率
(3)下列叙述中能表示该反应达到平衡状态的是_____
A.单位时间内消耗nmolCO的同时生成nmol | B.容器中气体压强不再变化 |
| C.容器中气体物质的量不再变化 | D.混合气体的密度不再变化 |
| A.减少Fe的量 | B.增加 的量 的量 | C.移出部分 | D.加入合适的催化剂 |
III、已知化学反应:
①
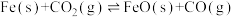

②


③
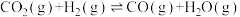
三个反应的平衡常数分别为K1、K2和K3。
(5)

(6)根据反应 ①和反应 ②可推导出K1、K2和K3的关系式:
您最近一年使用:0次
名校
3 . 苯达莫司汀(Bendamustine)是一种抗癌药物。苯达莫司汀的一种合成路线如下:
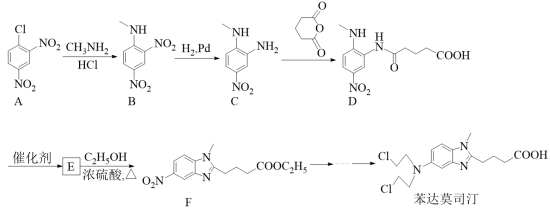
(1)A的分子式是_______ ,B→C的反应类型为_______ 。
(2)1molD物质在碱性条件下反应,最多消耗NaOH的物质的量为_______ 。F中含氧官能团的名称_______ 。
(3)E的结构简式为:_______ 。
(4)C→D的方程式为_______ 。
(5)下列关于上述流程中的物质说法正确的是_______ 。
a.A物质易溶于水
b.C物质的核磁共振氢谱有6组峰
c.在一定条件下,1mol苯达莫司汀与足量的氢气反应,最多能消耗5mol
d.一定条件下,F物质能够发生还原、加成、取代等类型的反应
(6)链状有机物G是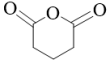 的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有
的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有_______ 种(不考虑立体异构)
(7)参照题干中的信息及已学知识请写出以甲苯和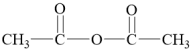 为原料,制
为原料,制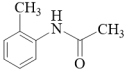 的合成路线流程图。
的合成路线流程图。_______

(1)A的分子式是
(2)1molD物质在碱性条件下反应,最多消耗NaOH的物质的量为
(3)E的结构简式为:
(4)C→D的方程式为
(5)下列关于上述流程中的物质说法正确的是
a.A物质易溶于水
b.C物质的核磁共振氢谱有6组峰
c.在一定条件下,1mol苯达莫司汀与足量的氢气反应,最多能消耗5mol

d.一定条件下,F物质能够发生还原、加成、取代等类型的反应
(6)链状有机物G是
 的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有
的同分异构体,并且G能发生水解反应,1molG发生银镜反应后生成4mol单质Ag,符合上述条件的G的结构有(7)参照题干中的信息及已学知识请写出以甲苯和
 为原料,制
为原料,制 的合成路线流程图。
的合成路线流程图。
您最近一年使用:0次
2022-10-29更新
|
1124次组卷
|
3卷引用:天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题
天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题天津市西青区杨柳青第一中学2022-2023学年高三上学期第一次适应性测试化学试题(已下线)2022年河北省高考真题变式题(14-18)
名校
4 . 化合物H是一种合成药物中间体,一种合成化合物H的人工合成路线如下:

(1)B的化学名称为___________ ,G中不含N原子的官能团的名称为___________ ,H的分子式为___________ 。
(2) 的过程经历两步反应。反应类型依次为加成反应、
的过程经历两步反应。反应类型依次为加成反应、___________ 。
(3) 的化学方程式为
的化学方程式为___________ 。
(4) 的所需的化学试剂及反应条件为
的所需的化学试剂及反应条件为___________ 。
(5)F与足量稀盐酸反应,所得生成物的结构简式为___________ 。
(6)E满足下列条件的同分异构体有___________ 种。
①苯环上有两个对位的取代基,其中一个取代基为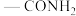
②能使溴水褪色
写出其中分子含有5种不同化学环境的氢原子的结构简式:___________ 。
(7)写出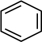 和2-丙醇(
和2-丙醇(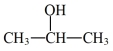 )为原料制备
)为原料制备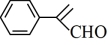 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)___________

(1)B的化学名称为
(2)
 的过程经历两步反应。反应类型依次为加成反应、
的过程经历两步反应。反应类型依次为加成反应、(3)
 的化学方程式为
的化学方程式为(4)
 的所需的化学试剂及反应条件为
的所需的化学试剂及反应条件为(5)F与足量稀盐酸反应,所得生成物的结构简式为
(6)E满足下列条件的同分异构体有
①苯环上有两个对位的取代基,其中一个取代基为
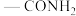
②能使溴水褪色
写出其中分子含有5种不同化学环境的氢原子的结构简式:
(7)写出
 和2-丙醇(
和2-丙醇( )为原料制备
)为原料制备 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
2022-05-30更新
|
352次组卷
|
2卷引用:天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题
名校
解题方法
5 . d区金属元素钛有“太空金属”“未来金属”等美誉,在航空航天、海洋产业等行业有重要作用。请回答下列问题:
(1)我国科学家用 和
和 ,制备超导材料
,制备超导材料 ,反应原理为
,反应原理为 。
。
①钛元素在元素周期表中的位置___________ ,基态钛原子的核外最高能层所含电子数___________ 。
②已知部分物质的熔沸点如下表。
 属于
属于___________ 晶体,应用所学知识解释 的熔点大于
的熔点大于 的原因
的原因___________ 。
③写出惰性电极电解 得到单质
得到单质 的化学方程式
的化学方程式___________ 。
(2) 是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为
是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为 ,但只有甲的水解产物能与草酸(
,但只有甲的水解产物能与草酸( )反应生成
)反应生成 。
。
①根据相似相溶的规律,可推断___________ (填“甲”或“乙”)在水中的溶解度较大。
② 发生水解反应的化学方程式是
发生水解反应的化学方程式是___________ 。
③ 中
中 的键角大于
的键角大于 分子中的
分子中的 键角,请结合所学知识解释原因
键角,请结合所学知识解释原因___________ 。
④查阅资料可知,甲、乙均为平面结构,画出乙的水解产物的空间结构___________ 。
(1)我国科学家用
 和
和 ,制备超导材料
,制备超导材料 ,反应原理为
,反应原理为 。
。①钛元素在元素周期表中的位置
②已知部分物质的熔沸点如下表。
 |  |  |  | |
熔点/ | 800(分解) | -25 | 714 | 2950 |
沸点/ | 700(升华) | 136.4 | 1412 | (略) |
 属于
属于 的熔点大于
的熔点大于 的原因
的原因③写出惰性电极电解
 得到单质
得到单质 的化学方程式
的化学方程式(2)
 是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为
是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为 ,但只有甲的水解产物能与草酸(
,但只有甲的水解产物能与草酸( )反应生成
)反应生成 。
。①根据相似相溶的规律,可推断
②
 发生水解反应的化学方程式是
发生水解反应的化学方程式是③
 中
中 的键角大于
的键角大于 分子中的
分子中的 键角,请结合所学知识解释原因
键角,请结合所学知识解释原因④查阅资料可知,甲、乙均为平面结构,画出乙的水解产物的空间结构
您最近一年使用:0次
2022-05-30更新
|
787次组卷
|
6卷引用:天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题
天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题(已下线)2022年江苏卷高考真题变式题14-17(已下线)2022年北京高考真题变式题1-14(已下线)化学(天津A卷)-学易金卷:2023年高考第一次模拟考试卷天津市区重点中学2023届高三毕业班联考(一)化学试题(已下线)2022年北京高考真题化学试题变式题(结构与性质)
名校
6 . 25℃时,用HCl气体调节 氨水的pH,溶液的pH与反应物的物质的量之比[
氨水的pH,溶液的pH与反应物的物质的量之比[ ]关系如图所示。若已知P1所示溶液中
]关系如图所示。若已知P1所示溶液中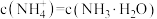 ,且忽略通入气体后溶液体积的变化,下列有关说法正确的是
,且忽略通入气体后溶液体积的变化,下列有关说法正确的是

 氨水的pH,溶液的pH与反应物的物质的量之比[
氨水的pH,溶液的pH与反应物的物质的量之比[ ]关系如图所示。若已知P1所示溶液中
]关系如图所示。若已知P1所示溶液中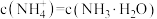 ,且忽略通入气体后溶液体积的变化,下列有关说法正确的是
,且忽略通入气体后溶液体积的变化,下列有关说法正确的是
A.P1所示溶液: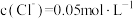 |
B.P2所示溶液: |
C.P3所示溶液: mol/L mol/L |
D.25℃时, 的电离平衡常数为 的电离平衡常数为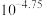 |
您最近一年使用:0次
2022-05-16更新
|
351次组卷
|
2卷引用:天津市咸水沽第一中学2022-2023学年高三上学期线上期末考试化学试题
2022高三·全国·专题练习
名校
解题方法
7 . 苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶。工业以乙苯为原料,通过如下反应I或反应II制取苯乙烯。回答下列问题:
(1)工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应I:C6H5-CH2CH3(g) C6H5-CH=CH2(g)+H2(g) ΔH1
C6H5-CH=CH2(g)+H2(g) ΔH1
①近期科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图所示(吸附在催化剂表面的物种用*标注):_______ ,该反应历程的决速步骤反应方程式为_______ 。
②在高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化剂“中毒”。因此在原料气中通入水蒸气的目的是_______ 。
③在温度为550℃,总压恒定为3p的密闭容器中通入体积比为2∶1的乙苯(g)和H2O(g)混合气体发生反应,达到平衡时乙苯的转化率为α,计算反应的压强平衡常数Kp=_______ 。
④乙苯脱氢制苯乙烯的反应往往伴随着副反应,生成苯、甲苯和聚苯乙烯等。在一定温度和压强下,为了提高苯乙烯的选择性,应当_______ 。
(2)工业上利用CO2氧化乙苯制苯乙烯,其原理为:反应II:C6H5-CH2CH3(g)+CO2 C6H5-CH=CH2(g)+CO+H2O(g) ΔH2=158.7kJ/mol。
C6H5-CH=CH2(g)+CO+H2O(g) ΔH2=158.7kJ/mol。
①相同反应条件下,采用CO2替代水蒸气进行乙苯脱氢反应,苯乙烯生产能耗有效降低,而且乙苯转化率也明显提高。请利用平衡原理分析乙苯转化率提高的原因。_______ 。
②在常压下,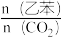 分别为a、b、c时,乙苯平衡转化率随温度变化的关系如图所示:
分别为a、b、c时,乙苯平衡转化率随温度变化的关系如图所示:_______ 。
(1)工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应I:C6H5-CH2CH3(g)
 C6H5-CH=CH2(g)+H2(g) ΔH1
C6H5-CH=CH2(g)+H2(g) ΔH1①近期科技工作者结合实验与计算机模拟结果,研究了一个乙苯分子在催化剂表面脱氢制苯乙烯的反应,其历程如图所示(吸附在催化剂表面的物种用*标注):

②在高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化剂“中毒”。因此在原料气中通入水蒸气的目的是
③在温度为550℃,总压恒定为3p的密闭容器中通入体积比为2∶1的乙苯(g)和H2O(g)混合气体发生反应,达到平衡时乙苯的转化率为α,计算反应的压强平衡常数Kp=
④乙苯脱氢制苯乙烯的反应往往伴随着副反应,生成苯、甲苯和聚苯乙烯等。在一定温度和压强下,为了提高苯乙烯的选择性,应当
(2)工业上利用CO2氧化乙苯制苯乙烯,其原理为:反应II:C6H5-CH2CH3(g)+CO2
 C6H5-CH=CH2(g)+CO+H2O(g) ΔH2=158.7kJ/mol。
C6H5-CH=CH2(g)+CO+H2O(g) ΔH2=158.7kJ/mol。①相同反应条件下,采用CO2替代水蒸气进行乙苯脱氢反应,苯乙烯生产能耗有效降低,而且乙苯转化率也明显提高。请利用平衡原理分析乙苯转化率提高的原因。
②在常压下,
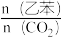 分别为a、b、c时,乙苯平衡转化率随温度变化的关系如图所示:
分别为a、b、c时,乙苯平衡转化率随温度变化的关系如图所示:
您最近一年使用:0次
2022-05-08更新
|
908次组卷
|
8卷引用:天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题
天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)湖北省圆创联考2021-2022学年高三下学期第二次联合测评化学试题(已下线)T28-原理综合题(已下线)T28-原理综合题(已下线)2023年湖南卷高考真题变式题(原理综合题)湖南省岳阳市岳阳县第一中学2023-2024学年高三下学期3月月考化学试题湖南省岳阳市汨罗市第一中学2023-2024学年高三下学期5月月考化学试题
8 . 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
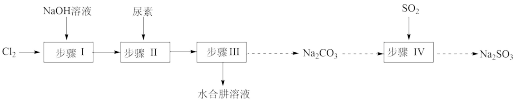
已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________ ;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________ ;使用冷凝管的目的是_________________________________ 。

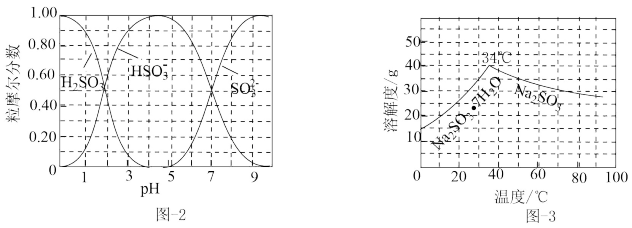
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、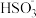 、
、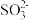 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________ 。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_______________________ ,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、
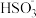 、
、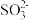 随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
您最近一年使用:0次
2018-06-10更新
|
6332次组卷
|
17卷引用:天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题
天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题河南省许昌高级中学2020届高三上学期第一次月考化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)河北省石家庄市行唐县三中2020届高三11月月考化学试题甘肃省武威第六中学2020届高三上学期第五次过关考试化学试题2020届高三化学选修4二轮专题练——酸碱中和滴定的曲线分析【精编25题】专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)【一飞冲天】名家原创卷1天津西青区2022-2023学年高三上学期期末考试化学试题江苏省南通市通州区金沙中学2022-2023学年高一下学期6月质量监测化学试题
名校
解题方法
9 . 在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
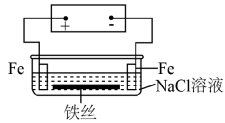

| A.原理图可理解为两个串联电解装置 |
| B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 |
| C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+ |
| D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) |
您最近一年使用:0次
2016-12-09更新
|
880次组卷
|
8卷引用:2015届天津市津南区高三4月模拟练习理科综合化学试卷
10 . 下列有关说法正确的是
A.已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3— I2+I— I2+I— |
| B.物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
您最近一年使用:0次
2016-12-09更新
|
362次组卷
|
2卷引用:2015届天津市津南区高三4月模拟练习理科综合化学试卷



