1 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
(1)将 1 mol TiCl3·4H2O 溶于水,加入足量 AgNO3 溶液,得到 1 mol AgCl 沉淀,已知Ti3+的配位数为6,TiCl3·4H2O的化学式用配合物的形式表示为___ 。
(2)有下列实验:___ 。深蓝色晶体的化学式为___ 。
②写出蓝色沉淀溶解成深蓝色溶液的离子方程式___ 。
③[Cu(NH3)4]2+中H−N−H键角比NH3分子中H−N−H键角___ (填“大”或“小”)。[Cu(NH3)4]SO4中存在的化学键类型有___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键
④物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是___ (填标号)。
A.[Cr(OH)4] − B.[Cu(CN)4]3− C.[ZnCl4]2− D.[Fe(CN)6]4−
画出[Cu(CN)4]2−的结构:___ (用“→”或“—”将配位键表示出来)。
(1)将 1 mol TiCl3·4H2O 溶于水,加入足量 AgNO3 溶液,得到 1 mol AgCl 沉淀,已知Ti3+的配位数为6,TiCl3·4H2O的化学式用配合物的形式表示为
(2)有下列实验:

②写出蓝色沉淀溶解成深蓝色溶液的离子方程式
③[Cu(NH3)4]2+中H−N−H键角比NH3分子中H−N−H键角
A.离子键 B.共价键 C.氢键 D.配位键
④物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是
A.[Cr(OH)4] − B.[Cu(CN)4]3− C.[ZnCl4]2− D.[Fe(CN)6]4−
画出[Cu(CN)4]2−的结构:
您最近一年使用:0次
名校
解题方法
2 . 已知P4单质的结构如下,P4在KOH溶液中的变化是:P4+3KOH+3H2O=3KH2PO2+PH3下列说法正确的是
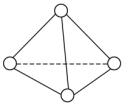
| A.31gP4含有1.5NA个P−P键 | B.产物PH3分子中所有的原子可能共平面 |
| C.P4中P原子为sp2杂化 | D.相关元素的电负性大小顺序:P>O>H>K |
您最近一年使用:0次
名校
解题方法
3 . 完成下列问题:
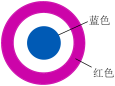
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生___________ 腐蚀,边缘区的电极反应式为___________ 。
(2)区分晶体和非晶体最可靠的方法是___________ 。
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为___________ 。
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是___________ (填“正极”或“负极”),该电池的负极的电极反应式为___________

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为___________ 。
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
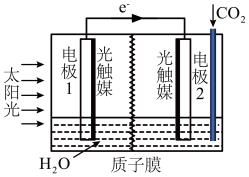
①电极2的电极反应式是___________ 。
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化___________ g。
(学法题)书写电极反应式时应注意哪些问题___________ 。
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生

(2)区分晶体和非晶体最可靠的方法是
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化
(学法题)书写电极反应式时应注意哪些问题
您最近一年使用:0次
名校
解题方法
4 . 有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
名校
解题方法
5 . 常温下,下列有关电解质溶液的叙述正确的是
A.0.1mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中: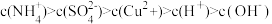 |
B.在 溶液中 溶液中 |
C.0.1mol/LNa2CO3溶液中: |
D.0.1mol·L-1的NaHA溶液,其pH=4: |
您最近一年使用:0次
名校
6 . 下列叙述正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1 |
| C.将10mL0.0lmol/LNaOH溶液与同浓度的HA溶液混合,若混合后溶液呈中性,则消耗的HA的体积V≥10mL |
| D.由水电离出来的H+的浓度为1.0×10-10mol·L-1,则原溶液的pH一定为4 |
您最近一年使用:0次
名校
解题方法
7 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ·mol-1
H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
Ⅱ.脱碳:
(2)向2 L密闭容器中加入1mol CO2和3 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH<0
CH3OH(l)+H2O(l) ΔH<0
①该反应自发进行的条件是___________ (填“低温”“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是___________ (填字母)。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H-H键断裂
f. CO2和H2的物质的量之比保持不变 g. v正(CO2) = 3v逆(H2)
(3)工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
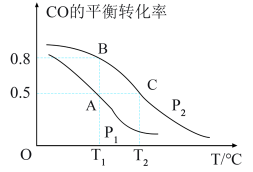
①p1、p2的大小关系是p1___________ p2(填“>”“<"或"=”)。
②A、B、C三点的平衡常数KA、KB、Kc的大小关系是___________ 。
(4)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。
①平衡时H2的体积分数是___________ ;平衡后再加入1.0molCO后重新到达平衡,则CO的转化率___________ (填“增大""不变”成“减小”),CO与CH3OH的浓度比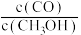
___________ (填"增大”“不变"或“减小")。
②若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___________ v(逆)(填“”“<"或“=”)。
③若p2压强恒定为p,则平衡常数Kp=___________ (Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH=+133 kJ·mol-1
H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
(1)催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
Ⅱ.脱碳:
(2)向2 L密闭容器中加入1mol CO2和3 mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ΔH<0
CH3OH(l)+H2O(l) ΔH<0①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H-H键断裂
f. CO2和H2的物质的量之比保持不变 g. v正(CO2) = 3v逆(H2)
(3)工业上使用水煤气(CO与H2的混合气体)转化成甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。CO的平衡转化率与温度、压强的关系如图所示。
①p1、p2的大小关系是p1
②A、B、C三点的平衡常数KA、KB、Kc的大小关系是
(4)在T2℃、p2压强时,往一容积为2L的密闭容器内,充入0.3molCO与0.4molH2发生反应。
①平衡时H2的体积分数是
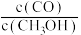
②若以不同比例投料,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
③若p2压强恒定为p,则平衡常数Kp=
您最近一年使用:0次
名校
8 . Ⅰ.硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________ ,最高能级电子所在的原子轨道为___________ 形。
(2)①硫单质的一种结构为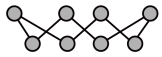 ,S原子杂化方式为
,S原子杂化方式为___________ ; 分子的空间构型是
分子的空间构型是___________ 。
② 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是___________ 。
③比较沸点高低: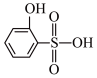
___________ (填“>”或“<”)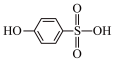 。
。
(3)Fe位于周期表的___________ 区,基态Fe原子的核外电子有___________ 种空间运动状态,Fe与CO形成的化合物Fe(CO)5常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于___________ (填晶体类型)。
(4)ZnS晶胞如图所示:
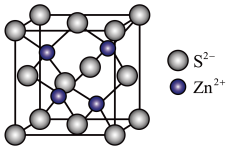
①由图可知,每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有___________ 个。
②已知该晶胞密度为 ,阿伏加德罗常数为NA,则晶胞边长为
,阿伏加德罗常数为NA,则晶胞边长为___________ pm。
(学法题)根据所学知识分析归纳,计算晶体密度的关键是___________
(5)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式___________ ;
②若向该深蓝色透明溶液中加入溶剂___________ ,将有深蓝色晶体析出,写出该晶体的化学式___________ 。
(1)基态硫原子的价层电子排布图是
(2)①硫单质的一种结构为
 ,S原子杂化方式为
,S原子杂化方式为 分子的空间构型是
分子的空间构型是②
 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是③比较沸点高低:

 。
。(3)Fe位于周期表的
(4)ZnS晶胞如图所示:

①由图可知,每个
 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有②已知该晶胞密度为
 ,阿伏加德罗常数为NA,则晶胞边长为
,阿伏加德罗常数为NA,则晶胞边长为(学法题)根据所学知识分析归纳,计算晶体密度的关键是
(5)早在西汉时期的《淮南万毕术》中记载“曾青得铁则化为铜”,这是有关“湿法炼铜”最早文献记录。若向盛有硫酸铜的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。
①写出蓝色沉淀溶解的离子方程式
②若向该深蓝色透明溶液中加入溶剂
您最近一年使用:0次
11-12高一上·江苏无锡·期中
名校
解题方法
9 . 某溶液中可能含有下列6种离子中的某几种:Cl-、 、
、 、
、 、Na+、K+,为确认溶液组成进行如下实验:
、Na+、K+,为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出),由此可以得出关于原溶液组成的正确结论是
 、
、 、
、 、Na+、K+,为确认溶液组成进行如下实验:
、Na+、K+,为确认溶液组成进行如下实验:(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出),由此可以得出关于原溶液组成的正确结论是
A.一定存在 、 、 、 、 ,可能存在Cl-、Na+、K+ ,可能存在Cl-、Na+、K+ |
B.一定存在 、 、 、 、 、Cl-,一定不存在Na+、K+ 、Cl-,一定不存在Na+、K+ |
C.c( )=0.01mol/L,c( )=0.01mol/L,c( )>c( )>c( ) ) |
D.如果上述6种离子都存在,则c(Cl-)>c( ) ) |
您最近一年使用:0次
2023-12-02更新
|
848次组卷
|
33卷引用:天津市静海区第一中学2021届高三12月考化学试题
天津市静海区第一中学2021届高三12月考化学试题(已下线)2011-2012学年江苏省无锡一中高一上学期期中考试化学试卷(已下线)2011-2012年浙江宁波万里国际中学高三第一学期期中考试化学试卷(已下线)2013-2014学年江苏南京市建邺高级中学高一上学期期中考试化学试卷(已下线)2014~2015江苏省响水中学高一上学期期中化学试卷2016届江西省上高县第二中学高三上学期第二次月考化学试卷2016届河北省衡水中学高三上学期四调考试化学试卷2015-2016学年江苏省启东中学高二上期中测试化学试卷2015-2016学年广东省普宁华侨中学高二上第三次月考化学试卷2015-2016学年江苏省清江中学高二上期末必修化学试卷2016届河北省正定中学高三上学期期末理综化学试卷【全国百强校】福建省三明市第一中学2018-2019学年高二下学期开学考试化学试题辽宁省大连市第二十四中学2020届高三上学期阶段联合考试化学试题安徽省六安市毛坦厂中学2020届高三11月月考化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2020届高三上学期期末考试化学试题河北省衡水中学2020届高三七调考试化学试题(已下线)考点04 离子反应-2020年高考化学命题预测与模拟试题分类精编湖北省武汉市第十一中学2019-2020学年高一下学期期中测试化学试题浙江省宁波市效实中学2020-2021学年高一下学期期中考试化学(学考)试题(已下线)课时08 离子检验与推断-2022年高考化学一轮复习小题多维练(全国通用)江苏省苏州市2022-2023学年高一上学期期中调研化学试题江苏省连云港市海州区四校2022-2023学年高一上学期期中考试化学试题江苏省徐州市2022-2023学年高一上学期阶段测试(一)化学试题江苏省常熟中学2022-2023学年高一下学期学业质量阳光指标调研化学试题江苏省西安交通大学苏州附属中学2023-2024学年高一上学期10月月考化学试题江苏省昆山中学2023-2024学年高一上学期10月月考化学试题江苏省昆山市陆家高级中学、花桥康桥学校2023-2024学年高一上学期10月阶段性测试化学试题江苏省昆山市柏庐高级中学 、周高高级中学2023~2024学年高一上学期阶段性测试(10月)化学试题福建省莆田第一中学2023-2024学年高一上学期期中考试化学试题山东省菏泽市第一中学2023-2024学年高二上学期第三次月考化学试题(已下线)专题02 氮及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)四川省眉山市仁寿第一中学校(北校区)2023-2024学年高一下学期3月月考化学试题黑龙江省哈尔滨市第三中学校2023-2024学年 高一下学期第一次验收考试化学试题
名校
10 . DCCNa(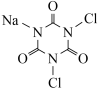 )是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸(
)是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸( )溶液反应制备DCCNa,实验装置如图所示:
)溶液反应制备DCCNa,实验装置如图所示:

已知: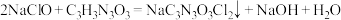
回答下列问题:
(1)仪器a的名称为______ 。
(2)装置A中发生的离子反应方程式为______ 。
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是______ 。
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是______ 。
(5)实验过程中B的温度必须保持为7~12℃,pH控制在6.5~8.5的范围。若温度过高,pH过低, 在溶液中会与
在溶液中会与 发生副反应生成
发生副反应生成 和
和 等,写出该副反应的化学方程式:
等,写出该副反应的化学方程式:______ 。
(6)装置C的试剂可选用______ (填标号)。
a. b.NaCl c.
b.NaCl c. d。
d。
(7)反应结束后,装置B中的浊液经过滤、______ 、干燥得DCCNa粗产品。
 )是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸(
)是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸( )溶液反应制备DCCNa,实验装置如图所示:
)溶液反应制备DCCNa,实验装置如图所示:
已知:
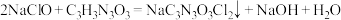
回答下列问题:
(1)仪器a的名称为
(2)装置A中发生的离子反应方程式为
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是
(5)实验过程中B的温度必须保持为7~12℃,pH控制在6.5~8.5的范围。若温度过高,pH过低,
 在溶液中会与
在溶液中会与 发生副反应生成
发生副反应生成 和
和 等,写出该副反应的化学方程式:
等,写出该副反应的化学方程式:(6)装置C的试剂可选用
a.
 b.NaCl c.
b.NaCl c. d。
d。
(7)反应结束后,装置B中的浊液经过滤、
您最近一年使用:0次
2023-11-30更新
|
248次组卷
|
2卷引用: 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题



