名校
1 . 某学习小组欲利用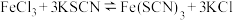 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将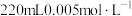
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变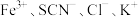 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2mL溶液X,加入5滴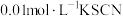 溶液,溶液红色
溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同):取2mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。
(2)取2mL溶液X,加入5滴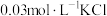 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。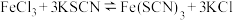 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ ,二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应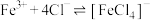 。
。
(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②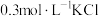 溶液、溶液、③
溶液、溶液、③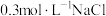 溶液、④
溶液、④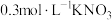 溶液、⑤
溶液、⑤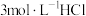 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。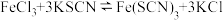 平衡体系的实验组是
平衡体系的实验组是____ ,盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
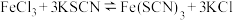 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将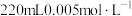
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
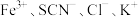 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2mL溶液X,加入5滴
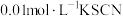 溶液,溶液红色
溶液,溶液红色(2)取2mL溶液X,加入5滴
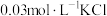 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
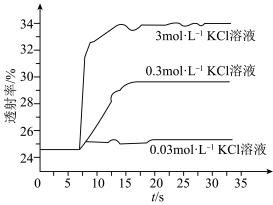
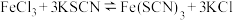 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应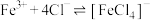 。
。(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②
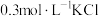 溶液、溶液、③
溶液、溶液、③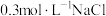 溶液、④
溶液、④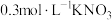 溶液、⑤
溶液、⑤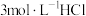 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。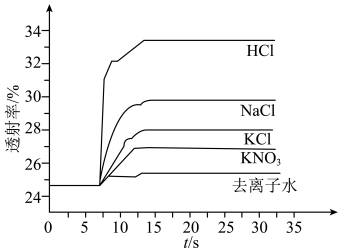
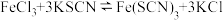 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近一年使用:0次
名校
2 . 将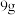 铜和铁的混合物投入
铜和铁的混合物投入 稀硝酸中,充分反应后得到标准状况下
稀硝酸中,充分反应后得到标准状况下 ,剩余
,剩余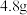 金属;继续加入
金属;继续加入 等浓度的稀硝酸,金属完全溶解,又得到标准状况下
等浓度的稀硝酸,金属完全溶解,又得到标准状况下 。若向反应后的溶液中加入
。若向反应后的溶液中加入 溶液,溶液不变红,则下列说法不正确的是
溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各 |
B.稀硝酸的物质的量浓度为 |
C.第一次剩余的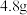 金属为铜 金属为铜 |
D.向反应后的溶液中再加入该稀硝酸 ,又得到标准状况下的 ,又得到标准状况下的 |
您最近一年使用:0次
3 . 25℃时,某混合溶液中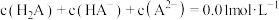 由水电离出的
由水电离出的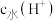 的对数
的对数 与
与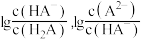 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是

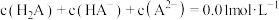 由水电离出的
由水电离出的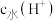 的对数
的对数 与
与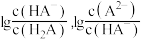 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
A.曲线 表示 表示 与 与 的变化关系 的变化关系 |
B.X点时存在 |
C.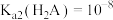 |
D. 点时溶液的 点时溶液的 |
您最近一年使用:0次
2023-11-20更新
|
518次组卷
|
2卷引用:天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷
4 . 银及其化合物在催化与电化学等领域中具有重要应用。
(1)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图所示,回答下列问题:

①中间体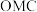 生成吸附态
生成吸附态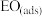 的活化能为
的活化能为_______  。
。
②由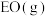 生成
生成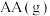 的热化学方程式为
的热化学方程式为_______ 。
(2)一定条件下,银催化剂表面上存在反应: ,该反应平衡压强
,该反应平衡压强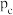 与温度
与温度 的关系如下:
的关系如下:
①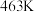 时的平衡常数
时的平衡常数
_______ 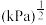 。
。
②起始状态Ⅰ中有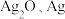 和
和 ,经下列过程达到各平衡状态:
,经下列过程达到各平衡状态:

已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是_______ (填字母)。
A.从Ⅰ到Ⅱ的过程
B.
C.平衡常数: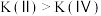
D.若体积 ,则
,则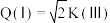
E.逆反应的速率: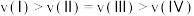
③某温度下,向恒容容器中加入 ,分解过程中反应速率
,分解过程中反应速率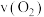 与压强
与压强 的关系为
的关系为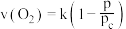 ,k为速率常数(定温下为常数)。当固体质量减少
,k为速率常数(定温下为常数)。当固体质量减少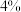 时,逆反应速率最大。若转化率为
时,逆反应速率最大。若转化率为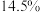 ,则
,则
_______ (用 表示)。
表示)。
(3) 可用作固体离子导体,能通过加热
可用作固体离子导体,能通过加热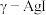 制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。

①测定晶体结构最常用的仪器是_______ (填字母)。
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D. 射线衍射仪
射线衍射仪
②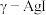 与
与 晶胞的体积之比为
晶胞的体积之比为_______ 。
③测定 中导电离子类型的实验装置如图所示。实验测得支管a中
中导电离子类型的实验装置如图所示。实验测得支管a中 质量不变,可判定导电离子是
质量不变,可判定导电离子是 而不是
而不是 ,依据是
,依据是_______ 。
(1)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图所示,回答下列问题:

①中间体
 生成吸附态
生成吸附态 的活化能为
的活化能为 。
。②由
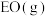 生成
生成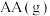 的热化学方程式为
的热化学方程式为(2)一定条件下,银催化剂表面上存在反应:
 ,该反应平衡压强
,该反应平衡压强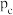 与温度
与温度 的关系如下:
的关系如下: | 401 | 443 | 463 |
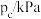 | 10 | 51 | 100 |
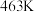 时的平衡常数
时的平衡常数
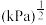 。
。②起始状态Ⅰ中有
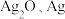 和
和 ,经下列过程达到各平衡状态:
,经下列过程达到各平衡状态:
已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是
A.从Ⅰ到Ⅱ的过程

B.

C.平衡常数:
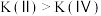
D.若体积
 ,则
,则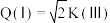
E.逆反应的速率:
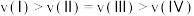
③某温度下,向恒容容器中加入
 ,分解过程中反应速率
,分解过程中反应速率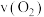 与压强
与压强 的关系为
的关系为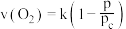 ,k为速率常数(定温下为常数)。当固体质量减少
,k为速率常数(定温下为常数)。当固体质量减少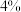 时,逆反应速率最大。若转化率为
时,逆反应速率最大。若转化率为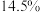 ,则
,则
 表示)。
表示)。(3)
 可用作固体离子导体,能通过加热
可用作固体离子导体,能通过加热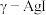 制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
①测定晶体结构最常用的仪器是
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D.
 射线衍射仪
射线衍射仪②
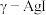 与
与 晶胞的体积之比为
晶胞的体积之比为③测定
 中导电离子类型的实验装置如图所示。实验测得支管a中
中导电离子类型的实验装置如图所示。实验测得支管a中 质量不变,可判定导电离子是
质量不变,可判定导电离子是 而不是
而不是 ,依据是
,依据是
您最近一年使用:0次
2023-09-28更新
|
5515次组卷
|
7卷引用:天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷
5 . 由 C-H 键构建 C-C 键是有机化学的热点研究领域。我国科学家利用 N-苯基甘氨酸中的 C-H 键在氧气作用下构建 C-C 键,实现了喹啉并内酯的高选择性制备。合成路线如下图。
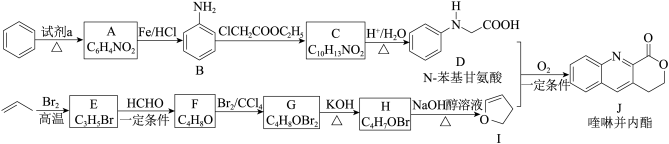
已知: i.ROH RBr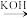 ROR
ROR
ii.R-Br+R'CHO
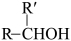
(1)试剂 a 为___________ 。E 中含有官能团名称___________ ,ClCH2COOC2H5用系统命名法的名称___________ 。
(2)B 具有碱性,B 转化为 C 的反应中,使 B 过量可以提高ClCH2COOC2H5的平衡转化率, 其原因是___________ (写出一条即可)。
(3)C 转化为 D 的化学方程式为___________ 。
(4)G 转化为 H 的化学方程式为___________ ;
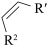
(5)已知:
i.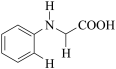 +
+ 

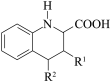
ii.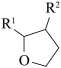

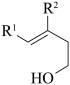
①D 和 I 在O2作用下得到 J 的 4 步反应如下图(无机试剂及条件已略去),中间产物 1 中有两个六元环和一个五元环,中间产物 3 中有三个六元环。结合已知反应信息,写出中间产物 1 和中间产物 3 的结构简式___________ 、___________ 。
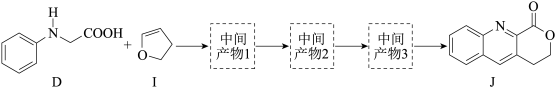
②D 和 I 转化成 J 的反应过程中还生成水,理论上该过程中消耗的O2与生成的 J 的物质的量之比为___________ 。

已知: i.ROH RBr
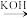 ROR
RORii.R-Br+R'CHO

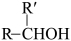
(1)试剂 a 为
(2)B 具有碱性,B 转化为 C 的反应中,使 B 过量可以提高ClCH2COOC2H5的平衡转化率, 其原因是
(3)C 转化为 D 的化学方程式为
(4)G 转化为 H 的化学方程式为
(5)已知:
i.
 +
+ 


ii.



①D 和 I 在O2作用下得到 J 的 4 步反应如下图(无机试剂及条件已略去),中间产物 1 中有两个六元环和一个五元环,中间产物 3 中有三个六元环。结合已知反应信息,写出中间产物 1 和中间产物 3 的结构简式

②D 和 I 转化成 J 的反应过程中还生成水,理论上该过程中消耗的O2与生成的 J 的物质的量之比为
您最近一年使用:0次
名校
6 . 葡萄酒中 最大使用量为
最大使用量为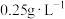 ,取
,取 葡萄酒。通过适当的方法使其所含
葡萄酒。通过适当的方法使其所含 全部逸出并用
全部逸出并用 将其全部氧化为
将其全部氧化为 ,这样得到
,这样得到 溶液。然后用
溶液。然后用 标准溶液进行滴定。
标准溶液进行滴定。
具体操作步骤包括:
A.________,并用蒸馏水洗涤滴定管;
B.用标准 溶液润洗滴定管
溶液润洗滴定管 次;
次;
C.取标准 溶液注入滴定管至刻度“0”以上
溶液注入滴定管至刻度“0”以上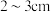 处;
处;
D.调节滴定管使尖嘴处充满溶液,并使液面至________刻度,记下读数;
E.移取 待测硫酸溶液注入洁净的锥形瓶中,并加入
待测硫酸溶液注入洁净的锥形瓶中,并加入 滴指示剂;
滴指示剂;
F.把锥形瓶放在滴定管下面,用标准 溶液滴定至终点并记下读数。
溶液滴定至终点并记下读数。
(1)填写空缺的操作步骤:①_______ 、②_______ 。
(2)上述滴定实验中,可选择甲基橙为指示剂,如何判断反应到达滴定终点:加入最后半滴标准液,_______ 。
(3)根据上述实验数据,可计算出所得硫酸的浓度为_______  (保留4位小数)。经计算,该葡萄酒中
(保留4位小数)。经计算,该葡萄酒中 使用量为
使用量为_______  (保留3位小数),由此可以判断其是否达标。
(保留3位小数),由此可以判断其是否达标。
(4)若称取一定量的 固体(含少量
固体(含少量 杂质)配制标准溶液并用来滴定,则对滴定结果产生的影响是
杂质)配制标准溶液并用来滴定,则对滴定结果产生的影响是_______ (填“偏大”、“偏小”或“无影响”)。
氧化铁是一种重要的无机材料,其化学性质稳定,催化活性高,具有良好的耐光性等优良性能。现从某种酸性工业废液(主要含 、
、 、
、 、
、 、
、 、
、 、
、 )中回收氧化铁的流程如图所示:
)中回收氧化铁的流程如图所示:

已知:常温下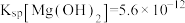 、
、 ;
; 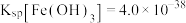 、
、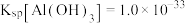 。
。
(5)写出在该酸性废液中通入空气时发生反应的离子方程式:_______ ,使用空气的优点是_______ 。
(6)常温下,在 的溶液中
的溶液中 存在的最大浓度为
存在的最大浓度为_______ 。
(7)有人利用氨水调节溶液 ,在
,在 时将
时将 沉淀出来,写出反应的离子方程式:
沉淀出来,写出反应的离子方程式:____ ,此时可能混有的杂质是____ (填化学式,下同),用_____ 试剂可将其除去。
 最大使用量为
最大使用量为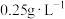 ,取
,取 葡萄酒。通过适当的方法使其所含
葡萄酒。通过适当的方法使其所含 全部逸出并用
全部逸出并用 将其全部氧化为
将其全部氧化为 ,这样得到
,这样得到 溶液。然后用
溶液。然后用 标准溶液进行滴定。
标准溶液进行滴定。具体操作步骤包括:
A.________,并用蒸馏水洗涤滴定管;
B.用标准
 溶液润洗滴定管
溶液润洗滴定管 次;
次;C.取标准
 溶液注入滴定管至刻度“0”以上
溶液注入滴定管至刻度“0”以上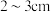 处;
处;D.调节滴定管使尖嘴处充满溶液,并使液面至________刻度,记下读数;
E.移取
 待测硫酸溶液注入洁净的锥形瓶中,并加入
待测硫酸溶液注入洁净的锥形瓶中,并加入 滴指示剂;
滴指示剂;F.把锥形瓶放在滴定管下面,用标准
 溶液滴定至终点并记下读数。
溶液滴定至终点并记下读数。| 实验 | 消耗 溶液的体积 溶液的体积 | 待测酸的体积 |
| 1 | 21.60 | 20.00 |
| 2 | 21.70 | 20.00 |
| 3 | 25.60 | 20.00 |
(2)上述滴定实验中,可选择甲基橙为指示剂,如何判断反应到达滴定终点:加入最后半滴标准液,
(3)根据上述实验数据,可计算出所得硫酸的浓度为
 (保留4位小数)。经计算,该葡萄酒中
(保留4位小数)。经计算,该葡萄酒中 使用量为
使用量为 (保留3位小数),由此可以判断其是否达标。
(保留3位小数),由此可以判断其是否达标。(4)若称取一定量的
 固体(含少量
固体(含少量 杂质)配制标准溶液并用来滴定,则对滴定结果产生的影响是
杂质)配制标准溶液并用来滴定,则对滴定结果产生的影响是氧化铁是一种重要的无机材料,其化学性质稳定,催化活性高,具有良好的耐光性等优良性能。现从某种酸性工业废液(主要含
 、
、 、
、 、
、 、
、 、
、 、
、 )中回收氧化铁的流程如图所示:
)中回收氧化铁的流程如图所示:
已知:常温下
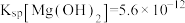 、
、 ;
; 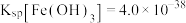 、
、 。
。(5)写出在该酸性废液中通入空气时发生反应的离子方程式:
(6)常温下,在
 的溶液中
的溶液中 存在的最大浓度为
存在的最大浓度为(7)有人利用氨水调节溶液
 ,在
,在 时将
时将 沉淀出来,写出反应的离子方程式:
沉淀出来,写出反应的离子方程式:
您最近一年使用:0次
2023-01-11更新
|
209次组卷
|
2卷引用:天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷
7 . 白云石的主要化学成分为 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
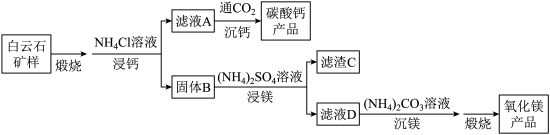
已知:
(1)白云石矿样煅烧完全分解的化学方程式为___________ 。
(2)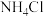 用量对碳酸钙产品的影响如下表
用量对碳酸钙产品的影响如下表
备注:ⅰ、 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量) (M代表Ca或Mg)
(M代表Ca或Mg)
ⅱ、 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。
①解释“浸钙”过程中主要浸出 的原因是
的原因是___________ 。
②沉钙反应的离子方程式为___________ 。
③“浸钙”过程不适宜选用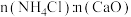 的比例为
的比例为___________ 。
④产品中 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是___________ 。
(3)“浸镁”过程中,取固体B与一定浓度的 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是___________ 。
(4)滤渣C中含有的物质是___________ 。
(5)该流程中可循环利用的物质是___________ 。
 ,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
,还含有质量分数约为2.1%的Fe2O3和1.0%的SiO2。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 |  |  |  |  |
 | 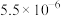 |  |  | 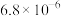 |
(1)白云石矿样煅烧完全分解的化学方程式为
(2)
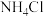 用量对碳酸钙产品的影响如下表
用量对碳酸钙产品的影响如下表| n(NH4Cl)/n(CaO) | 氧化物( )浸出率/% )浸出率/% | 产品中 纯度/% 纯度/% | 产品中Mg杂质含量/% (以  计) 计) | ||
 |  | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
 浸出率=(浸出的
浸出率=(浸出的 质量/煅烧得到的
质量/煅烧得到的 质量)
质量) (M代表Ca或Mg)
(M代表Ca或Mg)ⅱ、
 纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度计算值为滤液A中钙、镁全部以碳酸盐形式沉淀时计算出的产品中 纯度。
纯度。①解释“浸钙”过程中主要浸出
 的原因是
的原因是②沉钙反应的离子方程式为
③“浸钙”过程不适宜选用
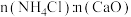 的比例为
的比例为④产品中
 纯度的实测值高于计算值的原因是
纯度的实测值高于计算值的原因是(3)“浸镁”过程中,取固体B与一定浓度的
 溶液混合,充分反应后
溶液混合,充分反应后 的浸出率低于60%。加热蒸馏,
的浸出率低于60%。加热蒸馏, 的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是
的浸出率随馏出液体积增大而增大,最终可达98.9%。从化学平衡的角度解释浸出率增大的原因是(4)滤渣C中含有的物质是
(5)该流程中可循环利用的物质是
您最近一年使用:0次
2022-09-08更新
|
10228次组卷
|
14卷引用:天津市耀华中学2022-2023学年高三上学期第一次月考化学试题
天津市耀华中学2022-2023学年高三上学期第一次月考化学试题(已下线)北京市第四中学2022-2023学年高三上学期阶段测试2化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)第08讲 铝、镁及其重要化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题15-19(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题(已下线)易错点33 物质的制备-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺(已下线)2022年北京高考真题化学试题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)北京交通大学附属中学2023-2024学年高三下学期开学考化学试题
名校
8 . 一种双阴极微生物燃料电池装置如图所示。该装置可以同时进行硝化和反硝化脱氮,下列叙述正确的是

| A.电池工作时,H+的迁移方向:左→右 |
| B.电池工作时,“缺氧阴极”电极附近的溶液pH减小 |
C.“好氧阴极”存在反应: -6e-+ 8OH-= -6e-+ 8OH-= + 6H2O + 6H2O |
| D.“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol |
您最近一年使用:0次
2022-05-27更新
|
3717次组卷
|
11卷引用:天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷
天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷湖南省衡阳市第八中学2022-2023学年高二下学期第二次月考化学试题湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题湖北省黄冈中学2022届高三第三次模拟考试化学试题(已下线)专题08 电化学及其应用-三年(2020-2022)高考真题分项汇编(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)山东省青岛第十九中学2022-2023学年高二上学期期中考试化学试题浙江省东阳中学2023届高三浙江省普通高校招生选考科目考试仿真训练化学试题2024届广东省名校高三下学期4月份联考化学试题 湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题2024届广东省深圳市东北师范大学附属中学深圳学校高三下学期适应性考试化学试卷
名校
解题方法
9 . 盐X溶液能发生如图所示的转化关系(部分反应的反应条件已略),相对分子质量:c比b大16,f比e大16。下列推断正确的是


| A.X可能为正盐,也可能为酸式盐 | B.将b通入a的水溶液中可能生成白色沉淀 |
| C.a、b、c、d、e、f可能都是极性分子 | D.反应①、②可能具有相同的实验现象 |
您最近一年使用:0次
2022-04-01更新
|
2175次组卷
|
8卷引用:天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷
天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷辽宁省沈阳市东北育才双语学校2022-2023学年高三上学期第一次模拟测试化学试题湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题湖南省攸县第三中学2022-2023学年高三第六次月考化学试题湖南省株洲市第四中学2023届高三第六次月考化学试题重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题(已下线)专项06 元素及其化合物-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考考前押题密卷(辽宁卷)
12-13高三下·江苏扬州·阶段练习
名校
解题方法
10 . 常温下,向 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是
 溶液中逐滴加入
溶液中逐滴加入 的
的 溶液,溶液的
溶液,溶液的 随
随 溶液体积的变化如图所示。下列说法正确的是
溶液体积的变化如图所示。下列说法正确的是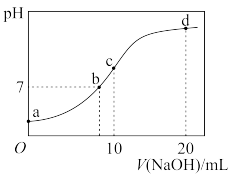
A.点 所示溶液中: 所示溶液中: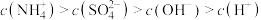 |
B.点 所示溶液中: 所示溶液中: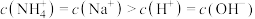 |
C.点 所示溶液中: 所示溶液中: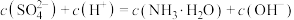 |
D.点 以后的溶液中可能出现: 以后的溶液中可能出现: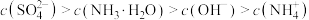 |
您最近一年使用:0次
2021-12-29更新
|
1227次组卷
|
23卷引用:天津市海河中学2020届高三第二学期化学测试(二)试卷
天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)2013届江苏省扬州市高三下学期5月考前适应性考试化学试卷河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题河北省武邑中学2019-2020学年高二下学期3月线上考试化学试题辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题黑龙江省安达市第七中学2019-2020学年高二下学期第一次网络检测化学试题上海交通大学附属中学2021届高三下学期3月月考化学试题天津市耀华中学2021届高三年级第二次模拟考试化学试题江苏省秦淮中学、宇通实验学校等六校2022-2023学年高三上学期10月学情调研化学试题2017届江苏省南通市高三高考全真模拟(四)化学 试卷2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷黑龙江省双鸭山市第一中学2017届高三全真模拟(第四次)考试理科综合化学试题浙江省2018版考前特训(2017年10月):选考仿真测试卷(四)江苏省前黄高级中学、如东高级中学、姜堰中学等五校2018届高三上学期第一次学情监测化学试题新疆2018届高三第一次适应性检测(一模)理科综合化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷吉林油田高级中学2021-2022学年高二上学期期中考试化学试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题江西省九江市第一中学2021-2022学年高二上学期期末化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题



