名校
解题方法
1 . 镓与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____ ,基态As原子核外有_________ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓____ (填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_________ 。
GaF3的熔点超过1000℃,可能的原因是______ 。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为___ ,草酸根中碳原子的杂化方式为____ 。
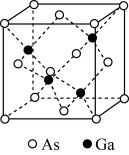

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_____ ,晶体的密度为____ (设NA为阿伏加 德罗常数的数值,列出算式即可)g·cm−3。
(1)基态Ga原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为


(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为
您最近一年使用:0次
2020-08-15更新
|
90次组卷
|
10卷引用:山西省六校(长治二中,晋城一中、康杰中学、临汾一中等)2018届高三第四次名校联合考试(百日冲刺)理综化学试题
山西省六校(长治二中,晋城一中、康杰中学、临汾一中等)2018届高三第四次名校联合考试(百日冲刺)理综化学试题山东省济南市章丘区2018届高三3月模拟联考理综化学试题四川省泸县第四中学2019届高三二诊模拟理综-化学试题河北省邢台市2018届高三上学期期末考试理综化学试题湖南省邵阳市2018届高三上学期期末考试理综化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二下学期第一次月考化学试题河北省藁城市第一中学2019届高三下学期4月月考化学试题河北省沧州市泊头市第一中学2020届高三上学期第四次月考化学试题湖南省湘潭一中、双峰一中,邵东一中2019-2020学年高二下学期联考化学试题高二选择性必修2(人教版2019)全书综合训练
2 . 钒被称为“现代工业味精”,是发展现代工业、现代国防和现代科学技术不可缺少的重要材料。常见的钒氧化物为VO、V2O3、VO2、V2O5,低价氧化钒在空气中易被氧化成高价氧化钒。
请回答下列问题:
(1)已知:
①2V(s)+O2(g)=2VO(s) △H1=-825.6kJ·mol-1
②4VO(s)+O2(g)=2V2O3(s) △H2=-788.8kJ·mol-1
③V2O3(s)+O2(g)=V2O5(s) △H3=-334.6kJ·mol-1
④4V(s)+5O2(g)=2V2O5(s) △H4
据上述反应热效应之间的关系,可知△H4=___ 。
(2)V2O5是钒氧化物中最重要的,也是最常用的钒化工制品。工业上制备V2O5的一个方法是利用VOCl3水解,则VOCl3中V的化合价为___ ,水解反应的化学方程式为___ 。
(3)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为___ 。
(4)工业制硫酸常用V2O5作催化剂,已知2SO2(g)+O2(g)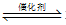 2SO3(g) △H=-196kJ·mol-1,500℃时将2molSO2和1molO2装入一容积恒定的10L密闭容器中,达到平衡时容器中SO3的浓度为0.1mol·L-1。
2SO3(g) △H=-196kJ·mol-1,500℃时将2molSO2和1molO2装入一容积恒定的10L密闭容器中,达到平衡时容器中SO3的浓度为0.1mol·L-1。
①该反应的平衡常数K=___ 。某温度时,该反应的平衡常数K=50,则该温度___ (填“>”“<”或“=”)500℃。
②下列措施能使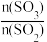 的值减小的是
的值减小的是___ (填字母)。
A.升温
B.其他条件不变,再充入2molHe
C.其他条件不变,再充入2molSO2和1molO2
D.不用V2O5作催化剂,改用其他更高效的催化剂
(5)酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成可溶性的VOSO4,请写出该反应的离子方程式:___ 。
请回答下列问题:
(1)已知:
①2V(s)+O2(g)=2VO(s) △H1=-825.6kJ·mol-1
②4VO(s)+O2(g)=2V2O3(s) △H2=-788.8kJ·mol-1
③V2O3(s)+O2(g)=V2O5(s) △H3=-334.6kJ·mol-1
④4V(s)+5O2(g)=2V2O5(s) △H4
据上述反应热效应之间的关系,可知△H4=
(2)V2O5是钒氧化物中最重要的,也是最常用的钒化工制品。工业上制备V2O5的一个方法是利用VOCl3水解,则VOCl3中V的化合价为
(3)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为
(4)工业制硫酸常用V2O5作催化剂,已知2SO2(g)+O2(g)
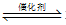 2SO3(g) △H=-196kJ·mol-1,500℃时将2molSO2和1molO2装入一容积恒定的10L密闭容器中,达到平衡时容器中SO3的浓度为0.1mol·L-1。
2SO3(g) △H=-196kJ·mol-1,500℃时将2molSO2和1molO2装入一容积恒定的10L密闭容器中,达到平衡时容器中SO3的浓度为0.1mol·L-1。①该反应的平衡常数K=
②下列措施能使
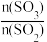 的值减小的是
的值减小的是A.升温
B.其他条件不变,再充入2molHe
C.其他条件不变,再充入2molSO2和1molO2
D.不用V2O5作催化剂,改用其他更高效的催化剂
(5)酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成可溶性的VOSO4,请写出该反应的离子方程式:
您最近一年使用:0次
2020-04-21更新
|
164次组卷
|
2卷引用:山西省长治市2020届高三(3月在线)理综化学试题
解题方法
3 . 废铅蓄电池的一种回收利用工艺流程如图所示:
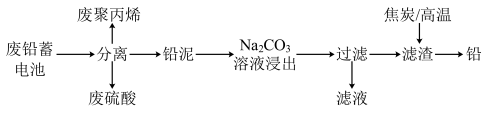
部分难溶电解质的性质如下表:
请回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有___ (写一条)。
(2)利用废铅蓄电池中的废硫酸与氟磷灰石[Ca5(PO4)3F]反应,可以制化肥-过磷酸钙[有效成分是Ca(H2PO4)2],写出该反应的化学方程式:___ 。
(3)Na2CO3溶液浸出时发生的反应为CO32-(aq)十PbSO4(s) PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___ 。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___ 。
(4)利用铅泥中PbSO4制取PbO2的方法:PbSO4溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb与KClO在强碱性条件下反应制取PbO2,写出生成PbO2的离子方程式:___ 。
(5)已知Pb(OH)2是既能溶于稀硝酸又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4:___ 。

部分难溶电解质的性质如下表:
| 物质 | Ksp | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.4×10-20 | 白色 |
请回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有
(2)利用废铅蓄电池中的废硫酸与氟磷灰石[Ca5(PO4)3F]反应,可以制化肥-过磷酸钙[有效成分是Ca(H2PO4)2],写出该反应的化学方程式:
(3)Na2CO3溶液浸出时发生的反应为CO32-(aq)十PbSO4(s)
 PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=(4)利用铅泥中PbSO4制取PbO2的方法:PbSO4溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb与KClO在强碱性条件下反应制取PbO2,写出生成PbO2的离子方程式:
(5)已知Pb(OH)2是既能溶于稀硝酸又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4:
您最近一年使用:0次
名校
解题方法
4 . 常温下,下列有关溶液的说法正确的是( )
| A.pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液:NH4+浓度的大小顺序为①>②>③ |
| B.常温下,pH为5的氯化铵溶液和pH为5的醋酸溶液中水的电离程度相同 |
| C.HA的电离常数Ka=4.93×10-10,则等浓度的NaA、HA混合溶液中:c(Na+)>c(HA)>c(A-) |
| D.已知在相同条件下酸性HF>CH3COOH,则物质的量浓度相等的NaF与CH3COOK溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
您最近一年使用:0次
2020-04-21更新
|
204次组卷
|
3卷引用:山西省长治市2020届高三(3月在线)理综化学试题
解题方法
5 . 已知:CH3C≡CH+CO+CH3OH M,N+CH3OH
M,N+CH3OH M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )
M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )
 M,N+CH3OH
M,N+CH3OH M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )
M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是( )| A.N可以使溴水褪色 |
| B.N转化为M的反应为取代反应 |
| C.M中所有碳原子可能共面 |
| D.N属于酯的同分异构体有3种 |
您最近一年使用:0次
6 . 某同学结合所学知识探究Na2O2与H2能否反应,设计装置如图,下列说法正确的是( )


| A.装置A中锌粒可用铁粉代替 |
| B.装置B中盛放碱石灰,目的是除去A中挥发出来的少量水蒸气 |
| C.装置C加热前,必须先用试管在干燥管管口处收集气体,检验气体纯度 |
| D.装置A也可直接用于MnO2与浓盐酸反应制取Cl2 |
您最近一年使用:0次
2020-04-21更新
|
413次组卷
|
4卷引用:山西省长治市2020届高三(3月在线)理综化学试题
山西省长治市2020届高三(3月在线)理综化学试题(已下线)第一节 钠及其化合物(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)(已下线)小题必刷12 钠及其化合物——2021年高考化学一轮复习小题必刷(通用版)陕西省西安中学 2023 届高三上学期第二次质量检测化学试题
7 . 通常检测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。设NA表示阿伏加 德罗常数的值,下列说法错误的是( )
| A.生成2.33gBaSO4沉淀时,转移电子数目为0.02NA |
| B.SO2具有漂白性,从而可使品红褪色 |
| C.17gH2O2中含有非极性键的数目为0.5NA |
| D.0.1molBaCl2晶体中所含分子总数为0.1NA |
您最近一年使用:0次
名校
解题方法
8 . 下列事实不能说明X元素的非金属性比硫元素的非金属性强的是( )
| A.X单质与H2S溶液反应,溶液变浑浊 |
| B.在氧化还原反应中,1molX单质比1mol硫得电子多 |
| C.X和硫两元素的气态氢化物受热分解,前者的分解温度高 |
| D.X元素的最高价含氧酸的酸性强于硫酸的酸性 |
您最近一年使用:0次
2020-04-21更新
|
132次组卷
|
3卷引用:山西省长治市2020届高三(3月在线)理综化学试题
名校
解题方法
9 . 普通电解精炼铜的方法所制备的铜中仍含杂质,利用如图中的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是( )
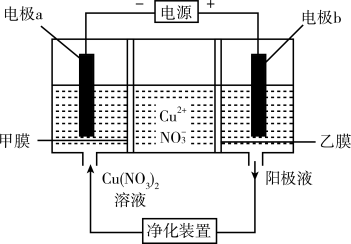

| A.电极a为粗铜 |
| B.甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区 |
| C.乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 |
| D.当电路中通过1mol电子时,可生成32g精铜 |
您最近一年使用:0次
2020-04-21更新
|
293次组卷
|
2卷引用:山西省长治市2020届高三(3月在线)理综化学试题
10 . 化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
| A.用石材制作砚台的过程是化学变化 |
| B.氯化铵溶液可清除铜制品表面的锈渍,是因为氨根离子水解使溶液显酸性 |
| C.月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋 |
| D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
您最近一年使用:0次



