解题方法
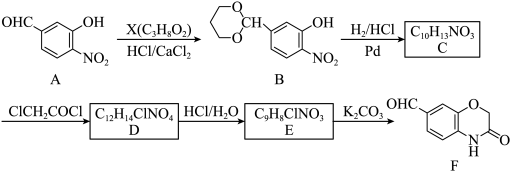
1 . 化合物F是合成某种药物的重要中间体,其合成路线如下: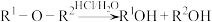
_______ ;F中含氧官能团的名称为_______ 。
2.(2)B→C和E→F的反应类型分别为_______ 、_______ 。
3.(3)设计A→B反应的目的为_______ 。
4.(4)C的结构简式为________ ,其中碳原子的轨道杂化类型有_______ 种。
5.(5)D→E的化学方程式为_______ 。
6.(6)M为F的同分异构体,满足下列条件的M有_______ 种(不考虑立体异构),任写其中一种核磁共振氢谱有4组峰的M的结构简式_______ 。
i.含苯环;ii.1molM与足量银氨溶液反应最多能生成6molAg。
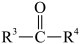
ii.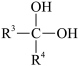 →
→
iii.R5-NH2+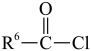
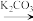
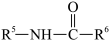
2.(2)B→C和E→F的反应类型分别为
3.(3)设计A→B反应的目的为
4.(4)C的结构简式为
5.(5)D→E的化学方程式为
6.(6)M为F的同分异构体,满足下列条件的M有
i.含苯环;ii.1molM与足量银氨溶液反应最多能生成6molAg。
您最近一年使用:0次
2024-05-31更新
|
112次组卷
|
2卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
2 . 下列实验操作及现象均正确,且能得出相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向FeS和CuS的混合物中加入足量稀硫酸,FeS完全溶解,CuS未溶解 | 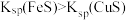 |
| B | 密闭容器中发生反应 ,缩小容器体积,气体颜色变深 ,缩小容器体积,气体颜色变深 | 缩小体积,平衡逆向移动 |
| C | 向溶液X中滴加盐酸酸化的 溶液,产生白色沉淀 溶液,产生白色沉淀 | 溶液X中存在 |
| D | 用pH计测定氯化铵溶液的pH,温度升高后,pH降低 | 温度升高促进 水解 水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-31更新
|
74次组卷
|
2卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
名校
解题方法
3 . 二甲醚( )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
Ⅰ.

Ⅱ.

Ⅲ.

下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
回答下列问题:
(1)
___________ ;反应Ⅱ的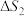
___________ (填“>”“=”或“<”)0。
(2) ℃下,向1L刚性密闭容器中投入2mol
℃下,向1L刚性密闭容器中投入2mol  ,只发生反应Ⅲ,t s时达到平衡,此时
,只发生反应Ⅲ,t s时达到平衡,此时 的转化率为
的转化率为 。
。
①下列叙述能说明反应Ⅲ已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化 b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率 d.
的消耗速率 d. 的体积分数不再发生变化
的体积分数不再发生变化
②若向该容器中再加入2mol ,重新达到平衡时所需时间
,重新达到平衡时所需时间___________ (填“>”“=”或“<”)t s,此时 的体积分数为
的体积分数为___________ (用含 的代数式表示)。
的代数式表示)。
③在催化剂条件下反应Ⅲ的反应过程如下图所示,“*”表示吸附在催化剂上。___________ (填“第一步”或“第二步”),判断的理由是__________________ 。
(3) ℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入
℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入 和
和 发生上述反应,平衡时
发生上述反应,平衡时 的转化率为60%,
的转化率为60%, (g)的体积分数为25%。则平衡时
(g)的体积分数为25%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字);该温度下反应Ⅰ的压强平衡常数
___________ (用含p的代数式表示) 。
。
 )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:Ⅰ.


Ⅱ.


Ⅲ.


下表是几种物质的标准生成热(由对应稳定单质生成1mol某种物质的焓变叫做该物质的标准生成热)。
| 物质 |  (g) (g) |  (g) (g) |  (g) (g) |  (g) (g) |
标准生成热/( ) ) | 0 | -201.3 | -241.3 | -184.3 |
(1)

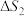
(2)
 ℃下,向1L刚性密闭容器中投入2mol
℃下,向1L刚性密闭容器中投入2mol  ,只发生反应Ⅲ,t s时达到平衡,此时
,只发生反应Ⅲ,t s时达到平衡,此时 的转化率为
的转化率为 。
。①下列叙述能说明反应Ⅲ已经达到平衡的是
a.混合气体密度不再发生变化 b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率 d.
的消耗速率 d. 的体积分数不再发生变化
的体积分数不再发生变化②若向该容器中再加入2mol
 ,重新达到平衡时所需时间
,重新达到平衡时所需时间 的体积分数为
的体积分数为 的代数式表示)。
的代数式表示)。③在催化剂条件下反应Ⅲ的反应过程如下图所示,“*”表示吸附在催化剂上。
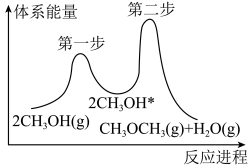
(3)
 ℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入
℃下,向压强恒定为p kPa的某密闭容器中按1∶3投入 和
和 发生上述反应,平衡时
发生上述反应,平衡时 的转化率为60%,
的转化率为60%, (g)的体积分数为25%。则平衡时
(g)的体积分数为25%。则平衡时 的体积分数为
的体积分数为
 。
。
您最近一年使用:0次
2024-04-19更新
|
227次组卷
|
3卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
名校
解题方法
4 . 氯化六氨合钴{ }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: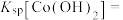
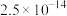 、
、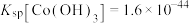 、
、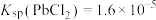 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,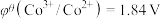 、
、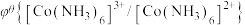
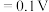 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是___________ (填仪器名称)。___________ ;控制反应温度在55℃的原因为___________ 。
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度___________ (填“大于”“小于”或“等于”)在浓盐酸中的。
(4)与步骤三中过滤相比,步骤四中抽滤的优点为___________ 。
(5)制备产品的总反应方程式为___________ ;步骤二中双氧水可用PbO2或KMnO4代替,其中更适合选用___________ (填化学式)代替双氧水,原因为___________ 。
(6)本实验所得产品的产率为___________ (列出计算式)。
 }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: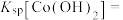
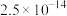 、
、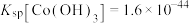 、
、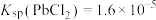 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,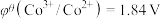 、
、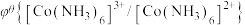
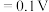 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度
(4)与步骤三中过滤相比,步骤四中抽滤的优点为
(5)制备产品的总反应方程式为
(6)本实验所得产品的产率为
您最近一年使用:0次
2024-04-19更新
|
193次组卷
|
5卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
名校
解题方法
5 . 用铜阳极泥进行金银提取,精炼过程产生的金精炼尾渣中含有多种贵金属,一种从金精炼尾渣中回收金(Au)、铂(Pt)、钯(Pd)的工艺流程如下: 、
、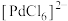 、
、 、
、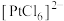 。
。
回答下列问题:
(1)“浸出”时,为提高金精炼尾渣的浸出速率,可采取的措施有___________ (任写两条)。
(2)“浸出”时,所用王水的组成及体积比为___________ 。
(3)“分金”时,生成金单质的离子方程式为___________ ;金位于元素周期表的第六周期第ⅠB族,则基态金原子的价层电子轨道表示式为___________ 。
(4)“沉铂”时,得到的 经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为
经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为___________ 。
(5)“沉钯”时,加入氯酸钠的目的为___________ 。
(6)“系列转化”涉及的部分转化如下:
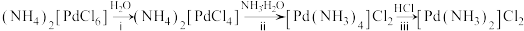
该过程中Pd有___________ 种不同的配位数,配位能力
___________  (填“>”或“<”);ⅲ中发生反应的化学方程式为
(填“>”或“<”);ⅲ中发生反应的化学方程式为___________ 。
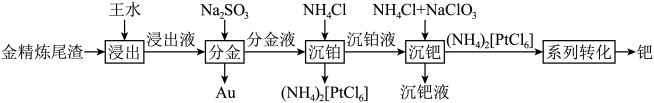
 、
、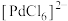 、
、 、
、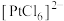 。
。回答下列问题:
(1)“浸出”时,为提高金精炼尾渣的浸出速率,可采取的措施有
(2)“浸出”时,所用王水的组成及体积比为
(3)“分金”时,生成金单质的离子方程式为
(4)“沉铂”时,得到的
 经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为
经煅烧后可得到海绵铂。工业上会将海绵铂反复“浸出—分金—沉铂—煅烧”2~3次,其目的为(5)“沉钯”时,加入氯酸钠的目的为
(6)“系列转化”涉及的部分转化如下:
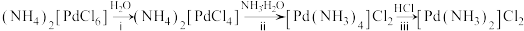
该过程中Pd有

 (填“>”或“<”);ⅲ中发生反应的化学方程式为
(填“>”或“<”);ⅲ中发生反应的化学方程式为
您最近一年使用:0次
2024-04-19更新
|
232次组卷
|
3卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
名校
6 . 已知HA是一元弱酸,MA是难溶盐,且 不发生水解。常温下,向某
不发生水解。常温下,向某 的溶液中逐滴加入MOH溶液后,溶液中
的溶液中逐滴加入MOH溶液后,溶液中 和
和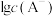 随
随 的变化关系如下图所示。下列说法错误的是
的变化关系如下图所示。下列说法错误的是
 不发生水解。常温下,向某
不发生水解。常温下,向某 的溶液中逐滴加入MOH溶液后,溶液中
的溶液中逐滴加入MOH溶液后,溶液中 和
和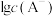 随
随 的变化关系如下图所示。下列说法错误的是
的变化关系如下图所示。下列说法错误的是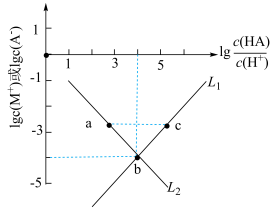
A.曲线 表示 表示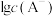 随 随 的变化 的变化 |
B.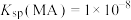 |
| C.pH:a>c |
D.b点时溶液中存在: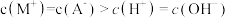 |
您最近一年使用:0次
2024-04-19更新
|
221次组卷
|
6卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学河北省张家口市尚义县第一中学等校2023-2024学年高三下学期4月模拟测试化学试题2024届河南省高三下学期4月模拟考试理科综合试题-高中化学(已下线)T13-溶液中的离子平衡(已下线)T13-溶液中的离子平衡(已下线)选择题11-14
名校
解题方法
7 . 氨是生产生活中重要的化工原料,也是一种重要的无碳存储介质,其生产技术一直受到广泛的关注。某团队利用电解法处理含 废水的同时制备
废水的同时制备 的工作原理如下。已知双极膜由阳离子交换膜和阴离子交换膜构成,溶液中水渗透到双极膜内界面解离成
的工作原理如下。已知双极膜由阳离子交换膜和阴离子交换膜构成,溶液中水渗透到双极膜内界面解离成 和
和 分别向两极移动。下列说法正确的是
分别向两极移动。下列说法正确的是
 废水的同时制备
废水的同时制备 的工作原理如下。已知双极膜由阳离子交换膜和阴离子交换膜构成,溶液中水渗透到双极膜内界面解离成
的工作原理如下。已知双极膜由阳离子交换膜和阴离子交换膜构成,溶液中水渗透到双极膜内界面解离成 和
和 分别向两极移动。下列说法正确的是
分别向两极移动。下列说法正确的是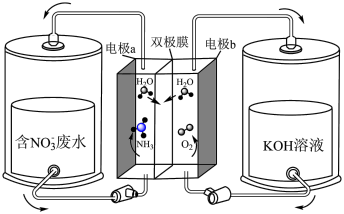
| A.电极b接电源负极 |
| B.双极膜的左侧为阴离子交换膜,右侧为阳离子交换膜 |
C.a电极的电极反应式为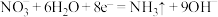 |
D.电解时,理论上生成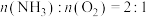 |
您最近一年使用:0次
2024-04-19更新
|
265次组卷
|
3卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
8 . 氮化硼是一种重要的无机非金属材料,在工业生产中有着重要的作用。常见的三种氮化硼晶体结构如下图:
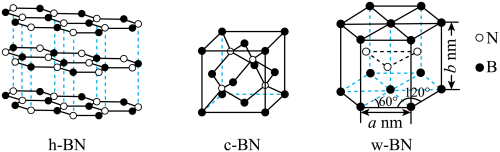
A.h-BN晶体中存在大 键 键 |
| B.c-BN晶体中由B、N构成最小的环为6元环 |
| C.w-BN晶体中B的配位数为12 |
D.w-BN晶体的密度可表示为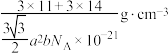 |
您最近一年使用:0次
2024-04-19更新
|
318次组卷
|
5卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
名校
解题方法
9 . 莫西赛利(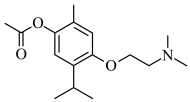 )是一种治疗脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。下列关于莫西赛利的说法错误的是
)是一种治疗脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。下列关于莫西赛利的说法错误的是
A.分子式为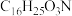 | B.能发生水解反应和加成反应 |
| C.分子中所有碳原子可能处于同一平面 | D.组成元素中基态N的第一电离能最大 |
您最近一年使用:0次
2024-04-19更新
|
246次组卷
|
3卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学
名校
10 . 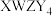 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是
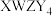 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是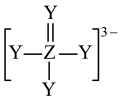
| A.电负性:Y>Z>X | B.W能与Y的简单氢化物反应生成 |
C.该化合物中Z采用 杂化 杂化 | D.Y元素形成的单质一定为非极性分子 |
您最近一年使用:0次
2024-04-19更新
|
180次组卷
|
4卷引用:2024届山西省吕梁市高三下学期4月模拟考试理科综合试题-高中化学



