1 . 制备FeOOH的工艺流程包含如下环节

(1)若在实验室完成上述制备,一定不需要的仪器是______。
(2)模拟氧化时,相关pH变化记录如图。

0~t1时段,pH逐渐减小的原因是反应生成了H2SO4,配平下列化学方程式:______ 。
______FeSO4+______O2+______=______FeOOH↓+______H2SO4
t1~t2时段,经历的反应为:12Fe2++3O2+2H2O=4FeOOH↓+8Fe3+,该过程pH继续平缓下降的原因可能是:______ 。(任写一条)
(3)判断流程中产品是否洗涤干净的方法是:______ 。

(1)若在实验室完成上述制备,一定不需要的仪器是______。
| A.烧杯 | B.漏斗 | C.玻璃棒 | D.蒸发皿 |

0~t1时段,pH逐渐减小的原因是反应生成了H2SO4,配平下列化学方程式:
______FeSO4+______O2+______=______FeOOH↓+______H2SO4
t1~t2时段,经历的反应为:12Fe2++3O2+2H2O=4FeOOH↓+8Fe3+,该过程pH继续平缓下降的原因可能是:
(3)判断流程中产品是否洗涤干净的方法是:
您最近一年使用:0次
解题方法
2 . 与氨气相关的化学变化是氮循环和转化的重要一环,对生产、生活有重要的价值。
(1)下图转化途径中属于“固氮”的是______。
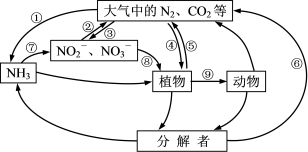
(2)合成氨是目前转化空气中氮最有效的工业方法,其反应历程和能量变化的简图如下:(图中ad表示物质吸附在催化剂表面时的状态)
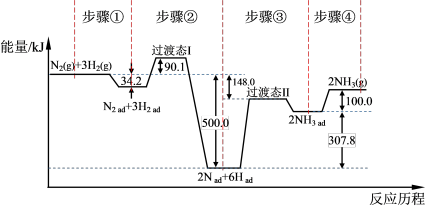
①由图可知合成氨反应N2(g)+3H2(g) 2NH3(g)的ΔH=
2NH3(g)的ΔH=______ kJ·mol-1,对总反应速率影响较大的是步骤______ 。(填写编号)
②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是______ 。(双选)
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
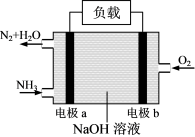
(3)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用NH3的燃烧反应(4NH3+3O2 2N2+6H2O)能设计成燃料电池,其工作原理如图所示。电极b为
2N2+6H2O)能设计成燃料电池,其工作原理如图所示。电极b为______ (选填“正”或“负”)极;电极a的电极反应式为______ ;当正负极共消耗3.136L(标准状况)气体时,通过负载的电子数为______ 个。
(1)下图转化途径中属于“固氮”的是______。
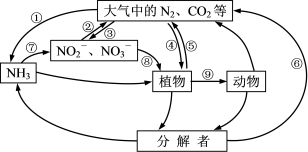
| A.④⑤⑥ | B.①③④ | C.①⑤⑦ | D.②⑧⑨ |

①由图可知合成氨反应N2(g)+3H2(g)
 2NH3(g)的ΔH=
2NH3(g)的ΔH=②若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.使用催化剂,能降低反应活化能,使单位体积内活化分子数增加
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
(3)氨是极具前景的氢能载体和性能卓越的“零碳”燃料,利用NH3的燃烧反应(4NH3+3O2
 2N2+6H2O)能设计成燃料电池,其工作原理如图所示。电极b为
2N2+6H2O)能设计成燃料电池,其工作原理如图所示。电极b为
您最近一年使用:0次
3 . 合成氨厂的CO2可用于合成重要化工原料CH3OH,主要反应为:3H2(g)+CO2(g) CH3OH(g)+H2O(g),向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
CH3OH(g)+H2O(g),向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
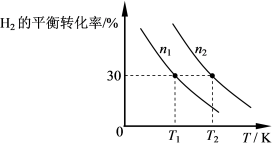
(1)若T1时,向容器中充入n1mol气体(3molH2和1molCO2),反应至5min时达到平衡,则0~5min内CO2的平均反应速率v(CO2)=______ 。
(2)由上图可判断该反应是______ (选填“吸热”或“放热”)反应,在______ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)判断图中n1、n2相对大小,并说明理由。______
 CH3OH(g)+H2O(g),向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。
CH3OH(g)+H2O(g),向两个容积固定为2L的密闭容器中分别充入比例相同,但总量不同的H2和CO2气体,H2的平衡转化率与初始充入物质的量(n)、反应温度(T)的关系如下图所示。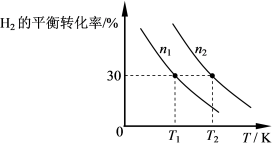
(1)若T1时,向容器中充入n1mol气体(3molH2和1molCO2),反应至5min时达到平衡,则0~5min内CO2的平均反应速率v(CO2)=
(2)由上图可判断该反应是
(3)判断图中n1、n2相对大小,并说明理由。
您最近一年使用:0次
解题方法
4 . 氧化铁黄(化学式为FeOOH)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾(FeSO4·7H2O)为原料制备FeOOH。
(1)下列关于铁元素的认识正确的是______。
(2)制备氧化铁黄的关键步骤是FeSO4溶液的氧化。为探究影响氧化FeSO4溶液快慢的因素,现利用FeSO4·7H2O、蒸馏水和稀H2SO4配制四组溶液进行实验,实验结果如下表:
对比实验I和II可知,实验中影响氧化快慢的因素是______ ;
综合对比分析四组实验,简述影响氧化FeSO4溶液快慢的决定因素。______
(1)下列关于铁元素的认识正确的是______。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
| 实验编号 | I | II | III | IV |
| c(FeSO4)/(mol·L-1) | 0.5 | 0.25 | 0.25 | 0.5 |
| 溶液pH | 2.9 | 2.9 | 3.5 | 3.3 |
| 初始颜色 | 浅绿色 | 浅绿色,较I浅 | 浅绿色,同II | 浅绿色,同I |
| 0.5h后颜色 | 浅绿色 | 浅绿色 | 黄绿色 | 浅绿色 |
| 2h后颜色 | 黄绿色 | 浅绿色 | 黄色 | 黄绿色 |
| 5h后颜色 | 浅黄色 | 浅黄色,较I浅 | 黄色,较IV浅 | 黄色 |
综合对比分析四组实验,简述影响氧化FeSO4溶液快慢的决定因素。
您最近一年使用:0次
5 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)下列生产、生活活动中,不易产生SO2的是______。
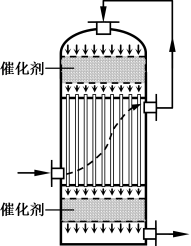
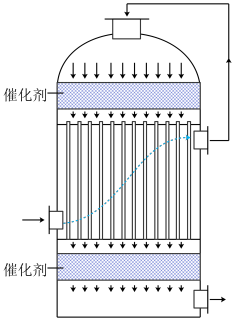
(2)工业中可用含SO2的冶炼烟气为原料生产硫酸,在右图装置中完成“SO2转化”工序。使用该装置实现了______。(双选)
(3)研究SO2的性质有利于探索其资源化利用。下列实验方案设计正确的是______。
(1)下列生产、生活活动中,不易产生SO2的是______。
| A.燃放鞭炮 | B.火力发电 | C.火山爆发 | D.海水晒盐 |
(2)工业中可用含SO2的冶炼烟气为原料生产硫酸,在右图装置中完成“SO2转化”工序。使用该装置实现了______。(双选)

| A.充分利用热能 |
| B.防止形成酸雾 |
| C.加速转化SO2 |
| D.获取纯净SO3 |
(3)研究SO2的性质有利于探索其资源化利用。下列实验方案设计正确的是______。
 |  |  |  |
| A.制取SO2 | B.收集SO2 | C.验证SO2水溶液的酸性 | D.验证SO2的还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 钠碱法的启动吸收剂为NaOH溶液,捕捉SO2后生成Na2SO3和NaHSO3的混合液。
(1)常温下进行“钠碱法”的模拟实验。用12gNaOH固体配成一定浓度的溶液,这些NaOH理论上最多可吸收SO2的体积约为______ L(折算成标准状况)。若实验时只吸收了0.10molSO2,则反应后的吸收液中,所含负离子的浓度由大到小的顺序为______ 。
(2)当钠碱法的吸收液pH达到4~6时,混合液中含较多量NaHSO3.加热该溶液可回收得到较高纯度的SO2,剩余溶液可循环使用,进一步吸收SO2,剩余溶液的主要溶质是______ (填写化学式)。
(3)将SO2通入NaOH溶液时,得到一组c(H2SO3)+c(HSO )+c(SO
)+c(SO )=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
)=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
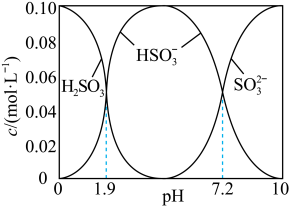
若溶液的pH=7,溶液中c(Na+)=c( )+
)+______ ,此时溶液中c(Na+)______ 0.100mol·L-1.(选填“>”、“<”或“=”)
(4)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(Kh)。以醋酸钠(CH3COONa)为例,其水解平衡常数存在以下定量关系:Kh=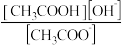
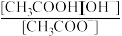 =
=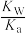 (Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。
(Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。______ 。
(5)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为SO2吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价______ 。
(1)常温下进行“钠碱法”的模拟实验。用12gNaOH固体配成一定浓度的溶液,这些NaOH理论上最多可吸收SO2的体积约为
(2)当钠碱法的吸收液pH达到4~6时,混合液中含较多量NaHSO3.加热该溶液可回收得到较高纯度的SO2,剩余溶液可循环使用,进一步吸收SO2,剩余溶液的主要溶质是
(3)将SO2通入NaOH溶液时,得到一组c(H2SO3)+c(HSO
 )+c(SO
)+c(SO )=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
)=0.100mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如下图所示。
若溶液的pH=7,溶液中c(Na+)=c(
 )+
)+(4)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(Kh)。以醋酸钠(CH3COONa)为例,其水解平衡常数存在以下定量关系:Kh=
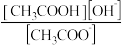
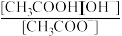 =
=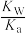 (Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。
(Kw为水的离子积常数,Ka为CH3COOH的电离常数)亚硫酸为二元弱酸,25℃时,其电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。请结合相关数据说明NaHSO3溶液呈酸性的理由。(5)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为SO2吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
您最近一年使用:0次
7 . 氧化铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如下图所示。 =Fe(C2O4)
=Fe(C2O4) (配合离子),Fe(C2O4)
(配合离子),Fe(C2O4) 不与稀碱液反应。
不与稀碱液反应。
(1)在溶液c中滴加NaOH标准溶液时,发生反应的离子方程式为______ ;
(2)若实验时加入了n1mol的H2SO4,消耗n2molNaOH,设氧化铁黄的式量为A,则氧化铁黄样品纯度为______ ;(用含w、n1、n2、A的代数式表示)
(3)测定时,若滴入Na2C2O4不足量,会使实验结果______ (选填“偏大”、“偏小”或“无影响”)。

 =Fe(C2O4)
=Fe(C2O4) (配合离子),Fe(C2O4)
(配合离子),Fe(C2O4) 不与稀碱液反应。
不与稀碱液反应。(1)在溶液c中滴加NaOH标准溶液时,发生反应的离子方程式为
(2)若实验时加入了n1mol的H2SO4,消耗n2molNaOH,设氧化铁黄的式量为A,则氧化铁黄样品纯度为
(3)测定时,若滴入Na2C2O4不足量,会使实验结果
您最近一年使用:0次
解题方法
8 . 资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
(1)下列生产、生活活动中,不易产生 的是___________。
的是___________。
(2)工业中可用含 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
(3)研究 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是___________ 。
钠碱法的启动吸收剂为 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。
(4)常温下进行“钠碱法”的模拟实验。用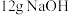 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为___________ L(折算成标准状况)。若实验时只吸收了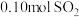 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为___________ 。
(5)当钠碱法的吸收液 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是________ (填写化学式)。
(6)将 通入
通入 溶液时,得到一组
溶液时,得到一组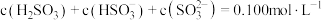 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
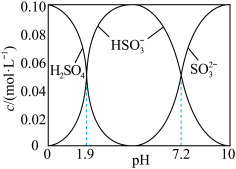
若溶液的 ,溶液中
,溶液中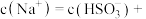
___________ ,此时溶液中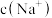
___________  。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)
(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数( )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数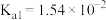 ,
,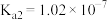 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________
(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价_____ 。
(1)下列生产、生活活动中,不易产生
 的是___________。
的是___________。| A.燃放鞭炮 | B.火力发电 | C.火山爆发 | D.海水晒盐 |
(2)工业中可用含
 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了___________。
转化”工序。使用该装置实现了___________。
| A.充分利用热能 | B.防止形成酸雾 | C.加速转化 | D.获取纯净 |
(3)研究
 的性质有利于探索其资源化利用。下列实验方案设计正确的是
的性质有利于探索其资源化利用。下列实验方案设计正确的是 |  |  |  |
A.制取 | B.收集 | C.验证 水溶液的酸性 水溶液的酸性 | D.验证 的还原性 的还原性 |
钠碱法的启动吸收剂为
 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。(4)常温下进行“钠碱法”的模拟实验。用
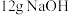 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为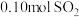 ,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含阴离子的浓度由大到小的顺序为(5)当钠碱法的吸收液
 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是(6)将
 通入
通入 溶液时,得到一组
溶液时,得到一组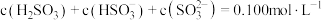 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
若溶液的
 ,溶液中
,溶液中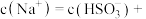
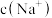
 。(选填“
。(选填“ ”“
”“ ”或“
”或“ ”)
”)(7)上述混合液中存在多个水解平衡,与化学平衡一样,水解平衡也有自己的平衡常数(
 )。以醋酸钠(
)。以醋酸钠( )为例,其水解平衡常数存在以下定量关系:
)为例,其水解平衡常数存在以下定量关系: (
( 为水的离子积常数,
为水的离子积常数, 为
为 的电离常数)亚硫酸为二元弱酸,
的电离常数)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数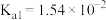 ,
,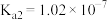 。请结合相关数据说明
。请结合相关数据说明 溶液呈酸性的理由。
溶液呈酸性的理由。(8)“钙碱法”的工作原理与“钠碱法”相似,一般选择消石灰的悬浊液为
 吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
吸收剂。请对照“钠碱法”,尝试通过比较反应物和生成物的不同性质,从生产成本和设备维护两方面对“钙碱法”做出评价
您最近一年使用:0次
名校
解题方法
9 . 氧化铁黄(化学式为 )是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾
)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾 为原料制备
为原料制备 。
。
(1)下列关于铁元素的认识正确的是___________。
(2)制备氧化铁黄的关键步骤是 溶液的氧化。为探究影响氧化
溶液的氧化。为探究影响氧化 溶液快慢的因素,现利用
溶液快慢的因素,现利用 、蒸馏水和稀
、蒸馏水和稀 配制四组溶液进行实验,实验结果如下表:
配制四组溶液进行实验,实验结果如下表:
①对比实验Ⅰ和Ⅱ可知,实验中影响氧化快慢的因素是___________ ;
②综合对比分析四组实验,简述影响氧化 溶液快慢的决定因素。
溶液快慢的决定因素。___________ 。
制备 的工艺流程包含如下环节
的工艺流程包含如下环节
(4)模拟氧化时,相关 变化记录如图。
变化记录如图。 时段,
时段, 逐渐减小的原因是反应生成了
逐渐减小的原因是反应生成了 ,配平下列化学方程式:
,配平下列化学方程式:___________ 。
________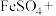 _______
_______ _______=______
_______=______ ______
______
 时段,经历的反应为:
时段,经历的反应为: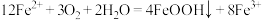 ,该过程
,该过程 继续平缓下降的原因可能是:
继续平缓下降的原因可能是:___________ 。(任写一条)
(5)判断流程中产品是否洗涤干净的方法是:___________ 。
氧化铁黄( )纯度可以通过产品的耗酸量确定,如下图所示。
)纯度可以通过产品的耗酸量确定,如下图所示。 (配合离子),
(配合离子),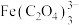 不与稀碱液反应。
不与稀碱液反应。
(6)①在溶液 中滴加
中滴加 标准溶液时,发生反应的离子方程式为
标准溶液时,发生反应的离子方程式为___________ ;
②若实验时加入了 的
的 ,消耗
,消耗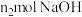 ,设氧化铁黄的式量为
,设氧化铁黄的式量为 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为___________ ;(用含 、
、 、
、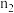 、
、 的代数式表示)
的代数式表示)
③测定时,若滴入 不足量,会使实验结果
不足量,会使实验结果___________ (选填“偏大”、“偏小”或“无影响”)。
 )是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾
)是一种黄色颜料,具有非常好的耐光性和耐碱性,是氧化铁的一水合物。工业上常以绿矾 为原料制备
为原料制备 。
。(1)下列关于铁元素的认识正确的是___________。
| A.能存在于人体的血红蛋白中 | B.是地壳中含量最多的金属元素 |
| C.单质是人类最早使用的金属 | D.铁的氧化物都具有致密的结构 |
(2)制备氧化铁黄的关键步骤是
 溶液的氧化。为探究影响氧化
溶液的氧化。为探究影响氧化 溶液快慢的因素,现利用
溶液快慢的因素,现利用 、蒸馏水和稀
、蒸馏水和稀 配制四组溶液进行实验,实验结果如下表:
配制四组溶液进行实验,实验结果如下表:| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
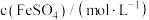 | 0.5 | 0.25 | 0.25 | 0.5 |
| 溶液pH | 2.9 | 2.9 | 3.5 | 3.3 |
| 初始颜色 | 浅绿色 | 浅绿色,较Ⅰ浅 | 浅绿色,同Ⅱ | 浅绿色,同Ⅰ |
 后颜色 后颜色 | 浅绿色 | 浅绿色 | 黄绿色 | 浅绿色 |
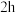 后颜色 后颜色 | 黄绿色 | 浅绿色 | 黄色 | 黄绿色 |
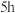 后颜色 后颜色 | 浅黄色 | 浅黄色,较I浅 | 黄色,较Ⅳ浅 | 黄色 |
②综合对比分析四组实验,简述影响氧化
 溶液快慢的决定因素。
溶液快慢的决定因素。制备
 的工艺流程包含如下环节
的工艺流程包含如下环节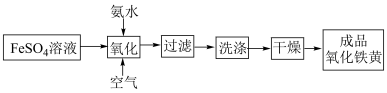
| A.烧杯 | B.漏斗 | C.玻璃棒 | D.蒸发皿 |
(4)模拟氧化时,相关
 变化记录如图。
变化记录如图。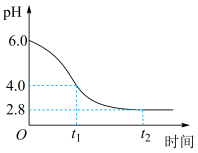
 时段,
时段, 逐渐减小的原因是反应生成了
逐渐减小的原因是反应生成了 ,配平下列化学方程式:
,配平下列化学方程式:________
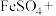 _______
_______ _______=______
_______=______ ______
______
 时段,经历的反应为:
时段,经历的反应为: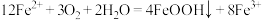 ,该过程
,该过程 继续平缓下降的原因可能是:
继续平缓下降的原因可能是:(5)判断流程中产品是否洗涤干净的方法是:
氧化铁黄(
 )纯度可以通过产品的耗酸量确定,如下图所示。
)纯度可以通过产品的耗酸量确定,如下图所示。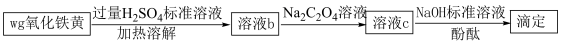
 (配合离子),
(配合离子),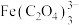 不与稀碱液反应。
不与稀碱液反应。(6)①在溶液
 中滴加
中滴加 标准溶液时,发生反应的离子方程式为
标准溶液时,发生反应的离子方程式为②若实验时加入了
 的
的 ,消耗
,消耗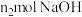 ,设氧化铁黄的式量为
,设氧化铁黄的式量为 ,则氧化铁黄样品纯度为
,则氧化铁黄样品纯度为 、
、 、
、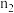 、
、 的代数式表示)
的代数式表示)③测定时,若滴入
 不足量,会使实验结果
不足量,会使实验结果
您最近一年使用:0次
2024-01-13更新
|
428次组卷
|
3卷引用:上海市浦东新区2023-2024学年高三上学期一模化学试卷
上海市浦东新区2023-2024学年高三上学期一模化学试卷(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)上海市闵行区多校联考2023-2024学年高三下学期三模考试化学试题
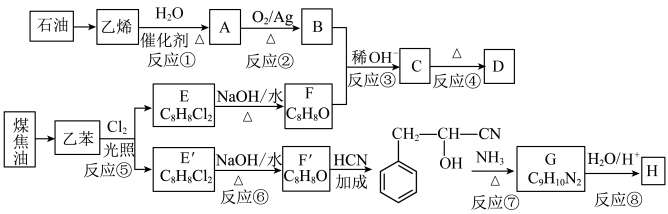
10 . 以石油和煤为原料可以合成各种用途广泛的有机产品。合成3-苯基-2-丁烯醛D(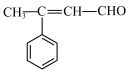 )和苯丙氨酸H(
)和苯丙氨酸H(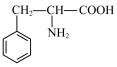 )的路线如下:
)的路线如下:
已知:①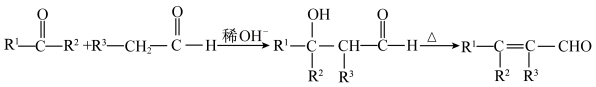 (
( 、
、 、
、 均可以是烃基或氢原子)
均可以是烃基或氢原子)
②同一个碳原子不能同时连两个羟基不稳定,会自动脱水: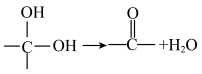
(1)煤加工获得煤焦油的方法是___________。
(2)反应①~④中,属于加成反应的是___________。
(3)B中官能团的名称为___________ 。
(4)写出反应⑥的化学反应方程式___________ 。
(5)检验D中的碳碳双键可使用的试剂是___________ 。
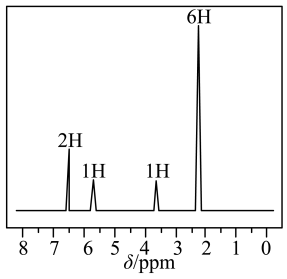
(6)D的同分异构体有多种,写出一种满足下列条件的结构简式。___________
①会使氯化铁溶液发生颜色变化,②核磁共振氢谱图如下:
(7)下列有关H(苯丙氨酸)的描述正确的是___________。
(8)反应⑧需要控制pH的理由是___________ 。
(9)参照上述信息和流程,设计以 为原料合成
为原料合成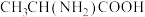 的合成路线
的合成路线___________ 。(合成路线常用的表示方式为:甲 乙……
乙…… 目标产物)
目标产物)
 )和苯丙氨酸H(
)和苯丙氨酸H( )的路线如下:
)的路线如下:
已知:①
 (
( 、
、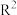 、
、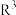 均可以是烃基或氢原子)
均可以是烃基或氢原子)②同一个碳原子不能同时连两个羟基不稳定,会自动脱水:

(1)煤加工获得煤焦油的方法是___________。
| A.分馏 | B.干馏 | C.裂化 | D.裂解 |
(2)反应①~④中,属于加成反应的是___________。
| A.反应① | B.反应② | C.反应③ | D.反应④ |
(3)B中官能团的名称为
(4)写出反应⑥的化学反应方程式
(5)检验D中的碳碳双键可使用的试剂是
(6)D的同分异构体有多种,写出一种满足下列条件的结构简式。
①会使氯化铁溶液发生颜色变化,②核磁共振氢谱图如下:

(7)下列有关H(苯丙氨酸)的描述正确的是___________。
| A.能溶于水 | B.与甘氨酸(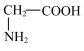 )互为同系物 )互为同系物 |
| C.不存在立体异构 | D.能自身反应形成高分子化合物 |
(8)反应⑧需要控制pH的理由是
(9)参照上述信息和流程,设计以
 为原料合成
为原料合成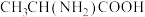 的合成路线
的合成路线 乙……
乙…… 目标产物)
目标产物)
您最近一年使用:0次
2024-01-13更新
|
458次组卷
|
3卷引用:上海市浦东新区2023-2024学年高三上学期一模化学试卷



