1 . 有 和
和 的混合物共
的混合物共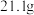 ,将其放入
,将其放入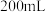 某浓度的盐酸中恰好完全反应。另取等质量该混合物与
某浓度的盐酸中恰好完全反应。另取等质量该混合物与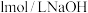 溶液反应,当混合物质量不再减少时,消耗
溶液反应,当混合物质量不再减少时,消耗 溶液
溶液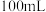 。
。
求:
(1)原混合物中 和
和 的质量各多少克
的质量各多少克_______ ?
(2)盐酸的物质的量浓度为多少_______ ?
 和
和 的混合物共
的混合物共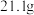 ,将其放入
,将其放入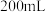 某浓度的盐酸中恰好完全反应。另取等质量该混合物与
某浓度的盐酸中恰好完全反应。另取等质量该混合物与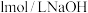 溶液反应,当混合物质量不再减少时,消耗
溶液反应,当混合物质量不再减少时,消耗 溶液
溶液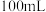 。
。求:
(1)原混合物中
 和
和 的质量各多少克
的质量各多少克(2)盐酸的物质的量浓度为多少
您最近一年使用:0次
解题方法
2 . 盐类水解平衡和沉淀溶解平衡是水溶液中两种重要的离子平衡。回答下列问题:
(1)为抑制水解,实验室中配制 FeCl3溶液时常加入______ (填名称)。
(2)25℃ 时,pH 均为 3 的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为______ 。
(3)25℃时,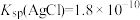 。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=
。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=______ mol·L-1(忽略溶液体积的变化)。
(4)某温度时,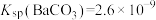 ,
,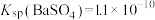 。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中
。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中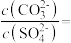
______ (保留1位小数)。
(1)为抑制水解,实验室中配制 FeCl3溶液时常加入
(2)25℃ 时,pH 均为 3 的醋酸和硫酸铝两种溶液中,由水电离出的c(H+)之比为
(3)25℃时,
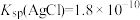 。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=
。现将足量氯化银固体放入100 mL0.2 mol/L AgNO3溶液中,则溶液中c(Cl-)=(4)某温度时,
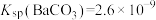 ,
,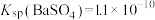 。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中
。在该温度下,向含有 BaSO4固体的溶液中滴加 Na2CO3溶液,当有 BaCO3沉淀生成时,溶液中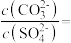
您最近一年使用:0次
解题方法
3 . 一定条件下,用 CO2和 H2反应生产燃料甲醇的热化学方程式为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,图1表示该反应过程中能量(单位为kJ·mol-1)的变化。回答下列问题:
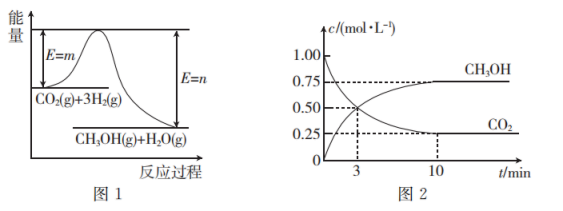
(1)该反应的 △H______ 0(填“>”或“<”),原因是______ 。
(2)在恒温恒容密闭容器中,下列能说明该反应已经达到平衡状态的是______ (填标号)。
A.v( H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)= v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1L的恒温(温度为 T℃)恒容密闭容器中,充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化如图 2 所示。从反应开始到平衡,用氢气的浓度变化表示的平均反应速率v(H2)=______ 平衡时容器内气体压强与起始时容器内气体压强之比为______ ,T℃时该反应的平衡常数K=______ L²·mol-2(保留 2 位小数)。

(1)该反应的 △H
(2)在恒温恒容密闭容器中,下列能说明该反应已经达到平衡状态的是
A.v( H2)=3v(CO2)
B.容器内气体压强保持不变
C.v逆(CO2)= v正(CH3OH)
D.容器内气体密度保持不变
(3)在体积为1L的恒温(温度为 T℃)恒容密闭容器中,充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化如图 2 所示。从反应开始到平衡,用氢气的浓度变化表示的平均反应速率v(H2)=
您最近一年使用:0次
4 . 一定温度下,在容积为2 L的恒容密闭容器中分别充入2.4 mol NO和2.4 mol CO,发生可逆反应: △H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
△H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
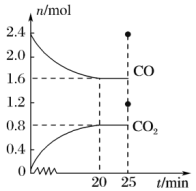
(1)当反应达到平衡时,NO和CO的转化率之比是___________ 。0~20 min内反应速率v(N2)=___________ 。
(2)该温度下的平衡常数K=___________ ,25 min时,若温度不变,向容器中再分别充入0.4 mol CO和0.4 mol N2,则化学平衡___________ 将 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。
(3)25 min时,保持其它条件不变,将反应体系中的c(CO)、c(NO)、c(N2)、c(CO2)均同时减半,化学平衡将___________ 将 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。
(4)若换用一个恒容、绝热的容器,使容器内温度迅速升至原来的2倍,则平衡将___________  填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。达到新平衡后,容器内温度
移动。达到新平衡后,容器内温度___________  填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 原来的2倍。
原来的2倍。
(5)反应达到平衡后,若改变某一个条件,下列八条曲线(①~⑧)正确的是___________  填序号
填序号 。
。
(6)汽车尾气治理的方法之一是使用催化转化装置,其中的反应原理之一是: ,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应
,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应___________  填“能”或“不能”
填“能”或“不能” 自发进行。
自发进行。
 △H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
△H<0,反应过程中部分反应物和生成物的物质的量的变化关系如图所示:
(1)当反应达到平衡时,NO和CO的转化率之比是
(2)该温度下的平衡常数K=
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。(3)25 min时,保持其它条件不变,将反应体系中的c(CO)、c(NO)、c(N2)、c(CO2)均同时减半,化学平衡将
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。
移动。(4)若换用一个恒容、绝热的容器,使容器内温度迅速升至原来的2倍,则平衡将
 填“向左”“向右”或“不”
填“向左”“向右”或“不” 移动。达到新平衡后,容器内温度
移动。达到新平衡后,容器内温度 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 原来的2倍。
原来的2倍。(5)反应达到平衡后,若改变某一个条件,下列八条曲线(①~⑧)正确的是
 填序号
填序号 。
。
(6)汽车尾气治理的方法之一是使用催化转化装置,其中的反应原理之一是:
 ,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应
,△H=-113.0 kJ/mol,室温条件下,该反应的△S=-145.3 J/(mol·K),则该反应 填“能”或“不能”
填“能”或“不能” 自发进行。
自发进行。
您最近一年使用:0次
12-13高三上·安徽滁州·阶段练习
名校
解题方法
5 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
752次组卷
|
22卷引用:2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷
(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2015-2016学年贵州省思南中学高二下学期期末化学卷安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)安徽省六安中学2021届高三上学期开学考试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
20-21高一上·浙江绍兴·阶段练习
解题方法
6 . 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:
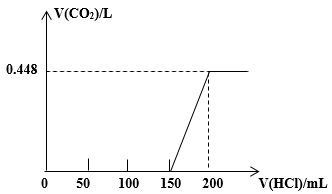
(1)盐酸的物质的量浓度为_______ mol/L;
(2)该样品中混合物的成分及其物质的量之比为_______ 。

(1)盐酸的物质的量浓度为
(2)该样品中混合物的成分及其物质的量之比为
您最近一年使用:0次
解题方法
7 . 将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加一定物质的量浓度的NaOH溶液至过量,生成沉淀的质量与加入的氢氧化钠溶液的体积关系如图所示。回答下列问题:
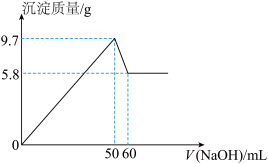
(1)写出镁铝合金与稀盐酸反应的离子方程式:___ 。
(2)当沉淀达到最大时,Al(OH)3的物质的量为___ ,所用NaOH溶液的物质的量浓度为___ 。
(3)沉淀溶解时,所涉及的反应化学方程式为___ 。
(4)该合金中镁的质量分数为___ 。

(1)写出镁铝合金与稀盐酸反应的离子方程式:
(2)当沉淀达到最大时,Al(OH)3的物质的量为
(3)沉淀溶解时,所涉及的反应化学方程式为
(4)该合金中镁的质量分数为
您最近一年使用:0次
解题方法
8 . 氯及其化合物有广泛用途。二氧化氯是一种新型的消毒剂。
①NaClO2中Cl的化合价为____________ 。
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式__________ 。若生成11.2L氯气(标准状况),转移电子数为_________ 。
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的_________ 倍。
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mg•L-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
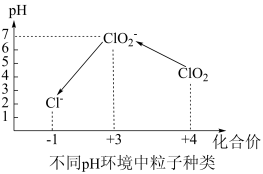
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是_____ mg•L-1。
①NaClO2中Cl的化合价为
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mg•L-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:

Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是
您最近一年使用:0次
9 . 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3 g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4 mol/L的盐酸,再根据生成CO2的体积计算出Na2CO3的质量,从而进一步计算出样品中变质NaOH的质量。
请回答下列问题:
(1)该实验的目的是_________________ 。
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g。若要将所称取的样品恰好溶解,最多需要蒸馏水____________ g,溶解样品所需的仪器是________________ 。
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:

则13.3 g 该样品中未变质的NaOH的质量为____________ ;NaOH的变质程度为_________ (用质量分数表示);与NaOH反应消耗的盐酸体积为________ mL。
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图象,他们从实验中还发现了什么问题?_____________________ ,并由此得出了什么结论?____________________________ 。
请回答下列问题:
(1)该实验的目的是
(2)已知20 ℃时,Na2CO3溶解度为21.7 g ,NaOH溶解度为108.3 g。若要将所称取的样品恰好溶解,最多需要蒸馏水
(3)实验测得加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:

则13.3 g 该样品中未变质的NaOH的质量为
(4)根据“与NaOH反应消耗盐酸的体积”,并对照上述图象,他们从实验中还发现了什么问题?
您最近一年使用:0次
名校
10 . H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
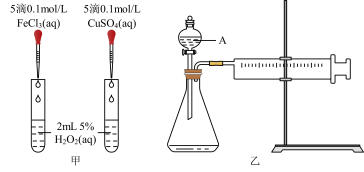
(1)若利用图甲装置,可通过观察__________ 现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________ 。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________ 。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________ ,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________ 。
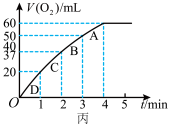
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________ 。H2O2初始物质的量浓度为_______ (保留两位小数)。

(1)若利用图甲装置,可通过观察
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:

您最近一年使用:0次
2019-09-20更新
|
445次组卷
|
10卷引用:安徽省定远县育才学校2019-2020学年高一下学期期末考试化学试题
安徽省定远县育才学校2019-2020学年高一下学期期末考试化学试题云南省盈江县一中2019-2020学年高二上学期开学考试化学试题人教版高中化学必修二第二单元《化学反应与能量》测试卷2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷2020年人教版高中化学必修2第二章《化学反应与能量》测试卷12020年春季苏教版高中化学必修2专题二《化学反应与能量转化》测试卷(已下线)2.1.2 影响化学反应速率的因素(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)云南省普洱市第一中学2021-2022学年高一下学期3月份考试化学试题云南省石屏县第一中学2021-2022学年高一下学期3月份考试化学试题云南省广南县第一中学校2021-2022学年高一下学期3月份考试化学试题



