解题方法
1 . 我国科学家制备的NiO/Al2O3/Pt催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:H3NBH3+4CH3OH NH4B(OCH3)4+3H2↑。请回答下列问题:
NH4B(OCH3)4+3H2↑。请回答下列问题:
(1)基态氮原子的价电子排布式为___________ 。
(2)硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因为___________ 。
(3)某有机硼化合物的结构简式如图所示,其中氨原子的杂化轨道类型为___________ 。

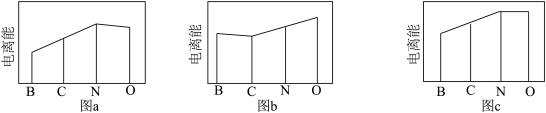
(4)图a、b、c分别表示B、C、N、O的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是___________ (填标号),判断的根据是___________ ;第二电离能的变化图是___________ (填标号)。
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,
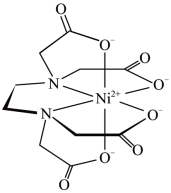
1个该配合物中通过螯合作用形成的配位键有___________ 个,在形成配位键前后C-N-C键角将___________ (填“增大"“减少”或“不变”)。
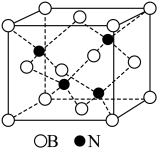
(6)BN晶体的晶胞如图所示,B、N的原子半径分别为apm和bpm,密度为2.25g·cm-3,阿伏加德罗常数的值为NA,BN晶胞中原子的体积占晶胞体积的百分率为___________ 。
 NH4B(OCH3)4+3H2↑。请回答下列问题:
NH4B(OCH3)4+3H2↑。请回答下列问题:(1)基态氮原子的价电子排布式为
(2)硼烷又称硼氢化合物,随着硼原子数的增加,硼烷由气态经液态至固态,其原因为
(3)某有机硼化合物的结构简式如图所示,其中氨原子的杂化轨道类型为

(4)图a、b、c分别表示B、C、N、O的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,

1个该配合物中通过螯合作用形成的配位键有
(6)BN晶体的晶胞如图所示,B、N的原子半径分别为apm和bpm,密度为2.25g·cm-3,阿伏加德罗常数的值为NA,BN晶胞中原子的体积占晶胞体积的百分率为

您最近一年使用:0次
名校
解题方法
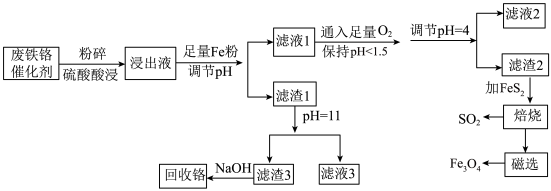
2 . 某废铁铬催化剂(含Fe3O4、Cr2O3、MgO、Al2O3及少量不溶性杂质)回收铁、铬的工艺流程如下图所示:
ii.Cr(OH)3+OH-=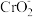 +2H2O
+2H2O
iii.已知Cr的金属性强于Fe
(1)加入铁粉后,调节pH的范围为___________ 。
(2)由滤渣1得到滤液3发生反应的离子方程式为___________ 。
(3)滤渣3成分的化学式为___________ ;回收铬时,铬的存在形式为___________ (填化学式)。
(4)由滤液2得到结晶水合物的操作是___________ 、___________ 过滤、洗涤、干燥。
(5)滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为___________ ;该过程加入少量CaO的目的是___________ 。
(6)酸浸过程中,在硫酸用量一定的情况下,随着酸浓度的增加,铁、铬的溶解度增大。实际生产中,硫酸的质量分数为50%,其原因是___________ 。(已知,Fe2(SO4)3▪ 9H2O,Cr2(SO4)3·18H2O在20°C时的溶解度分别为400g和64g)
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Mg2+ | |||
| 开始沉淀的pH | 1.5 | 4.0 | 4.6 | 7.6 | 9.5 | |||
| 沉淀完全的pH | 2.8 | 5.2 | 6.8 | 9.7 | 11.1 | |||
| 金属氢氧化物 | Al(OH)3 | Cr(OH)3 | ||||||
| 开始溶解的pH | 7.8 | 12 | ||||||
| 溶解完全的pH | 10.8 | >14 | ||||||
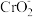 +2H2O
+2H2Oiii.已知Cr的金属性强于Fe
(1)加入铁粉后,调节pH的范围为
(2)由滤渣1得到滤液3发生反应的离子方程式为
(3)滤渣3成分的化学式为
(4)由滤液2得到结晶水合物的操作是
(5)滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为
(6)酸浸过程中,在硫酸用量一定的情况下,随着酸浓度的增加,铁、铬的溶解度增大。实际生产中,硫酸的质量分数为50%,其原因是
您最近一年使用:0次
2023-03-21更新
|
894次组卷
|
6卷引用:四川省巴中市2023届高三一诊考试理综化学试题
名校
3 . 硫代硫酸钠(Na2S2O3)在工业、医药等领域应用广泛。下图为实验室制取硫代硫酸钠的装置,反应过程中需通过pH传感器控制pH为7-8。
(1)盛Na2SO3的仪器名称为___________ 。
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是___________ 。
(3)若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:___________ 。
(4)当数据采集处pH接近7时,应采取的操作为___________ 。
(5)装置B中的药品可以选择下列物质中的___________(填字母)。
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为:___________ 。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量___________ (填“偏大”、“偏小”、“无影响”)。
③脱碳液中V2O5的质量分数为___________ %。

(1)盛Na2SO3的仪器名称为
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是
(3)若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:
(4)当数据采集处pH接近7时,应采取的操作为
(5)装置B中的药品可以选择下列物质中的___________(填字母)。
| A.饱和NaHCO3溶液 | B.饱和NaHSO3溶液 |
| C.NaOH溶液 | D.酸性KMnO4溶液 |
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为:
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量
③脱碳液中V2O5的质量分数为
您最近一年使用:0次
2023-03-21更新
|
870次组卷
|
4卷引用:四川省巴中市2023届高三一诊考试理综化学试题
解题方法
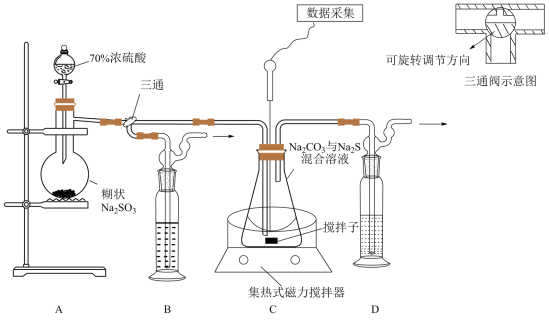
4 .  是棕黄色、易潮解、300℃能升华的物质,工业上常用
是棕黄色、易潮解、300℃能升华的物质,工业上常用 作印刷电路板的蚀刻剂。某化学兴趣小组在实验室用氯气与金属铁反应制备无水三氯化铁,其实验装置如下。
作印刷电路板的蚀刻剂。某化学兴趣小组在实验室用氯气与金属铁反应制备无水三氯化铁,其实验装置如下。
已知: 熔点为674℃,沸点为1023℃。
熔点为674℃,沸点为1023℃。
(1)X的名称是__________ 。
(2)写出装置A中浓盐酸和 发生反应的化学方程式
发生反应的化学方程式__________ 。
(3)B的作用是__________ ,缺少该装置可能引起的后果是__________ (任写一点)。
(4)若缺少C,装置D中硬质玻璃管右端出现了少量黑色固体。该黑色固体是__________ ,写出生成该固体的化学方程式__________ 。
(5)实验结束后,应进行的操作依次是__________ (填正确序号)。
①熄灭A处的酒精灯 ②熄灭D处的酒精灯 ③停止通 ④通入
④通入
(6)本实验的主要缺陷是__________ (任写一点)。
(7)D中含有 干燥铁粉,制得无水
干燥铁粉,制得无水 样品
样品 ,本次实验产率为
,本次实验产率为__________ %。
 是棕黄色、易潮解、300℃能升华的物质,工业上常用
是棕黄色、易潮解、300℃能升华的物质,工业上常用 作印刷电路板的蚀刻剂。某化学兴趣小组在实验室用氯气与金属铁反应制备无水三氯化铁,其实验装置如下。
作印刷电路板的蚀刻剂。某化学兴趣小组在实验室用氯气与金属铁反应制备无水三氯化铁,其实验装置如下。
已知:
 熔点为674℃,沸点为1023℃。
熔点为674℃,沸点为1023℃。(1)X的名称是
(2)写出装置A中浓盐酸和
 发生反应的化学方程式
发生反应的化学方程式(3)B的作用是
(4)若缺少C,装置D中硬质玻璃管右端出现了少量黑色固体。该黑色固体是
(5)实验结束后,应进行的操作依次是
①熄灭A处的酒精灯 ②熄灭D处的酒精灯 ③停止通
 ④通入
④通入
(6)本实验的主要缺陷是
(7)D中含有
 干燥铁粉,制得无水
干燥铁粉,制得无水 样品
样品 ,本次实验产率为
,本次实验产率为
您最近一年使用:0次
2023-02-17更新
|
204次组卷
|
3卷引用:四川省巴中市2022-2023学年高一上学期期末考试化学试题
5 . 下表是元素周期表中前四周期的部分元素,表中所列字母分别代表一种元素。
回答下列问题:
(1)i在元素周期表中的位置是__________ 。
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为__________ (填写离子符号)。
(3)n与o形成的化合物为__________ (填写化学式),将该化合物进行焰色试验,火焰呈__________ 色。
(4)用电子式表示g和m形成化合物的过程__________ 。
(5)将足量d的氢化物溶于水,再取少量 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为__________ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入 盐酸中。
盐酸中。
实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:
______  (选填“>”或“<”);
(选填“>”或“<”);
②利用元素周期律对上述实验结论进行解释__________ 。
(7)向 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:__________ 。
a | b | |||||||
c | d | e | f | |||||
g | h | i | j | k | l | m | ||
o | n | |||||||
(1)i在元素周期表中的位置是
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为
(3)n与o形成的化合物为
(4)用电子式表示g和m形成化合物的过程
(5)将足量d的氢化物溶于水,再取少量
 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入
 盐酸中。
盐酸中。实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:

 (选填“>”或“<”);
(选填“>”或“<”);②利用元素周期律对上述实验结论进行解释
(7)向
 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:
您最近一年使用:0次
2023-02-17更新
|
196次组卷
|
3卷引用:四川省巴中市2022-2023学年高一上学期期末考试化学试题
6 . 回答下列问题
(1)在2L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
①则K1_______ K2(填“>”、“<”或“=”),原因:_______ 。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为_______ ,平衡时H2的转化率为_______ 。若再同时增加各物质的量为1mol,此时反应的V正_______ V逆(>或=或<),平衡常数将_______ (填“增大”、“减小”或“不变”)
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
热化学方程式:_______ 。
(1)在2L密闭容器中,起始投入4mol N2和6mol H2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
| 温度K | 平衡时NH3的物质的量/mol |
| T1 | 3.6 |
| T2 | 2 |
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
| 化学键 | H-H | N≡N | N-H |
| 键能/kJ·mol-1 | 430 | 936 | 390 |
您最近一年使用:0次
7 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D的阳离子与B中阴离子具有相同的电子层结构,D的化合价为+1,B、C均可分别与A形成10电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1,请用具体的元素回答下列问题:
(1)E元素基态原子电子排布式为_______ 。
(2)用电子排布图表示F元素原子的价电子构型_______ 。
(3)F、G元素的最高价含氧酸中酸性较强的分子式为_______ 。
(4)离子半径:D+_______ B3-,第一电离能:B_______ C,电负性:C_______ F(填“<”“>”或“=”)
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为_______ ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式_______ 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式_______ 。
(1)E元素基态原子电子排布式为
(2)用电子排布图表示F元素原子的价电子构型
(3)F、G元素的最高价含氧酸中酸性较强的分子式为
(4)离子半径:D+
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式
您最近一年使用:0次
8 . Ⅰ.完成下列选择题
(1)对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________
Ⅱ.碳元素单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
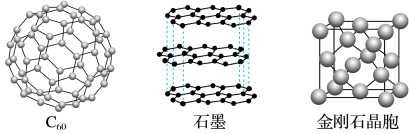
回答下列问题:
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_______ 。
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_______ 、_______ 。
(4)C60属于_______ 晶体,石墨属于_______ 晶体。
(5)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是金刚石中只存在C-C间_______ 共价键(σ或π),而石墨层内的C-C间不仅存在_______ 共价键(σ或π),还有_______ 键(σ或π)。
(6)金刚石晶胞含有_______ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_______ a,列式表示碳原子在晶胞中的空间占有率_______ (不要求计算结果)。
(1)对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________
| A.SiX4是离子晶体 | B.SiX4是共价化合物 |
| C.NaX不溶于水 | D.NaX的熔点一般高于SiX4 |
Ⅱ.碳元素单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(2)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(3)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(4)C60属于
(5)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm,其原因是金刚石中只存在C-C间
(6)金刚石晶胞含有
您最近一年使用:0次
解题方法
9 . 如表是元素周期表一部分。表中所列的字母分别代表某一化学元素。
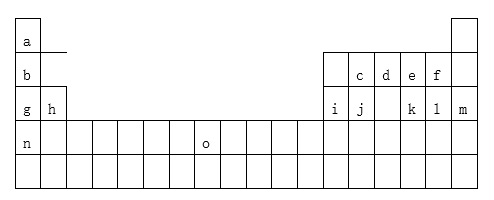
(1)元素“O”在周期表中的位置是____ 。
(2)画出“c”的电子排布图____ 。
(3)b、c、d的氢化物的化学式为:____ ,____ ,____ ;d氢化物的电子式为____ :。中心原子杂化轨道____ ,分子构型____ 。
(4)比较h,i第一电离能的大小____ (元素符号),原因____ 。

(1)元素“O”在周期表中的位置是
(2)画出“c”的电子排布图
(3)b、c、d的氢化物的化学式为:
(4)比较h,i第一电离能的大小
您最近一年使用:0次
名校
10 . 奴佛卡因H是口腔科局部麻醉药,某兴趣小组以甲苯和乙烯为主要原料,采用以下合成路线进行制备。
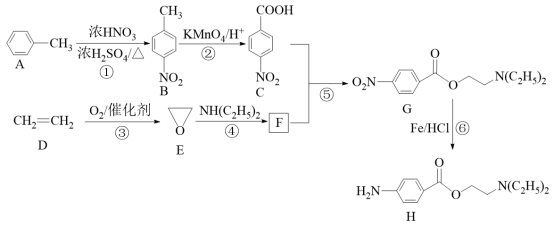
已知:苯环上有羧基时,新引入的取代基连在苯环的间位。
请回答下列问题:
(1)A的名称_______ ,C中官能团的名称___________ 。
(2)F的结构简式____________ ,反应⑤的反应条件______________ 。
(3)下列有关反应的说法正确的是:_______。(填标号)
(4)写出A→B的反应方程式______________ 。
(5)写出两种同时符合下列条件的B的同分异构体____________________ 、______________ 。
①红外光谱检测分子中含有醛基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(6)参照上述路线,写出以苯和 为原料制取的合成
为原料制取的合成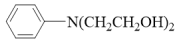 路线图
路线图_____________________ 。

已知:苯环上有羧基时,新引入的取代基连在苯环的间位。
请回答下列问题:
(1)A的名称
(2)F的结构简式
(3)下列有关反应的说法正确的是:_______。(填标号)
| A.步骤①和②可以互换 | B.步骤①→⑤共有2个取代反应 |
| C.E中所有原子处于同一平面 | D.1 mol H物质最多和4 mol氢气发生加成反应 |
(5)写出两种同时符合下列条件的B的同分异构体
①红外光谱检测分子中含有醛基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(6)参照上述路线,写出以苯和
 为原料制取的合成
为原料制取的合成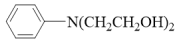 路线图
路线图
您最近一年使用:0次
2022-09-07更新
|
374次组卷
|
3卷引用:四川省巴中市2023届高三上学期零诊考试理综化学试题
四川省巴中市2023届高三上学期零诊考试理综化学试题(已下线)预测卷02-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)四川省江油中学2023-2024学年高三上期10月月考理综化学试题



