1 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4+ a Na2O2= 2Na2FeO4+ b X + 2Na2SO4+ c O2↑
该反应中物质X应是__________________ ,b与c的关系是________________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________________________ 。
②每生成1mol FeO42-转移_____________ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____________ mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________ ,被氧化的离子的物质的量分别是_______________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为_______________ (用含a、b的代数式表示)。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4+ a Na2O2= 2Na2FeO4+ b X + 2Na2SO4+ c O2↑
该反应中物质X应是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO42-转移
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为
您最近一年使用:0次
2016-12-09更新
|
403次组卷
|
2卷引用:2016届四川省德阳市香港马会第五中学高三上学期10月月考理综化学试卷1
2 . 设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol  OD- 离子含有的质子、中子数均为10NA OD- 离子含有的质子、中子数均为10NA |
| B.标准状况下,4.48 L己烷含有的分子数为0.2NA |
| C.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| D.VL a mol•L﹣1的氯化铁溶液中,若Fe3+的数目为NA,则Cl﹣的数目等于3NA |
您最近一年使用:0次
2016-12-09更新
|
98次组卷
|
2卷引用:2016届四川省德阳市香港马会第五中学高三上学期10月月考理综化学试卷1
3 . 自来水厂生产自来水时,需要用到净水剂,对水进行消毒杀菌处理。
(1)漂白粉是常用的一种消毒剂,制备过程的化学方程式为___________ 。漂白粉不能与家庭中常用的洁厕剂(一种酸性液体,主要含HCl)混合使用,否则容易造成人体中毒,其原因是(用有关的离子方程式表示)_________ 。
(2)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应可用离子方程式表示为_________ 。
(3)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应式是__________ 。
(1)漂白粉是常用的一种消毒剂,制备过程的化学方程式为
(2)高铁酸钾(K2FeO4)是一种新型多功能水处理剂。工业上有多种方法制备高铁酸钾,其中一种方法是在氢氧化钾溶液中用次氯酸钠氧化氢氧化铁。该反应可用离子方程式表示为
(3)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%电能,已知该电池的总反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应式是
您最近一年使用:0次
解题方法
4 . 某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)
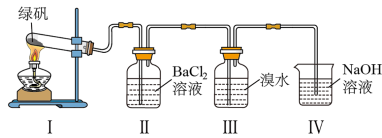
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________ 。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________ ,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________ 。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________ 。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________ 。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)

(1)II中有白色沉淀生成,说明FeSO4固体分解生成了
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
| 实验步骤 | 实验预期现象和结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |  |
| 步骤二:滴加 | 当溶液中出现 |
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是
您最近一年使用:0次
5 . 下列离子方程式正确的是
| A.氨水与亚硫酸溶液混合:NH3·H2O+H+===NH4++H2O |
| B.将少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO- =" 2HClO" +CaSO3↓ |
| C.足量铁屑溶于稀硫酸:2Fe+6H+= 2Fe3++3H2↑ |
| D.将Cl2通入FeSO4溶液中:Cl2+2Fe2+==2Fe3++2Cl- |
您最近一年使用:0次
名校
6 . 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
| A.HCl的电子式H:Cl | B.HClO的结构式H-Cl-O |
C.Cl-的结构示意图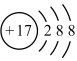 | D.质量数为37的氯原子 37Cl |
您最近一年使用:0次
2016-12-09更新
|
215次组卷
|
2卷引用:2014-2015学年四川省德阳市第五中学高一下学期期中考试化学试卷
7 . 非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题。
(1)①O2-的核外电子排布式为__________ ,CS2的晶体类型为________ 晶体,其C的轨道杂化方式为____________ ;
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是____________________ ;
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______________ 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是________________ 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(Cl )比值等于
)比值等于_________
(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。分析图中a、b、c、d四个点,水的电离程度最大的是____ ;在b点,溶液中各离子浓度由大到小的排列顺序是____________ 。

(1)①O2-的核外电子排布式为
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(Cl
 )比值等于
)比值等于(3)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。分析图中a、b、c、d四个点,水的电离程度最大的是

您最近一年使用:0次
8 . 设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.标准状况下,2.24 L C6H14中含有极性共价键的数目为1.4 NA |
| B.0.1 mol·L-1 NH4Cl溶液中含有NH4+的数目小于0.1 NA |
| C.100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA |
| D.标准状况下,11.2 L由CH4和C2H4组成的混合气体中含氢原子的数目为2 NA |
您最近一年使用:0次
9 . 化学是一门以实验为基础的学科,试回答以下问题。

(1)实验室中制取并收集少量氨气,可选用上述_____ (填装置序号)装置,氨气应从收集装置的_____ (填字母序号)导管进气。
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中盛满稀NaOH溶液,正确的连接顺序为___________________ (用接口字母表示),装置乙的作用是____________ ,丙中产生NO的离子方程式为______________________ 。
(3)二氧化氯(C1O2)是一种常用高效消毒剂,某研究小组利用丁装置制备C1O2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和K2SO4,则该反应中氧化产物与还原产物物质的量之比为_________ 。
②温度过高时,二氧化氯的水溶液有可能发生爆炸。在反应开始前将烧杯中的水加热到80%,然后停止加热,并使其保持在60℃~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是____________ 。
③将二氧化氯溶液加入到硫化氢溶液中,然后加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式________________ 。

(1)实验室中制取并收集少量氨气,可选用上述
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中盛满稀NaOH溶液,正确的连接顺序为
(3)二氧化氯(C1O2)是一种常用高效消毒剂,某研究小组利用丁装置制备C1O2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和K2SO4,则该反应中氧化产物与还原产物物质的量之比为
②温度过高时,二氧化氯的水溶液有可能发生爆炸。在反应开始前将烧杯中的水加热到80%,然后停止加热,并使其保持在60℃~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是
③将二氧化氯溶液加入到硫化氢溶液中,然后加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式
您最近一年使用:0次
10 . 下列解释事实的方程式不正确的是
| A.向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++ 3NH3·H2O===Al(OH)3+ 3NH4+ |
| B.加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3+ + 3OH—="=" Fe(OH)3↓ |
C.常温下0.1mol/L 氯化铵溶液pH=5:NH4+ +H2O  NH3·H2O+ H+ NH3·H2O+ H+ |
| D.电解精炼铜时阳极铜溶解:Cu — 2e— ="==" Cu2+ |
您最近一年使用:0次
2016-12-09更新
|
231次组卷
|
4卷引用:2015届四川省德阳市高三4月模拟练习化学试卷



