1 . 通过下列实验进行物质性质或成分的探究。
实验1:向某溶液中加入澄清石灰水,观察到有白色沉淀产生
实验2:取久置的过氧化钠样品少许于试管中,加入2~3mL蒸馏水,有无色无味的气体生成
实验3:将盛满氯气的试管倒扣在水槽中,静置一段时间,观察到试管中液面明显上升
实验4:用洁净的铂丝蘸取某碱性溶液进行焰色试验,观察到火焰的颜色呈黄色
下列说法正确的是
实验1:向某溶液中加入澄清石灰水,观察到有白色沉淀产生
实验2:取久置的过氧化钠样品少许于试管中,加入2~3mL蒸馏水,有无色无味的气体生成
实验3:将盛满氯气的试管倒扣在水槽中,静置一段时间,观察到试管中液面明显上升
实验4:用洁净的铂丝蘸取某碱性溶液进行焰色试验,观察到火焰的颜色呈黄色
下列说法正确的是
A.实验1说明溶液中含有 或 或 |
| B.实验2可知过氧化钠没有变质 |
| C.实验3说明氯气能溶于水 |
D.实验4说明溶液中的溶质为 |
您最近一年使用:0次
解题方法
2 . 常温下,根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 分别测量浓度均为0.1mol·L-1Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 | Al(OH) 比CO 比CO 更容易结合H+ 更容易结合H+ |
| B | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 | 亚硫酸钠样品已变质 |
| C | 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液, | 非金属性:Cl>C>Si |
| D | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 下列实验操作或实验方案,能达到目的的是
选项 | 实验操作或实验方案 | 目的 |
A | 向有MnO2固体的圆底烧瓶中加入浓盐酸,产生的气体依次通过饱和食盐水和浓硫酸 | 制取并纯化氯气 |
B | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 检验Na2SO3固体是否变质 |
C | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝 | 证明该气体为Cl2 |
D | 将NaOH待测液滴在湿润的pH试纸上,与标准比色卡对照 | 测定NaOH溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . I.硫酸亚铁 是中学化学常用试剂,可用于治疗缺铁性贫血症。
是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备 溶液时为防止硫酸亚铁变质,常采用的措施是
溶液时为防止硫酸亚铁变质,常采用的措施是_______ (填一种)。
(2)以 为原料可制备碱式硫酸铁
为原料可制备碱式硫酸铁 、铁红、硫酸亚铁铵[
、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。

①制备 时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是
时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是_______ 。
②制备 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,有气体生成,该反应的离子方程式为
溶液,有气体生成,该反应的离子方程式为_______ 。
Ⅱ.用工业废渣(主要含有 、FeO、
、FeO、 及少量Fe)制备绿矾
及少量Fe)制备绿矾 晶体的流程如下:
晶体的流程如下:
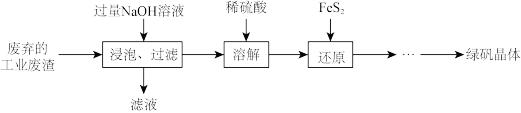
(3)“浸泡过程中加入过量NaOH溶液的目的是_______ 。
(4)“溶解”后所得溶液中含有的阳离子为 和
和_______ 。
(5)“还原时选择 而不用Cu粉的原因是
而不用Cu粉的原因是_______ 。
(6)测定绿矾中 的氧化率实验方案如下:
的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/L 溶液至恰好完全反应,反应原理为:
溶液至恰好完全反应,反应原理为: (未配平),消耗
(未配平),消耗 溶液20.00mL;
溶液20.00mL;
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。
(已知: 的氧化率
的氧化率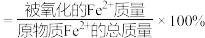 )
)
根据以上数据,计算该绿矾样品中 的氧化率,写出计算过程
的氧化率,写出计算过程______ 。
 是中学化学常用试剂,可用于治疗缺铁性贫血症。
是中学化学常用试剂,可用于治疗缺铁性贫血症。(1)实验室配备
 溶液时为防止硫酸亚铁变质,常采用的措施是
溶液时为防止硫酸亚铁变质,常采用的措施是(2)以
 为原料可制备碱式硫酸铁
为原料可制备碱式硫酸铁 、铁红、硫酸亚铁铵[
、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。
①制备
 时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是
时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是②制备
 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,有气体生成,该反应的离子方程式为
溶液,有气体生成,该反应的离子方程式为Ⅱ.用工业废渣(主要含有
 、FeO、
、FeO、 及少量Fe)制备绿矾
及少量Fe)制备绿矾 晶体的流程如下:
晶体的流程如下:
(3)“浸泡过程中加入过量NaOH溶液的目的是
(4)“溶解”后所得溶液中含有的阳离子为
 和
和(5)“还原时选择
 而不用Cu粉的原因是
而不用Cu粉的原因是(6)测定绿矾中
 的氧化率实验方案如下:
的氧化率实验方案如下:步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/L
 溶液至恰好完全反应,反应原理为:
溶液至恰好完全反应,反应原理为: (未配平),消耗
(未配平),消耗 溶液20.00mL;
溶液20.00mL;步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。
(已知:
 的氧化率
的氧化率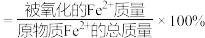 )
)根据以上数据,计算该绿矾样品中
 的氧化率,写出计算过程
的氧化率,写出计算过程
您最近一年使用:0次
名校
解题方法
5 . 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室中可通过NaHSO3的过饱和溶液经结晶制得。
实验I.焦亚硫酸钠的制备
(1)实验室制备少量Na2S2O5的装置如图1所示

①装置Y的作用是___________ 。
②制取Na2S2O5的反应分两步进行,其中第二步为2NaHSO3=Na2S2O5+H2O,则第一步的离子方程式为___________ 。
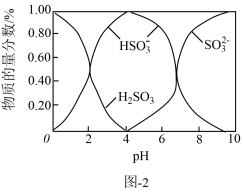
(2)已知:水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
打开磁力搅拌器,将装有Na2CO3过饱和溶液的锥形瓶至于40℃水浴中,___________ ,可得Na2S2O5固体。(须使用的试剂:SO2、SO2饱和溶液)
实验II.焦亚硫酸钠的性质
(3)长期放置的Na2S2O5固体会部分被氧化成Na2SO4而发生变质。请设计检验Na2S2O5样品是否变质的实验方案___________ 。(已知Na2S2O5、Na2SO3分别与稀硫酸反应得到的产物相同)
实验III.焦亚硫酸钠的测定
(4)某小组通过下述方法检测某饮料中抗氧化剂Na2S2O5残留的含量,步骤如下:
步骤一:取样品100.00mL于锥形瓶中,加入稀硫酸后蒸馏,使SO2全部逸出,馏分用25 mL 0.02 mol·L-1的I2溶液吸收。
步骤二:向吸收液中滴加0.01 mol·L-1的Na2S2O3标准溶液与I2发生反应2S2O +I2=2I-+S4O
+I2=2I-+S4O ,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。
,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。
样品中Na2S2O5的残留量为___________ g·L-1。(写出计算过程)
实验I.焦亚硫酸钠的制备
(1)实验室制备少量Na2S2O5的装置如图1所示

①装置Y的作用是
②制取Na2S2O5的反应分两步进行,其中第二步为2NaHSO3=Na2S2O5+H2O,则第一步的离子方程式为
(2)已知:水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
的物质的量分数随pH变化分布如图2所示。请补充完整制取Na2S2O5固体的实验方案:
打开磁力搅拌器,将装有Na2CO3过饱和溶液的锥形瓶至于40℃水浴中,
实验II.焦亚硫酸钠的性质
(3)长期放置的Na2S2O5固体会部分被氧化成Na2SO4而发生变质。请设计检验Na2S2O5样品是否变质的实验方案
实验III.焦亚硫酸钠的测定
(4)某小组通过下述方法检测某饮料中抗氧化剂Na2S2O5残留的含量,步骤如下:
步骤一:取样品100.00mL于锥形瓶中,加入稀硫酸后蒸馏,使SO2全部逸出,馏分用25 mL 0.02 mol·L-1的I2溶液吸收。
步骤二:向吸收液中滴加0.01 mol·L-1的Na2S2O3标准溶液与I2发生反应2S2O
 +I2=2I-+S4O
+I2=2I-+S4O ,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。
,滴定至终点时消耗Na2S2O3标准溶液20.00 mL。样品中Na2S2O5的残留量为
您最近一年使用:0次
6 . 为检验某漂白粉是否变质,进行下列探究实验:
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
| A.工业上用氯气和澄清石灰水制取漂白粉 |
| B.实验1和实验2说明漂白粉没有变质 |
| C.实验3中产生的气体只有氯气 |
D.实验3中下列反应的电子转移可表示为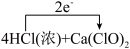 =CaCl2+2Cl2↑+2H2O =CaCl2+2Cl2↑+2H2O |
您最近一年使用:0次
2023-02-15更新
|
813次组卷
|
9卷引用:江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题
江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题(已下线)专题04 氯气及氯的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省江都区大桥中学2023-2024学年高一上学期期末复习模拟测试化学试题(已下线)第07讲 氯气的性质和次氯酸-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考点清单】(讲+练)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)辽宁省丹东市凤城市第一中学2023-2024学年高三上学期10月测试化学试题安徽省六安市舒城晓天中学2023-2024学年高一上学期期中考试化学试卷贵州省遵义市桐梓县荣兴高级中学2023-2024学年高一上学期第四次月考化学试题
解题方法
7 . 下列设计的实验方案能达到相应实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1 mL 1 mol/L  溶液迅速产生较多气泡 溶液迅速产生较多气泡 |
| B | 检验 晶体是否已氧化变质 晶体是否已氧化变质 | 将 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 证明“84消毒液”的氧化能力随溶液pH的减小而增强 | 将“84消毒液"(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| D | 证明氯化银的溶解度大于硫化银的溶解度 | 向2 mL 0.1 mol/L硝酸银溶液中加入1mL 0.1 mol/L NaCl溶液,出现白色沉淀,再加入几滴0.1 molL的 溶液,有黑色沉淀生成 溶液,有黑色沉淀生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 过氧化钠常作漂白剂、杀菌剂、消毒剂,若保存不当容易吸收空气中的 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀生成,证明 已经变质。
已经变质。
(2)为了粗略测定过氧化钠的纯度,他们设计并用如图装置来测定ag样品中过氧化钠的质分数。
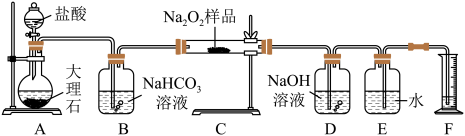
①将仪器连接好以后,必须进行的第一步操作是___________ 。
②从B装置中逸出的气体是否需要干燥?___________ (填“是”或“否”)。
③D中NaOH溶液的作用为___________ ,发生反应的离子方程式为___________ 。
④实验结束,读取实验中生成气体的体积时,不合理的是___________ (填字母)。
a、直接读取气体体积,不需冷却到室温
b、上下移动量筒,使得E、F中液面高度相同
c、视线与凹液面最低点相平,读取量筒中水的体积
⑤实验完成后,E到F之间导管内残留水的体积会使测量结果___________ (填“偏大”“偏小”或“不影响”)。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)为了粗略测定过氧化钠的纯度,他们设计并用如图装置来测定ag样品中过氧化钠的质分数。

①将仪器连接好以后,必须进行的第一步操作是
②从B装置中逸出的气体是否需要干燥?
③D中NaOH溶液的作用为
④实验结束,读取实验中生成气体的体积时,不合理的是
a、直接读取气体体积,不需冷却到室温
b、上下移动量筒,使得E、F中液面高度相同
c、视线与凹液面最低点相平,读取量筒中水的体积
⑤实验完成后,E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
名校
解题方法
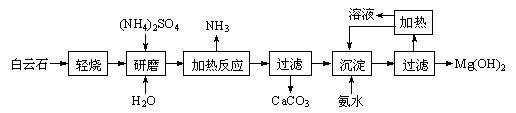
9 . 以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
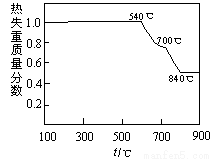
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:
② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份_____ (填化学式)。结合上图判断“轻烧”温度应不超过 _____ 。
(2)“加热反应”的化学方程式为_________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)=_______ (已知)。
(4)该工艺中可以循环使用的物质是________ (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是__________________________ 。

已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:

② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份
(2)“加热反应”的化学方程式为
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)=
(4)该工艺中可以循环使用的物质是
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石 的方法,其优点是
您最近一年使用:0次
2017-10-13更新
|
225次组卷
|
2卷引用:江苏省苏州市2018届高三期初调研化学试题
解题方法
10 . 下列化学实验事实及其结论中正确的是
| A.将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,证明非金属性:Cl>Si |
| B.向SO2水溶液中滴加盐酸和Ba(NO3)2溶液,有白色沉淀生成,证明BaSO3难溶于酸 |
| C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡后沉淀呈黄色,证明Ksp(AgCl)>Ksp(AgI) |
| D.将漂白粉样品溶于水,加入盐酸和KI溶液,再加入CCl4振荡,静置,下层液体呈紫红色,证明样品未变质 |
您最近一年使用:0次



