名校
1 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向过氧化钠样品中滴加过量的盐酸,将生成的气体通入CaCl2溶液 | 无白色沉淀产生 | 样品未变质 |
| B | 向氯仿(CHCl3)样品中加入AgNO3溶液 | 有白色沉淀产生 | 样品已变质 |
| C | 将漂白粉样品溶于水,加入盐酸和KI溶液,再加入CCl4振荡,静置 | 下层液体呈紫红色 | 样品未变质 |
| D | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生 | 样品已变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-03更新
|
392次组卷
|
2卷引用:江苏省南通、徐州、扬州、泰州、淮安、宿迁六市2018届高三第二次调研(二模)化学试题
名校
解题方法
2 . 过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
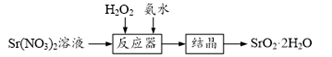
反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是______ 。

(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为______ 。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=______ 。[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9]
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程________ 。(已知:S2O32- S4O62-)
S4O62-)

反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是

(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程
 S4O62-)
S4O62-)
您最近一年使用:0次
3 . 过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
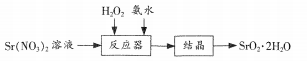
反应原理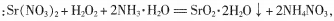 该反应放热.
该反应放热.
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是____ 。

(2)SrO2.2H2O遇CO2会反应变质,反应的化学方程式为___ 。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F一、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=__ 。
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol/L Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程__________ 。(已知:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9)

反应原理
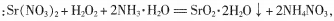 该反应放热.
该反应放热.(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是

(2)SrO2.2H2O遇CO2会反应变质,反应的化学方程式为
(3)25℃时,将Sr(NO3)2溶液滴加到含有F一、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol/L Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程
您最近一年使用:0次
名校
解题方法
4 . 根据信息书写反应方程式:
(1)以 溶液为原料可以制取磁性氧化铁(
溶液为原料可以制取磁性氧化铁( ),制取流程如下:
),制取流程如下:
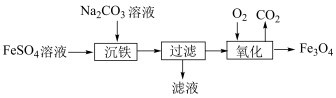
①写出沉铁时反应的离子方程式:____________ 。
②“氧化”的条件为高温。写出该反应的化学方程式:____________ 。
③ 可以溶于盐酸;写出该反应的离子方程式:
可以溶于盐酸;写出该反应的离子方程式:____________ 。
(2)漂白粉中的 在潮湿的空气中与
在潮湿的空气中与 和
和 会发生变质,变质时发生复分解反应,产物之一为
会发生变质,变质时发生复分解反应,产物之一为 。写出该反应的化学方程式:
。写出该反应的化学方程式:__________________ 。
(3)某氧化还原反应包含 、
、 、NaCl、NaClO、NaOH、
、NaCl、NaClO、NaOH、 六种物质,
六种物质, 是产物之一,写出该反应的化学方程式:
是产物之一,写出该反应的化学方程式:____________ 。
(1)以
 溶液为原料可以制取磁性氧化铁(
溶液为原料可以制取磁性氧化铁( ),制取流程如下:
),制取流程如下:
①写出沉铁时反应的离子方程式:
②“氧化”的条件为高温。写出该反应的化学方程式:
③
 可以溶于盐酸;写出该反应的离子方程式:
可以溶于盐酸;写出该反应的离子方程式:(2)漂白粉中的
 在潮湿的空气中与
在潮湿的空气中与 和
和 会发生变质,变质时发生复分解反应,产物之一为
会发生变质,变质时发生复分解反应,产物之一为 。写出该反应的化学方程式:
。写出该反应的化学方程式:(3)某氧化还原反应包含
 、
、 、NaCl、NaClO、NaOH、
、NaCl、NaClO、NaOH、 六种物质,
六种物质, 是产物之一,写出该反应的化学方程式:
是产物之一,写出该反应的化学方程式:
您最近一年使用:0次
名校
5 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
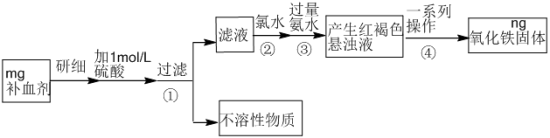
(1)实验中用已经准确量取的浓硫酸配制500mL 1mol•L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要______ 、________ 。
(2)步骤②加入过量氯水后发生反应的离子方程式为______ .
(3)步骤④中一系列操作步骤为过滤、洗涤、______ 、冷却、称量。
(4)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1mol•L-1的硫酸溶液,过滤.取滤液加______ 溶液,溶液变红说明该补血剂已部分变质.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有______ 性(填“氧化”或“还原”)的物质.
(5)下列检验(4)中滤液中是否有Fe2+应选用的试剂是______.

(1)实验中用已经准确量取的浓硫酸配制500mL 1mol•L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要
(2)步骤②加入过量氯水后发生反应的离子方程式为
(3)步骤④中一系列操作步骤为过滤、洗涤、
(4)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1mol•L-1的硫酸溶液,过滤.取滤液加
(5)下列检验(4)中滤液中是否有Fe2+应选用的试剂是______.
| A.KSCN溶液 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液. |
您最近一年使用:0次
名校
6 . 某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等.测定该复合肥中N的质量分数的实验步骤如下:
步骤1:准确称取0.5000g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2逸出时,冷却至室温;
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤、洗涤,得0.1550g Ca3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加过量甲醛溶液,加指示剂,用0.5000 mol·L-1 NaOH标准溶液滴定至终点,消耗NaOH溶液22.0mL。
已知:CO(NH2)2+H2SO4+H2O=(NH4)2SO4+CO2↑4NH4++6HCHO=4H++(CH2)6N4+6H2O
(1)步骤1中,加入浓硫酸后发生的反应还有______ (写出化学反应方程式)。
(2)以上实验所测复合肥样品中N的质量分数为________ 。
若0.5000 mol·L-1 NaOH标准溶液配制时,所取用的固体NaOH因长时间放置而部分变质,则该实验所测定的N的质量分数结果_____ (填偏高、偏低或无影响)。
(3)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比(写出计算过程)。_______________ 。
步骤1:准确称取0.5000g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2逸出时,冷却至室温;
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤、洗涤,得0.1550g Ca3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加过量甲醛溶液,加指示剂,用0.5000 mol·L-1 NaOH标准溶液滴定至终点,消耗NaOH溶液22.0mL。
已知:CO(NH2)2+H2SO4+H2O=(NH4)2SO4+CO2↑4NH4++6HCHO=4H++(CH2)6N4+6H2O
(1)步骤1中,加入浓硫酸后发生的反应还有
(2)以上实验所测复合肥样品中N的质量分数为
若0.5000 mol·L-1 NaOH标准溶液配制时,所取用的固体NaOH因长时间放置而部分变质,则该实验所测定的N的质量分数结果
(3)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比(写出计算过程)。
您最近一年使用:0次
名校
解题方法
7 . 下列实验操作、现象及结论都正确的是
| 选项 | 实验目的 | 实验现象 | 结论 |
| A | 检验乙醇是否含水,向乙醇中加入一小块钠 | 产生无色气体 | 乙醇中含有水 |
| B | 检验溴乙烷发生消去反应的产物,加热溴乙烷、乙醇和NaOH混合液,产生的气体通入溴水 | 溶液褪色 | 溴乙烷消去产物为乙烯 |
| C | 向苯酚溶液中滴加少量浓溴水,振荡 | 无白色沉淀 | 苯酚与浓溴水不反应 |
| D | 在3mL5%的 溶液滴入3∼4滴5%的NaOH溶液,振荡后加入0.5mL的乙醛溶液并加热 溶液滴入3∼4滴5%的NaOH溶液,振荡后加入0.5mL的乙醛溶液并加热 | 未产生砖红色沉淀 | 乙醛已经完全变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-24更新
|
224次组卷
|
2卷引用:江苏省射阳中学2023-2024学年高二上学期开学考试化学试题
8 . 下列说法正确的是
| A.FeCl3溶液需存放在加有少量铁粉的试剂瓶中,防止变质 |
| B.食盐水中Ca2+、SO42-等杂质的去除,应先加Na2CO3溶液,后加BaCl2溶液 |
| C.用四氯化碳来萃取碘水中的I2,有机层应从分液漏斗的下端放出 |
| D.用BaCl2溶液来检验暴露在空气中的Na2SO3样品是否变质 |
您最近一年使用:0次
2016-12-09更新
|
356次组卷
|
4卷引用:2015-2016学年江苏省宿迁市高一上学期期末考试化学试卷
9 . 烟道气中的NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00mL烟道气经除尘、干燥后缓慢通入适量酸化的H2O2的溶液中,使NOx完全被氧化为NO ,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO
,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO 的还原产物全为NO,且NO全部从溶液中逸出)
的还原产物全为NO,且NO全部从溶液中逸出)
(1)写出NO被H2O2氧化为NO 的离子方程式
的离子方程式_______
(2)与量取的20.00mL溶液中NO 反应的Fe2+为
反应的Fe2+为_______ mol?若FeSO4标准溶液部分变质,会使NOx含量测定结果如何_______ (答偏高、偏低或者无影响)
(3)标准状况下该工程烟道气中NOx(折合为NO2)的含量为每立方米_______ 毫克?
 ,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO
,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO 的还原产物全为NO,且NO全部从溶液中逸出)
的还原产物全为NO,且NO全部从溶液中逸出)(1)写出NO被H2O2氧化为NO
 的离子方程式
的离子方程式(2)与量取的20.00mL溶液中NO
 反应的Fe2+为
反应的Fe2+为(3)标准状况下该工程烟道气中NOx(折合为NO2)的含量为每立方米
您最近一年使用:0次
10 . 某兴趣小组为丰富课本所学的SO2性质,设计了下列系列实验:
(1)用下图装置制取并收集SO2以验证其氧化性
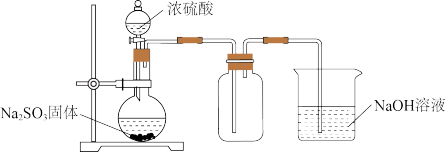
①Na2SO3久置于空气中易变质,体现了Na2SO3具有___________ 性。
②烧杯中NaOH溶液的作用是___________ 。
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为___________ 。
(2)用下图装置验证H2SO3比H2CO3酸性强
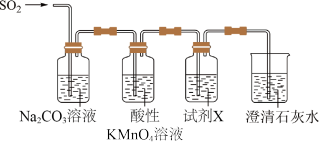
①试剂X是___________ ,其作用是___________ 。
②当观察到___________ ,即证明H2SO3比H2CO3酸性强。
(1)用下图装置制取并收集SO2以验证其氧化性

①Na2SO3久置于空气中易变质,体现了Na2SO3具有
②烧杯中NaOH溶液的作用是
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为
(2)用下图装置验证H2SO3比H2CO3酸性强

①试剂X是
②当观察到
您最近一年使用:0次
2020-12-17更新
|
506次组卷
|
4卷引用:江苏省扬州中学2019-2020学年高一上学期期末考试化学试题



