1 . 根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,用pH试纸测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 |  结合H+的能力比 结合H+的能力比 的强 的强 |
B | 将FeCl2样品溶于试管中,加入氯水,继续滴加KSCN溶液,溶液变红 | FeCl2样品已经被氧化变质 |
C | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgCl) > Ksp(AgI) |
D | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列实验操作、现象和结论都正确的是
| 选项 | 实验操作和现象 | 结论或解释 |
| A | 向NH4Al(SO4)2溶液中逐滴滴加NaOH溶液至过量,立即出现沉淀后沉淀不变,最后沉淀全部溶解 | Al3+先与OH反应,NH4+后与OH 反应,Al(OH)3最后与OH-反应 |
| B | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 | 样品已部分或全部变质 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置润湿的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________ 。
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
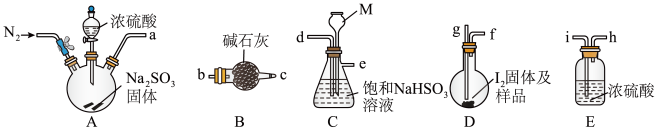
(2)装置连接的顺序为a__________ (填接口字母顺序);M仪器的名称为__________ ,其在实验过程中的作用是__________________________ 。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________ ;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
(4)Na2S2O3标准液应装在________ (填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________ 。
(5)滴定实验重复四次得到数据如下:
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________ %(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________ (填“偏高”“偏低”或“不变”)。
(1)写出该反应的化学反应方程式:
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:

(2)装置连接的顺序为a
(3)操作步骤①:连接装置并检查装置气密性,装入药品,
 +I2=S4O
+I2=S4O +2I-。
+2I-。(4)Na2S2O3标准液应装在
(5)滴定实验重复四次得到数据如下:
| 实验 | 1 | 2 | 3 | 4 |
| 消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将
您最近一年使用:0次
4 . 吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
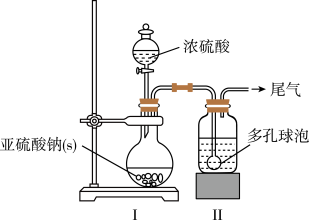
(1)装置Ⅰ中产生气体的化学反应方程式为__ ;Ⅱ中多孔球泡的作用是__ 。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__ 。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。
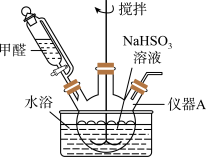
(3)仪器A的名称为___ ;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__ 。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__ 。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__ ;吊白块样品的纯度为__ %(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__ (填“偏高”、“偏低”或“无影响”)
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。

(1)装置Ⅰ中产生气体的化学反应方程式为
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为
(4)将仪器A中的反应温度恒定在80~90℃的目的是
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是
您最近一年使用:0次
2019-12-31更新
|
638次组卷
|
4卷引用:2019年四川省雅安市高三第一次诊断考试理综化学试题
名校
5 . 下列实验操作、现象和结论均正确的是
实验操作和现象 | 结 论 | |
A | 向等体积等浓度的盐酸中分别加入ZnS和CuS,ZnS溶解而CuS不溶解 | Ksp(CuS)<Ksp(ZnS) |
B | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 | 样品已变质 |
C | 加热盛有少量NH4HCO3固体的试管,试管口处润湿的红色石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 常温下,测得0.1 mol·L-1 NaA溶液的pH小于0.1 mol·L-1 Na2B溶液的pH | 酸性:HA>H2B |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-05-29更新
|
1740次组卷
|
2卷引用:四川省棠湖中学2020届高三一诊模拟考试理综化学试题
名校
6 . 砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________ 。
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→____________ (填接口字母顺序);M仪器的名称为________________ ,其在实验过程中的作用是:____________ ;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________ ;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2 ,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取 25.00mL 用0.20 mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________ (填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________ ;
(5)滴定实验重复四次得到数据如下:
①若实验开始时,向D 装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________ %。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________ (填“偏高”、“ 偏低”或“不变”)。
(1)写出该反应的化学反应方程式:
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,
步骤④中继续通入N2的目的是
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取 25.00mL 用0.20 mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在
(5)滴定实验重复四次得到数据如下:
| 实验 | ① | ② | ③ | ④ |
| 消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D 装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将
您最近一年使用:0次
2019-03-28更新
|
1020次组卷
|
3卷引用:【全国百强校】四川省成都市石室中学2019届高三第二次诊断性模拟测试化学试题
2018·陕西·高考模拟
名校
7 . 下列根据实验操作和实验现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
| B | 将Na2SO3样品溶于水,滴加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 原Na2SO3样品已变质 |
| C | 向淀粉KI溶液中滴入3滴稀盐酸,再加入10%的H2O2溶液 | 滴入稀硫酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
| D | 向5mL 0.5mol/NaHCO3溶液中滴入2 mL 1mol/L BaCl2溶液 | 产生白色沉淀,且有无色气体生成 | 反应的化学方程式为2 NaHCO3+BaCl2=BaCO3↓+2NaCl+CO2↑+H2O |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向NaI溶液中滴入少量新制氯水和苯,振荡、静置,溶液上层呈紫色 | I-还原性强于Cl- |
| B | 向某溶液中滴加H2O2溶液后再加入KSCN,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液, 有白色沉淀产生 | 样品已变质 |
| D | 向蔗糖溶液中加入少量稀硫酸并加热,冷却,加入新制Cu(OH)2悬浊液,加热,未出现红色沉淀 | 蔗糖未水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-05更新
|
307次组卷
|
2卷引用:四川省泸县第五中学2019-2020学年高一下学期第二次月考化学试题
9 . 下列实验操作,现象和结论正确的是
| 实验操作和现象 | 结 论 | |
| A | 向浓度均为0.1mol/L的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| B | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 | 样品已部分或全部变质 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置润湿的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含Br2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 亚硝酰氯(NOC1)是一种黄色气体,沸点为-5.5。其液体状态呈红褐色。遇水易水解,伴随有氯伴随有氯化氢生成。某化学兴趣小组按下图装置用Cl2和NO制备NOC1。回答下列相关问题:
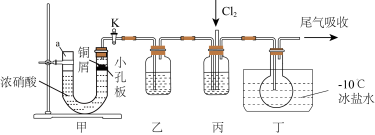
(1)仪器a的名称是_____ ,装置甲中反应的离子方程式是______ .
(2)装置乙的作用是____ ,实验开始时,先打开活塞k,当观察到装置丙中出现____ (填现象)时再缓缓通入Cl2.
(3)装置丙中生成NOC1的反应方程式是___ ,装置丁中冰盐水的作用是______ .
(4)经分析该套装置设计上有一处明显缺陷,改进方法是_____ (用文字描述)。
(5)工业制得的NOC1中常含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.441g样品溶于适量的NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用0.8000mol/L硝酸酸化的AgNO3溶液滴定,若消耗AgNO3溶液的体积为25.00mL,则NOC1的质量分数为___ %(保留2位小数);如果AgNO3溶液出现部分变质(变质的部分不参与反应),则测得的NOC1的质量分数会____ (填“偏大”或“偏小”)。

(1)仪器a的名称是
(2)装置乙的作用是
(3)装置丙中生成NOC1的反应方程式是
(4)经分析该套装置设计上有一处明显缺陷,改进方法是
(5)工业制得的NOC1中常含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.441g样品溶于适量的NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用0.8000mol/L硝酸酸化的AgNO3溶液滴定,若消耗AgNO3溶液的体积为25.00mL,则NOC1的质量分数为
您最近一年使用:0次



