名校
解题方法
1 . NiSO4广泛应用于印染、医药、催化、电镀等方面。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4·xH2O的工艺流程如下。 在350℃分解生成
在350℃分解生成 和
和 。
。
Ⅱ.NiSO4·xH2O易溶于水,难溶于乙醇,其水溶液显酸性。
回答下列问题:
(1)“浸渣”的成分有 、
、 外,还含有
外,还含有___________ (写化学式)。
(2)矿渣中部分FeO在空气中焙烧时反应生成 的化学方程式为
的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中 (浓度为
(浓度为 ),当溶液中
),当溶液中 时,除钙率为
时,除钙率为___________ [已知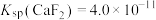 ]。
]。
(4)有机萃取剂(RH)可用于对溶液中的金属离子进行富集与分离,如萃取 的原理为
的原理为 ,萃取剂与溶液的体积比(
,萃取剂与溶液的体积比(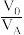 )对溶液中
)对溶液中 、
、 的萃取率影响如图所示,
的萃取率影响如图所示,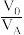 的最佳取值为
的最佳取值为___________ 。在___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 。下列说法正确的是
。下列说法正确的是___________ (填标号)。
A.蒸发浓缩至溶液表面出现晶膜时,停止加热
B.为得到较大NiSO4·xH2O晶体颗粒,宜用冰水快速冷却结晶
C.可通过抽滤提高过滤速度,并鼓入热风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
②NiSO4在一定条件下可被氧化成难溶于水的NiOOH,其在镍镉(Ni-Cd)可充电电池中发生如下反应: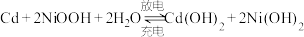 ,充电时阳极反应式为
,充电时阳极反应式为___________ 。
(6)采用热重分析法测定NiSO4·xH2O样品所含结晶水数目。
将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点产物组成为 ,x的值为
,x的值为___________ ;C点产物的化学式为___________ 。

 在350℃分解生成
在350℃分解生成 和
和 。
。Ⅱ.NiSO4·xH2O易溶于水,难溶于乙醇,其水溶液显酸性。
回答下列问题:
(1)“浸渣”的成分有
 、
、 外,还含有
外,还含有(2)矿渣中部分FeO在空气中焙烧时反应生成
 的化学方程式为
的化学方程式为(3)向“浸取液”中加入NaF以除去溶液中
 (浓度为
(浓度为 ),当溶液中
),当溶液中 时,除钙率为
时,除钙率为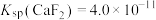 ]。
]。(4)有机萃取剂(RH)可用于对溶液中的金属离子进行富集与分离,如萃取
 的原理为
的原理为 ,萃取剂与溶液的体积比(
,萃取剂与溶液的体积比(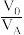 )对溶液中
)对溶液中 、
、 的萃取率影响如图所示,
的萃取率影响如图所示,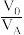 的最佳取值为
的最佳取值为
 。下列说法正确的是
。下列说法正确的是A.蒸发浓缩至溶液表面出现晶膜时,停止加热
B.为得到较大NiSO4·xH2O晶体颗粒,宜用冰水快速冷却结晶
C.可通过抽滤提高过滤速度,并鼓入热风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
②NiSO4在一定条件下可被氧化成难溶于水的NiOOH,其在镍镉(Ni-Cd)可充电电池中发生如下反应:
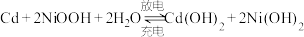 ,充电时阳极反应式为
,充电时阳极反应式为(6)采用热重分析法测定NiSO4·xH2O样品所含结晶水数目。
将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点产物组成为
 ,x的值为
,x的值为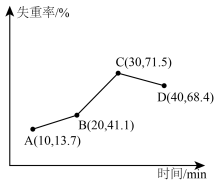
您最近一年使用:0次
名校
2 . 某催化剂主要含Ni、Ni(OH)2、NiS及少量Zn、Fe、CuO、CaO、SiO2等杂质,从中制备金属Ni的工艺流程如下:
回答下列问题:
(1)为提高废镍催化剂的浸出速率,可采取的措施有_____ (答一条即可)。
(2)反应 的平衡常数K=
的平衡常数K=_____ 。滤渣1的成分除CuS外还有_____ 。
(3)NaClO氧化 为
为 的离子方程式为
的离子方程式为_____ 。
(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是_____ 。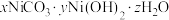 。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为
。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为_____ 。
(6)“分解”时通N2的作用是_____ 。
| 物质 | NiS | ZnS | CuS | FeS | CaF2 |
 (20℃) (20℃) | 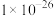 | 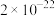 |  |  |  |
(1)为提高废镍催化剂的浸出速率,可采取的措施有
(2)反应
 的平衡常数K=
的平衡常数K=(3)NaClO氧化
 为
为 的离子方程式为
的离子方程式为(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是
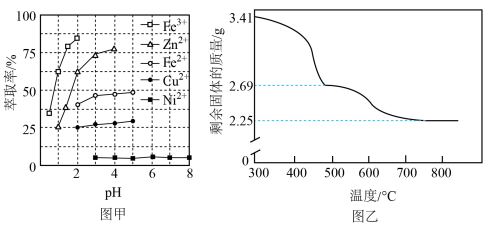
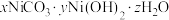 。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为
。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为(6)“分解”时通N2的作用是
您最近一年使用:0次
2023-09-25更新
|
598次组卷
|
4卷引用:四川省南充市2024届高三上学期高考适应性考试(零诊)理科综合化学试题
名校
3 . 高锰酸钾(KMnO4)外观呈紫黑色固体小颗粒,其易溶于水,是一种强氧化剂。某实验小组设计如下实验步骤制备KMnO4:
(一)K2MnO4的制备
将氯酸钾2.5g、氢氧化钾5.2g放入铁坩埚中混合均匀,小火加热并用铁棒搅拌至熔化后边搅拌边逐渐加入3g二氧化锰,并强力搅拌以防结块,加热数分钟后即得到墨绿色的熔融物(K2 MnO4),待冷却后在研钵中研细并倒入装有100mL蒸馏水的烧杯中,加热使其溶解,趁热过滤,得到含K2MnO4的溶液。
(二)KMnO4的制备
方法①:向K2 MnO4溶液中通入CO2使其歧化为KMnO4和MnO2,用pH试纸测量溶液的pH,当pH为10~11时,即停止通入CO2,过滤,经一系列操作得到KMnO4产品。
方法②:用如图装置电解K2 MnO4溶液(足量)制得KMnO4。
(1)下列仪器中,_______ (填标号)是坩埚;实验中用到的“铁坩埚、铁棒”能否用“瓷坩埚、玻璃棒”代替?_______ (填“能”或“否”)。___________ 。
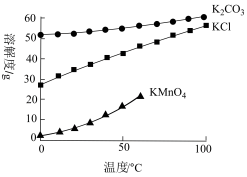
(3)“方法①”中不能用盐酸代替CO2的原因是___________ (填离子方程式)。产物溶解度随温度变化情况如图所示,则“一系列操作”具体为___________ 、抽滤、烘干。_______ (填“c”或“d”)电极处有气体放出,另一极的现象为___________ 。
(5)取a g KMnO4样品,配制成100ml溶液,取出10.00mL溶液于锥形瓶中,用cmol·L-1的H2C2O4溶液进行滴定,到达滴定终点时,溶液变为___________ ,此时消耗溶液体积为VmL,则该样品纯度为___________ ×100%。
(一)K2MnO4的制备
将氯酸钾2.5g、氢氧化钾5.2g放入铁坩埚中混合均匀,小火加热并用铁棒搅拌至熔化后边搅拌边逐渐加入3g二氧化锰,并强力搅拌以防结块,加热数分钟后即得到墨绿色的熔融物(K2 MnO4),待冷却后在研钵中研细并倒入装有100mL蒸馏水的烧杯中,加热使其溶解,趁热过滤,得到含K2MnO4的溶液。
(二)KMnO4的制备
方法①:向K2 MnO4溶液中通入CO2使其歧化为KMnO4和MnO2,用pH试纸测量溶液的pH,当pH为10~11时,即停止通入CO2,过滤,经一系列操作得到KMnO4产品。
方法②:用如图装置电解K2 MnO4溶液(足量)制得KMnO4。
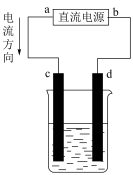
(1)下列仪器中,
A. B.
B. C.
C. 
(3)“方法①”中不能用盐酸代替CO2的原因是
(5)取a g KMnO4样品,配制成100ml溶液,取出10.00mL溶液于锥形瓶中,用cmol·L-1的H2C2O4溶液进行滴定,到达滴定终点时,溶液变为
您最近一年使用:0次
名校
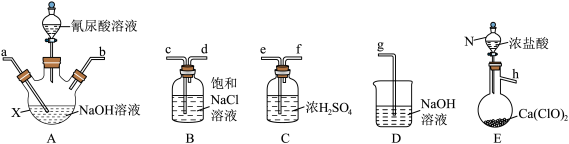
4 . 二氯异氰尿酸钠(NaC3N3O3Cl2)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中 法是向
法是向 溶液通入
溶液通入 产生高浓度
产生高浓度 溶液,然后与氰尿酸(C3H3N3O3)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
溶液,然后与氰尿酸(C3H3N3O3)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
已知: ,回答下列问题:
,回答下列问题:
(1)写出装置E中发生反应的化学方程式___________ 。
(2)按气流从左至右,导管口连接顺序为:________ (填小写字母)
h→___________→___________→___________→___________→___________
(3)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为___________ (填仪器名称)。
(4)装置A中制备 溶液完成的现象是
溶液完成的现象是___________ ,在加氰尿酸溶液过程仍需不断通入 的理由是
的理由是___________ 。
(5)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为: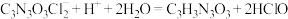 ;
; ;
;
准确称取0.6000g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用 标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗 溶液15.00mL。
溶液15.00mL。
①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要___________ 。
②滴定至溶液呈微黄色时,加入的指示剂是___________ ,该样品的有效氯为___________ %。(该样品的有效氯 ,保留三位有效数字)
,保留三位有效数字)
 法是向
法是向 溶液通入
溶液通入 产生高浓度
产生高浓度 溶液,然后与氰尿酸(C3H3N3O3)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
溶液,然后与氰尿酸(C3H3N3O3)反应制取二氯异氰尿酸钠。从下面选择所需装置完成实验。
已知:
 ,回答下列问题:
,回答下列问题:(1)写出装置E中发生反应的化学方程式
(2)按气流从左至右,导管口连接顺序为:
h→___________→___________→___________→___________→___________
(3)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为
(4)装置A中制备
 溶液完成的现象是
溶液完成的现象是 的理由是
的理由是(5)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为:
 ;
; ;
;
准确称取0.6000g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量
 溶液,密封在暗处静置5min;用
溶液,密封在暗处静置5min;用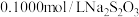 标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入指示剂继续滴定至终点,消耗 溶液15.00mL。
溶液15.00mL。①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒和量筒外,还需要
②滴定至溶液呈微黄色时,加入的指示剂是
 ,保留三位有效数字)
,保留三位有效数字)
您最近一年使用:0次
5 .  常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取
常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取 时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
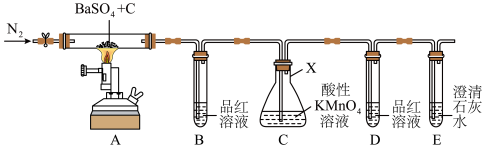
(1)仪器 的名称为
的名称为____________ 。
(2)一段时间后, 中品红溶液褪色,
中品红溶液褪色, 中溶液颜色变淡,
中溶液颜色变淡, 、
、 中无明显现象,则实验生成的气体为
中无明显现象,则实验生成的气体为____________ (填化学式),装置 中发生反应的离子方程式是
中发生反应的离子方程式是____________________________________ 。
(3)该装置的明显缺陷是____________________________________ 。
(4)测定 样品纯度的实验步骤如下:
样品纯度的实验步骤如下:
Ⅰ.称取 样品,加水溶解,配制成
样品,加水溶解,配制成 溶液;
溶液;
Ⅱ.取一锥形瓶,向其中加入 醋酸溶液、
醋酸溶液、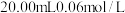 碘溶液、
碘溶液、 Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅲ.向充分反应后的溶液中,加入 滴淀粉溶液,用
滴淀粉溶液,用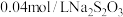 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (
( )。
)。
①滴定终点时的现象为____________________________________________________________ 。
②样品中 的纯度为
的纯度为____________  (保留三位有效数字)。
(保留三位有效数字)。
③下列情况会导致测定 的纯度偏小的是
的纯度偏小的是____________ (填标号)。
a.称量样品时,发生了潮解
b.配制 溶液时,未洗涤烧杯
溶液时,未洗涤烧杯
c.达滴定终点时,俯视读数
 常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取
常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取 时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
(1)仪器
 的名称为
的名称为(2)一段时间后,
 中品红溶液褪色,
中品红溶液褪色, 中溶液颜色变淡,
中溶液颜色变淡, 、
、 中无明显现象,则实验生成的气体为
中无明显现象,则实验生成的气体为 中发生反应的离子方程式是
中发生反应的离子方程式是(3)该装置的明显缺陷是
(4)测定
 样品纯度的实验步骤如下:
样品纯度的实验步骤如下:Ⅰ.称取
 样品,加水溶解,配制成
样品,加水溶解,配制成 溶液;
溶液;Ⅱ.取一锥形瓶,向其中加入
 醋酸溶液、
醋酸溶液、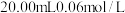 碘溶液、
碘溶液、 Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);Ⅲ.向充分反应后的溶液中,加入
 滴淀粉溶液,用
滴淀粉溶液,用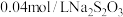 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (
( )。
)。①滴定终点时的现象为
②样品中
 的纯度为
的纯度为 (保留三位有效数字)。
(保留三位有效数字)。③下列情况会导致测定
 的纯度偏小的是
的纯度偏小的是a.称量样品时,发生了潮解
b.配制
 溶液时,未洗涤烧杯
溶液时,未洗涤烧杯c.达滴定终点时,俯视读数
您最近一年使用:0次
名校
6 . 实验室有一包含锰混合物样品,可能含有MnO2(63.2%,难溶于水),MnO(77.5%,难溶于水),MnCO3(47.8%,难溶于水)和MnCl2(43.7%,易溶于水)(括号内是该物质锰元素质量分数)中的一种或几种,为测定其中锰元素的含量,小明查阅资料设计了如下流程。请回答下列问题:

(1)操作X是_______ 。
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是_______ 。
(3)“氧化”步骤的离子方程式是_______ ,上述流程中能够循环利用的物质是_______ 。
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为_______ (保留1位小数)。李华经过分析认为上述结果存在问题,理由是_______ ,经过检查,原来是小明忘记了操作X处所得的MnO2。

(1)操作X是
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是
(3)“氧化”步骤的离子方程式是
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为
您最近一年使用:0次
名校
解题方法
7 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
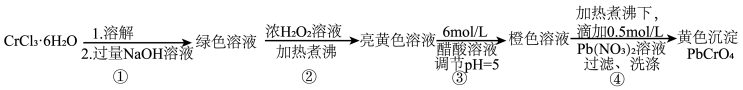
回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用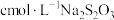 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用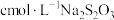 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
2022-08-30更新
|
243次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
解题方法
8 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定硫酸铜晶体中结晶水的含量 | 加热盛有硫酸铜晶体的坩埚,待固体全部呈白色后将坩埚放置在铁架台上冷却,再称重 |
| B | 检验Fe(NO3)2中是否混有Fe(NO3)3 | 取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液 |
| C | 验证石蜡油分解的产物不仅是烷烃 | 将热分解的气体产物通入溴的四氯化碳溶液 |
| D | 制备无水氯化铝 | 在硬质玻璃管中灼烧AlCl3·6H2O,同时通入干燥空气气流保护 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-20更新
|
641次组卷
|
2卷引用:四川省乐山市2023届高三下学期第三次调查研究考试理科综合化学试题
名校
解题方法
9 . 无水FeCl3是芳香烃取代反应常用的催化剂,它具有易水解、易升华的性质。某同学用5.60g干燥铁粉制得13.00g无水FeCl3样品,实验装置如图所示。下列说法正确的是
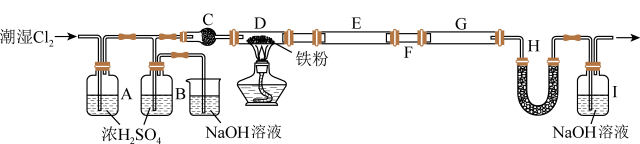

| A.该实验中FeCl3的产率为60% |
| B.装置C、H中的药品可以都为P2O5 |
| C.装置B用于干燥氯气,装置E和G用于收集产物 |
| D.可用K4[Fe(CN)6]溶液检验FeCl3产品中是否存在FeCl2 |
您最近一年使用:0次
2023-04-04更新
|
1836次组卷
|
10卷引用:四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题
四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题湖北省圆创2023届高三3月联合测评化学试题湖北省武汉市圆创联考2023届高三3月质检化学试题(已下线)化学-2023年高考押题预测卷03(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)(已下线)题型35 微型成套装置实验流程(已下线)T13-化学实验基础湖北省名校联盟2023届高三3月联合测评化学试题(已下线)选择题11-15甘肃省天水市第一中学 第三中学联考2023-2024学年高三上学期第三次月考 化学试题(已下线)热点19 化学微型实验
名校
解题方法
10 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为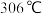 ,沸点为
,沸点为 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向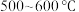 的铁粉中通入氯气来生产无水氯化铁。
的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为 ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用 与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目
与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目__________ ,当生成 氯气,做还原剂的
氯气,做还原剂的 的物质的量为
的物质的量为__________  。
。
(2)C放置在盛冷水的水槽中,水浴的作用是____________________ 。
(3)仪器D的名称是__________ ,D中装的药品可以是__________ (填序号)
A. B.碱石灰 C.
B.碱石灰 C. D.
D.
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)
(5)定量分析。取装置C中的产物,按以下步骤进行测定:①称取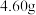 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式__________ 计算该样品中铁元素的质量分数为__________ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有 杂质。
杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是__________ 。
氯化铁:熔点为
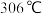 ,沸点为
,沸点为 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向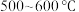 的铁粉中通入氯气来生产无水氯化铁。
的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为
 ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用
 与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目
与浓盐酸反应制取氯气,写出反应的化学方程式并用双线桥法来表示出电子转移的方向和数目 氯气,做还原剂的
氯气,做还原剂的 的物质的量为
的物质的量为 。
。(2)C放置在盛冷水的水槽中,水浴的作用是
(3)仪器D的名称是
A.
 B.碱石灰 C.
B.碱石灰 C. D.
D.
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的__________进行检测。(填序号,试剂不组合使用)A. 溶液 溶液 | B.酸性 溶液 溶液 | C. 溶液 溶液 | D.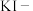 淀粉溶液 淀粉溶液 |
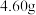 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液中发生反应的离子方程式
溶液中发生反应的离子方程式(6)由(5)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有
 杂质。
杂质。②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是
您最近一年使用:0次
2023-01-10更新
|
357次组卷
|
3卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题



