名校
解题方法
1 . 过硫酸铵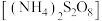 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至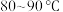 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为___________ 。
(2)仪器的连接顺序为
___________ (用小写字母连接)。
(3)盛放浓硫酸的仪器名称为___________ 。装置A中 的作用是
的作用是___________ 。过硫酸铵保存在棕色试剂瓶中的原因是___________ 。
(4)A中制取过硫酸铵的反应的化学方程式为___________ 。充分反应后,将A中混合液经一系列操作得到晶体,然后用无水乙醇洗涤。选择用无水乙醇洗涤的目的是___________ 。
(5)过硫酸铵可用于测定锰钢中 元素的含量:取
元素的含量:取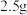 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
___________ (保留两位小数)。
(6)根据本实验可得出, 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为___________ 。
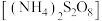 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至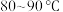 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为
(2)仪器的连接顺序为

(3)盛放浓硫酸的仪器名称为
 的作用是
的作用是(4)A中制取过硫酸铵的反应的化学方程式为
(5)过硫酸铵可用于测定锰钢中
 元素的含量:取
元素的含量:取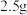 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
(6)根据本实验可得出,
 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为
您最近一年使用:0次
解题方法
2 . 从某铋(Bi)、锌的冶炼厂的高铟烟灰(主要含ZnO、 、
、 、
、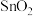 、
、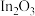 )中提取铟和铋的流程如图:
)中提取铟和铋的流程如图:
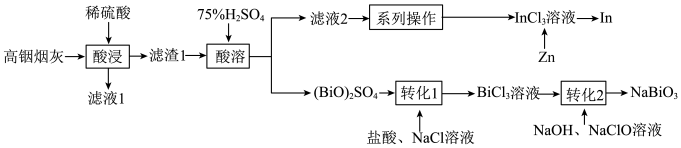
已知: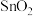 不溶于稀硫酸;
不溶于稀硫酸; 难溶于水。
难溶于水。
回答下列问题:
(1)“滤液1”中含有的金属阳离子有_______ (填离子符号)。
(2)“酸浸”过程中使用稀硫酸而不用75%的) 溶液,其原因是
溶液,其原因是_______ 。
(3)“酸溶”生成的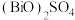 中,Bi元素的化合价为
中,Bi元素的化合价为_______ 。
(4)“转化2”时发生反应的化学方程式为_______ 。
(5)“系列操作”的流程如下:
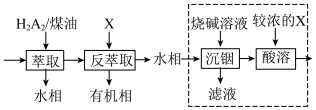
已知:“萃取”时发生反应: (金属阳离子)
(金属阳离子)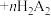 (有机液)
(有机液) (有机液)
(有机液)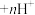 ;
;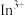 与
与 相似,易水解。
相似,易水解。
①试剂X的名称为_______ ,“萃取”和“反萃取”的目的是_______ 。
②关于虚线框内的实验步骤,下列说法正确的是_______ (填标号)。
A.可以提高 溶液的浓度
溶液的浓度
B.烧碱溶液可用纯碱溶液代替
C.需用到分液漏斗、烧杯、玻璃棒等仪器
(6)akg的高铟烟灰经上述流程后,得到 质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为
质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为_______ (用含a、b、w的计算式表示)。
 、
、 、
、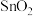 、
、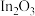 )中提取铟和铋的流程如图:
)中提取铟和铋的流程如图:
已知:
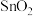 不溶于稀硫酸;
不溶于稀硫酸; 难溶于水。
难溶于水。回答下列问题:
(1)“滤液1”中含有的金属阳离子有
(2)“酸浸”过程中使用稀硫酸而不用75%的)
 溶液,其原因是
溶液,其原因是(3)“酸溶”生成的
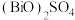 中,Bi元素的化合价为
中,Bi元素的化合价为(4)“转化2”时发生反应的化学方程式为
(5)“系列操作”的流程如下:

已知:“萃取”时发生反应:
 (金属阳离子)
(金属阳离子)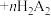 (有机液)
(有机液) (有机液)
(有机液)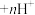 ;
;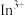 与
与 相似,易水解。
相似,易水解。①试剂X的名称为
②关于虚线框内的实验步骤,下列说法正确的是
A.可以提高
 溶液的浓度
溶液的浓度B.烧碱溶液可用纯碱溶液代替
C.需用到分液漏斗、烧杯、玻璃棒等仪器
(6)akg的高铟烟灰经上述流程后,得到
 质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为
质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为
您最近一年使用:0次
名校
解题方法
3 . 漂白粉的效能是以有效氯的含量来衡量的。有效氯是指漂白粉与浓盐酸生成氯气的质量与漂白粉的质量之比。
(1)为了制备可用于测量有效氯的浓盐酸,将常温常压下39.6L的HCl气体溶于100mL的水中。已知,常温常压下,气体的摩尔体积为 ,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度
,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度________ (用小数表示,保留小数点后1位)。
(2)取10g漂白粉,向其中滴加足量所配制的浓盐酸,产生的气体在常温常压下的体积为1.225L,则漂白粉中次氯酸钙的质量分数为多少________ (用百分数表示)?
(3)已知,漂白粉中的有效氯一般为35%,请计算出这个批次的漂白粉的有效氯含量(用百分数表示),并判断其是否合格。________
(1)为了制备可用于测量有效氯的浓盐酸,将常温常压下39.6L的HCl气体溶于100mL的水中。已知,常温常压下,气体的摩尔体积为
 ,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度
,水的密度为1g/mL,配制所得的浓盐酸的密度为1.18g/mL,试求得所配浓盐酸的物质的量浓度(2)取10g漂白粉,向其中滴加足量所配制的浓盐酸,产生的气体在常温常压下的体积为1.225L,则漂白粉中次氯酸钙的质量分数为多少
(3)已知,漂白粉中的有效氯一般为35%,请计算出这个批次的漂白粉的有效氯含量(用百分数表示),并判断其是否合格。
您最近一年使用:0次
名校
4 . 某同学为测定 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体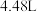 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是
 和
和 混合粉末中
混合粉末中 的含量。将
的含量。将 和
和 混合粉末加入
混合粉末加入 的稀硝酸中,得到
的稀硝酸中,得到 气体
气体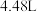 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是| A.反应后有固体剩余 | B.反应后的溶液中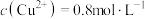 |
C. 单质在混合粉末中的质量分数约为 单质在混合粉末中的质量分数约为 | D.在反应后的溶液中加入足量铁粉,可置换出 |
您最近一年使用:0次
2024-04-11更新
|
155次组卷
|
3卷引用:辽宁省部分高中2023-2024学年高一下学期4月月考化学试题
辽宁省部分高中2023-2024学年高一下学期4月月考化学试题吉林省白山市抚松县第一中学2023-2024学年高一下学期4月月考化学试题(已下线)第二章 化学计量及应用(测试)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
5 . 实验室有一包含锰混合物样品,可能含有MnO2(63.2%,难溶于水),MnO(77.5%,难溶于水),MnCO3(47.8%,难溶于水)和MnCl2(43.7%,易溶于水)(括号内是该物质锰元素质量分数)中的一种或几种,为测定其中锰元素的含量,小明查阅资料设计了如下流程。请回答下列问题:

(1)操作X是_______ 。
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是_______ 。
(3)“氧化”步骤的离子方程式是_______ ,上述流程中能够循环利用的物质是_______ 。
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为_______ (保留1位小数)。李华经过分析认为上述结果存在问题,理由是_______ ,经过检查,原来是小明忘记了操作X处所得的MnO2。

(1)操作X是
(2)“酸浸”过程中发生的反应均为复分解反应,“酸浸”的目的是
(3)“氧化”步骤的离子方程式是
(4)若氯气与氢氧化钠溶液反应除了生成NaClO3外,还有部分NaClO,且二者的物质的量之比为3∶1,则反应的离子方程式为
(5)小明在实验中,消耗混合物样品10g,最终收集到MnO2 5.8g,样品中锰元素质量分数为
您最近一年使用:0次
名校
6 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,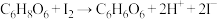 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中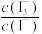 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到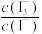 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,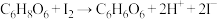 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
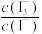 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到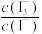 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
106次组卷
|
3卷引用: 北京市第五中学2023-2024学年高二上学期12月月考化学试题
名校
7 . 某铜合金中 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:
1.称取 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;
Ⅱ.取 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的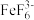 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;
Ⅲ.向Ⅱ的锥形瓶中加入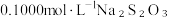 溶液滴定,发生反应:
溶液滴定,发生反应:
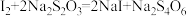 (无色);
(无色);
Ⅳ.平行测定四次,四次滴定实验消耗 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:
V.计算铜的质量分数。
已知: 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。
(1)盛装 溶液,应选择下图中的
溶液,应选择下图中的_____________ (填“a”或“b”)。

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是_____________ 。
(4)滴定终点的现象_____________ 。
(5)Ⅳ所消耗的 标准溶液平均体积为
标准溶液平均体积为_____________  ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为_____________ (结果保留两位小数)。
(6)以下操作造成铜的含量偏高的是_____________ 。
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入 溶液
溶液
 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:1.称取
 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;Ⅱ.取
 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的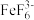 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;Ⅲ.向Ⅱ的锥形瓶中加入
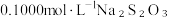 溶液滴定,发生反应:
溶液滴定,发生反应: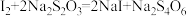 (无色);
(无色);Ⅳ.平行测定四次,四次滴定实验消耗
 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:| 滴定次数 | 待测溶液的体积/ | 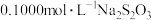 溶液的体积/ 溶液的体积/ | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 50.00 | 0.00 | 18.02 |
| 第二次 | 50.00 | 0.56 | 18.96 |
| 第三次 | 50.00 | 0.22 | 18.20 |
| 第四次 | 50.00 | 0.35 | 18.35 |
已知:
 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。(1)盛装
 溶液,应选择下图中的
溶液,应选择下图中的
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中
 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是(4)滴定终点的现象
(5)Ⅳ所消耗的
 标准溶液平均体积为
标准溶液平均体积为 ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为(6)以下操作造成铜的含量偏高的是
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入
 溶液
溶液
您最近一年使用:0次
8 . 工业上利用冶炼烟尘(主要成分TeO2、SeO2、PbO、Au、Ag等)回收Se、TeO2的工艺流程如下:
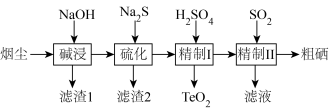
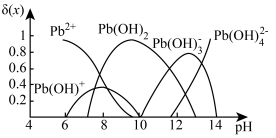
已知:①水溶液中各形态铅的分布系数 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为__ 。
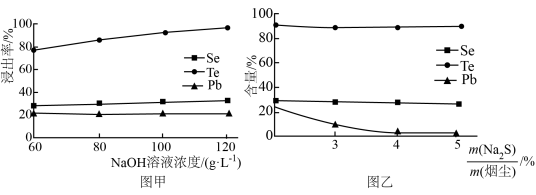
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为__ 100g/L,浓度不能过大的原因是__ ;硫化时,Na2S加入量对元素含量的影响如图乙所示,反应的离子方程式为__ 。
(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是__ (用离子方程式表示),pH过低还会导致沉磅率降低的原因是__ 。
(4)精制Ⅱ后的滤液可循环使用,应当导入到__ 操作中(填操作单元的名称)。
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为__ 。测定原理为:SeO2+4I-+4H+=Se+2I2+2H2O;I2+2S2O =2I-+S4O
=2I-+S4O

已知:①水溶液中各形态铅的分布系数
 (x)与溶液pH的关系如图所示。
(x)与溶液pH的关系如图所示。
②SeO2是酸性氧化物,TeO2、PbO是两性氧化物。回答下列问题:
(1)Se在元素周期表中的位置为
(2)碱浸时,NaOH溶液对元素浸出率的影响如图甲所示,实际生产中所用NaOH溶液的浓度为

(3)精制1时控制pH范围为5.5~6.5,pH过低导致TeO2中会混有Se和黄色固体杂质,原因是
(4)精制Ⅱ后的滤液可循环使用,应当导入到
(5)测定粗硒样品中硒的含量:称量0.2500g粗硒样品,用浓H2SO4将样品中的Se氧化得到SeO2,生成的SeO2加入硫酸酸化的KI溶液中充分反应,加入淀粉溶液,用0.4000mol/L的Na2S2O3标准溶液滴定至终点时消耗20.00mL(杂质不参与反应)。则粗硒样品中硒的质量分数为
 =2I-+S4O
=2I-+S4O
您最近一年使用:0次
解题方法
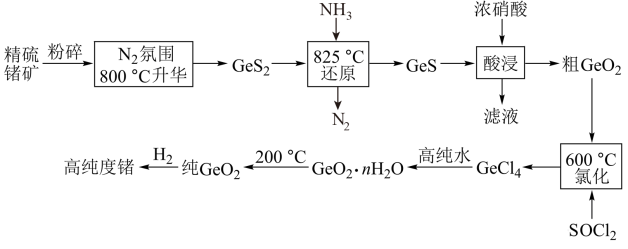
9 . 8月1日起,为了国家信息安全,我国禁止镓和锗的出口,锗是一种重要的半导体材料,工业上用精硫锗矿(主要成分为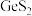 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示:
(1) 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为___________ 。
(2)800℃升华时通入 的目的是:
的目的是:___________ 、___________ 。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:___________ ,酸浸时温度不能过高的原因是___________ 。
(4) 易水解生成
易水解生成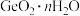 ,证明
,证明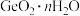 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是___________ 。
(5)测定错的含量:称取0.5500g锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下 ,能将
,能将 氧化为
氧化为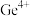 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:___________ 、___________ ,②该样品中储的质量分数是___________ %(精确到0.01%)。
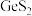 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示:
(1)
 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为(2)800℃升华时通入
 的目的是:
的目的是:(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:
(4)
 易水解生成
易水解生成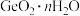 ,证明
,证明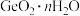 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是(5)测定错的含量:称取0.5500g锗样品,加入双氧水溶解,再加入盐酸生成
 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为24.80mL。已知:酸性条件下 ,能将
,能将 氧化为
氧化为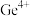 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:
您最近一年使用:0次
解题方法
10 . 利用含硒物料(主要成分为Se、S、 、
、 和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
和少量含Cu、Ag的化合物)制取精硒的工业流程如下:

已知:硫单质熔点:单斜硫119℃、正交硫95℃;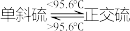 。
。
回答下列问题:
(1)“脱硫”选择温度为95℃的原因是___________ ;实验室进行“过滤”操作时,用到的玻璃仪器除烧杯外,还有___________ 。
(2)“氧化浸取”中,Se被氧化为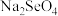 并收集到
并收集到 气体,该反应的化学反应方程式为
气体,该反应的化学反应方程式为___________ 。
(3)“除杂”中, 浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是___________ 。

(4)“酸化”过程中制取精硒的离子方程式为___________ 。
(5)测定精硒中硒的含量:
准确称量0.2000g样品,用浓 将样品中的Se氧化得到
将样品中的Se氧化得到 ;生成的
;生成的 加入到硫酸酸化的KI溶液中充分反应。用0.4000
加入到硫酸酸化的KI溶液中充分反应。用0.4000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL。精硒中硒的质量分数为
溶液24.00mL。精硒中硒的质量分数为___________ 。上述过程发生的反应: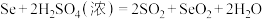 、
、 、
、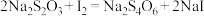
 、
、 和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
和少量含Cu、Ag的化合物)制取精硒的工业流程如下:
已知:硫单质熔点:单斜硫119℃、正交硫95℃;
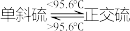 。
。回答下列问题:
(1)“脱硫”选择温度为95℃的原因是
(2)“氧化浸取”中,Se被氧化为
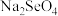 并收集到
并收集到 气体,该反应的化学反应方程式为
气体,该反应的化学反应方程式为(3)“除杂”中,
 浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
浓度对粗硒除杂的影响如图所示,精硒中的杂质含量先降低后上升的原因是
(4)“酸化”过程中制取精硒的离子方程式为
(5)测定精硒中硒的含量:
准确称量0.2000g样品,用浓
 将样品中的Se氧化得到
将样品中的Se氧化得到 ;生成的
;生成的 加入到硫酸酸化的KI溶液中充分反应。用0.4000
加入到硫酸酸化的KI溶液中充分反应。用0.4000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液24.00mL。精硒中硒的质量分数为
溶液24.00mL。精硒中硒的质量分数为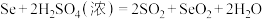 、
、 、
、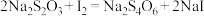
您最近一年使用:0次
2023-10-11更新
|
321次组卷
|
3卷引用:山东省潍坊市五县区2023-2024学年高三上学期10月阶段监测化学试题



