名校
解题方法
1 . 实验室中利用固体 进行如图所示实验,下列说法错误的是
进行如图所示实验,下列说法错误的是
 进行如图所示实验,下列说法错误的是
进行如图所示实验,下列说法错误的是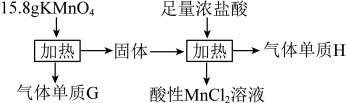
| A.气体G与气体H均为氧化产物 | B.实验中 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H在标准状况下的总体积可能为5.6 L |
您最近一年使用:0次
名校
2 . 双氧水、84消毒液、高铁酸钠是生活中常用的消毒剂,请回答下列问题:
(1)某同学设计如表实验研究H2O2的性质
已知:I2遇淀粉溶液变蓝
①从化合价改变上看H2O2,既有氧化性又有还原性,具有还原性的原因是_______ 。
②能证明H2O2具有氧化性的实验是________ (填序号“i”或“ii”)。
(2)2016年巴西奥运会期间,由于工作人员将84消毒液(有效成分为NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。
已知:NaClO具有强氧化性,易被还原为NaCl
①该反应说明氧化性:NaClO________ O2(填“>”或“<”)。
②当有3个氧气分子生成时,转移________ 个电子。
(3)湿法制备Na2FeO4,反应为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
①该反应的氧化产物是________ 。
②用双线桥法标出该反应电子转移的方向和数目______ 。
(1)某同学设计如表实验研究H2O2的性质
| 序号 | 实验 | 实验现象 |
| i | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
①从化合价改变上看H2O2,既有氧化性又有还原性,具有还原性的原因是
②能证明H2O2具有氧化性的实验是
(2)2016年巴西奥运会期间,由于工作人员将84消毒液(有效成分为NaClO)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。
已知:NaClO具有强氧化性,易被还原为NaCl
①该反应说明氧化性:NaClO
②当有3个氧气分子生成时,转移
(3)湿法制备Na2FeO4,反应为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
①该反应的氧化产物是
②用双线桥法标出该反应电子转移的方向和数目
您最近一年使用:0次
名校
解题方法
3 . NaBH4(B的化合价为+3)是化工生产中的重要还原剂,其与水发生反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑。下列有关该反应的叙述正确的是
| A.该反应为置换反应 | B.H2O是还原剂 |
| C.NaBH4被氧化 | D.每生成1个H2转移1个电子 |
您最近一年使用:0次
2023-10-05更新
|
43次组卷
|
4卷引用:安徽省马鞍山市当涂第一中学2022-2023学年高一上学期11月月考化学试题
名校
4 . 在一个氧化还原反应体系中,反应物、生成物共有六种微粒:Fe3+、NO 、Fe2+、NH
、Fe2+、NH 、H+、H2O。已知氧化性:NO
、H+、H2O。已知氧化性:NO (H+)>Fe3+。下列叙述不正确的是
(H+)>Fe3+。下列叙述不正确的是
 、Fe2+、NH
、Fe2+、NH 、H+、H2O。已知氧化性:NO
、H+、H2O。已知氧化性:NO (H+)>Fe3+。下列叙述不正确的是
(H+)>Fe3+。下列叙述不正确的是| A.该反应说明Fe(NO3)2溶液不宜加酸酸化 | B.该反应中氧化剂与还原剂的个数之比为8:1 |
C.若有1个NO 发生氧化反应,则转移8e- 发生氧化反应,则转移8e- | D.该反应中Fe2+是还原剂,NO 是还原产物 是还原产物 |
您最近一年使用:0次
2023-10-05更新
|
45次组卷
|
2卷引用:安徽省马鞍山市当涂第一中学2022-2023学年高一上学期11月月考化学试题
名校
5 . 水体中氨氮含量会造成水体富营养化,用次氯酸钠除去氨氮的原理如图所示。下列说法错误的是


| A.去除过程中,每一步反应都是氧化还原反应 |
| B.每除去2个NH3,转移6个电子 |
| C.该过程需控制温度,温度过高时氨氮去除率会降低 |
| D.去除过程的总反应方程式为:2NH3+3NaClO=N2+3NaCl+3H2O |
您最近一年使用:0次
2023-10-05更新
|
40次组卷
|
2卷引用:安徽省马鞍山市当涂第一中学2022-2023学年高一上学期11月月考化学试题
名校
解题方法
6 . 在催化剂及酸性介质条件下,H2和O2直接合成过氧化氢的反应机理如图所示。下列说法不正确的是


| A.反应H2和O2的个数之比为1:1 |
| B.O2在催化剂表面得到电子被还原 |
| C.工业采用较低的氢气和氧气体积比(如0.1)主要为了防止爆炸 |
| D.反应后酸性介质中pH显著降低 |
您最近一年使用:0次
2023-10-05更新
|
36次组卷
|
2卷引用:安徽省马鞍山市当涂第一中学2022-2023学年高一上学期11月月考化学试题
7 . 氧化还原反应在高中化学中是一类重要的反应类型。KMnO4、FeCl3是中学化学中常用的氧化剂。回答下列问题:
(1)实验室迅速制备少量气可利用反应: (未配平)。
(未配平)。
①上述反应中被还原的元素为___________ (填元素符号)。
② 与
与 反应生成
反应生成 ,
, 发生
发生___________ 反应(填“氧化”或“还原”)。
③配平以下化学方程式并用双线桥标注电子转移的方向和数目:_________
□KMnO4+□HCl(浓)→□KCl+□MnCl2+□Cl2+□H2O(未配平)
(2)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用 表示。
表示。
①上式中X的化学式为___________ 。
②若有32g铜被氧化,则参与反应的FcCl3的质量为___________ g。
(1)实验室迅速制备少量气可利用反应:
 (未配平)。
(未配平)。①上述反应中被还原的元素为
②
 与
与 反应生成
反应生成 ,
, 发生
发生③配平以下化学方程式并用双线桥标注电子转移的方向和数目:
□KMnO4+□HCl(浓)→□KCl+□MnCl2+□Cl2+□H2O(未配平)
(2)FeCl3溶液能与Cu反应制作印刷电路板。其制作原理可用
 表示。
表示。①上式中X的化学式为
②若有32g铜被氧化,则参与反应的FcCl3的质量为
您最近一年使用:0次
名校
8 . 在催化剂存在的条件下, 、
、 和
和 可发生反应:
可发生反应: 下列说法正确的是
下列说法正确的是
 、
、 和
和 可发生反应:
可发生反应: 下列说法正确的是
下列说法正确的是A. 是反应中的还原剂 是反应中的还原剂 |
B.还原性: |
C.反应中 、 、 元素化合价未发生变化 元素化合价未发生变化 |
D.每消耗1个 ,反应转移12个电子 ,反应转移12个电子 |
您最近一年使用:0次
名校
9 . 已知反应: 。下列结论正确的是
。下列结论正确的是
 。下列结论正确的是
。下列结论正确的是| A.HCl作还原剂,KCl是还原产物 |
| B.氧化性:Cl2>KClO3 |
| C.氧化剂和还原剂的物质的量之比为1:5 |
| D.生成3个Cl2分子,转移6个电子 |
您最近一年使用:0次
名校
10 . 氯气是一种重要的化工原料,可用于制备许多化合物。现用下图装置制取氯气,进行氯气性质探究,并制备其他物质。回答下列问题:

(1)检验A、B装置的气密性:将分液漏斗的活塞和开关K关闭,________ ,则气密性良好。
(2)实验室若用MnO2和浓盐酸制取Cl2,反应的化学方程式为___________ 。
(3)C装置中I处为湿润的石蕊试纸,该处颜色的变化说明氯水具有___________ 性;II处为湿润的淀粉KI试纸,通入Cl2后的现象为___________ ,说明Cl2具有___________ 性。
(4)已知氧化性:Cl2>Fe3+>I2。则1.25amolCl2通入含有1.0amolFeI2溶液中,反应的离子方程式为___________ 。
(5)D装置用于制K2FeO4,高铁酸盐是一种原料价廉、来源广泛的新型强氧化剂,在化工制备、电池材料和水处理等方面具有广泛的应用前景。写出D中发生的主要反应的化学方程式___________ 。高铁酸钠在水中可被还原为Fe3+,则高铁酸钠与氯气的消毒效率(以单位质量得到的电子数表示)之比为___________ 。

(1)检验A、B装置的气密性:将分液漏斗的活塞和开关K关闭,
(2)实验室若用MnO2和浓盐酸制取Cl2,反应的化学方程式为
(3)C装置中I处为湿润的石蕊试纸,该处颜色的变化说明氯水具有
(4)已知氧化性:Cl2>Fe3+>I2。则1.25amolCl2通入含有1.0amolFeI2溶液中,反应的离子方程式为
(5)D装置用于制K2FeO4,高铁酸盐是一种原料价廉、来源广泛的新型强氧化剂,在化工制备、电池材料和水处理等方面具有广泛的应用前景。写出D中发生的主要反应的化学方程式
您最近一年使用:0次



