名校
1 . 大气中 主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将
主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是
 主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将
主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是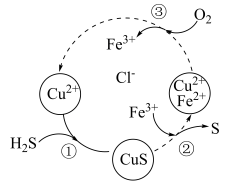
A.过程①中,生成CuS的反应为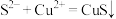 |
B.过程②中, 作还原剂 作还原剂 |
C.过程③中,每消耗1mol  ,转移2mol ,转移2mol  |
D.回收S的总反应为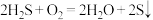 |
您最近一年使用:0次
2024-03-26更新
|
54次组卷
|
2卷引用:安徽省太和中学2023-2024学年高一下学期4月期中考试化学试题
解题方法
2 . 现有以下物质:ⅰ. 、ⅱ.酒精、ⅲ.
、ⅱ.酒精、ⅲ. 、ⅳ.
、ⅳ. 、ⅴ.
、ⅴ. 溶液、ⅵ.食醋、ⅶ.
溶液、ⅵ.食醋、ⅶ. 、ⅷ.
、ⅷ. 、ⅸ.烧碱溶液、ⅹ.液氯。
、ⅸ.烧碱溶液、ⅹ.液氯。
回答下列问题:
(1)以上物质属于电解质的有_______ (填编号,下同),能导电的有_______ 。
(2)写出物质ⅷ的电离方程式:________ 。
(3)物质ⅴ和物质ⅸ混合后发生反应的离子方程式为________ 。
(4)向 物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入
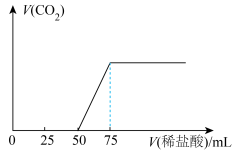
物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是
的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是_______ (填化学式),原 物质ix的浓度为
物质ix的浓度为______ 。
(5)物质ⅳ是一种新型净水剂。制取物质ⅳ时所发生的反应如下: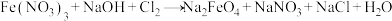
①配平上述反应的化学方程式并用“双线桥”表示电子转移情况:________ 。
②该反应中 是
是________ (填“氧化剂”“还原剂”“氧化产物”或“还原产物”)。
③生成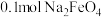 时,转移电子的数自为
时,转移电子的数自为____  (
( 表示阿伏加德罗常数的值),消耗
表示阿伏加德罗常数的值),消耗___ 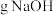 。
。
 、ⅱ.酒精、ⅲ.
、ⅱ.酒精、ⅲ. 、ⅳ.
、ⅳ. 、ⅴ.
、ⅴ. 溶液、ⅵ.食醋、ⅶ.
溶液、ⅵ.食醋、ⅶ. 、ⅷ.
、ⅷ. 、ⅸ.烧碱溶液、ⅹ.液氯。
、ⅸ.烧碱溶液、ⅹ.液氯。回答下列问题:
(1)以上物质属于电解质的有
(2)写出物质ⅷ的电离方程式:
(3)物质ⅴ和物质ⅸ混合后发生反应的离子方程式为
(4)向
 物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入
物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是
的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是 物质ix的浓度为
物质ix的浓度为
(5)物质ⅳ是一种新型净水剂。制取物质ⅳ时所发生的反应如下:
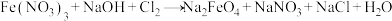
①配平上述反应的化学方程式并用“双线桥”表示电子转移情况:
②该反应中
 是
是③生成
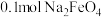 时,转移电子的数自为
时,转移电子的数自为 (
( 表示阿伏加德罗常数的值),消耗
表示阿伏加德罗常数的值),消耗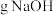 。
。
您最近一年使用:0次
2024-01-30更新
|
58次组卷
|
2卷引用:安徽省阜阳市2023-2024学年高一上学期期末联考化学试卷
3 .  是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过如下反应制得
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过如下反应制得 :
: (未配平)。
(未配平)。 为阿伏加德罗常数的值,下列与该反应有关的说法中错误的是
为阿伏加德罗常数的值,下列与该反应有关的说法中错误的是
 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过如下反应制得
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过如下反应制得 :
: (未配平)。
(未配平)。 为阿伏加德罗常数的值,下列与该反应有关的说法中错误的是
为阿伏加德罗常数的值,下列与该反应有关的说法中错误的是A.氧化剂与还原剂的物质的量之比为 |
B.还原性: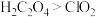 |
C. 作氧化剂发生还原反应 作氧化剂发生还原反应 |
D.若生成标准状况下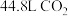 ,则转移电子数目为 ,则转移电子数目为 |
您最近一年使用:0次
2024-01-30更新
|
127次组卷
|
2卷引用:安徽省阜阳市2023-2024学年高一上学期期末联考化学试卷
解题方法
4 . 除了上面的金属钠之外,白风还发现了以前一位学弟留下的实验报告。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为___________ 。
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为___________ 。
(3)若mn = 5,则反应中转移的电子数量最小为___________ 。
(4)若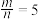 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为___________ 。
(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中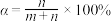 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
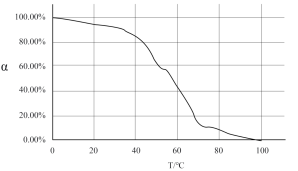
Ⅰ.由图像我们可以得出的结论是:______________________ 。
Ⅱ.试推测为什么图像会有这种趋势:______________________ 。
只是,这实验报告怎么看着这么像数学题……?
“看来这个学弟很喜欢5啊……”
一定条件下将一定量氯气通入KOH溶液中,生成 m mol氯酸钾、n mol次氯酸钾以及其他常见物质。用NA代表阿伏加德罗常数的值:
(1)若m + n = 5,则反应中转移的电子的物质的量最大为
(2)若m - n = 5,则反应中被还原的氯原子和被氧化的氯原子物质的量的比值的最大值为
(3)若mn = 5,则反应中转移的电子数量最小为
(4)若
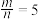 ,则反应中被还原的氯原子和被氧化的氯原子数目之比为
,则反应中被还原的氯原子和被氧化的氯原子数目之比为(5)我们可以用一个转化系数α来近似描述混合液的漂白性,其中
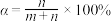 ,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
,白风根据实验报告选用不同的温度测定了对应时刻的α,并绘制出了T-α图像:
Ⅰ.由图像我们可以得出的结论是:
Ⅱ.试推测为什么图像会有这种趋势:
您最近一年使用:0次
名校
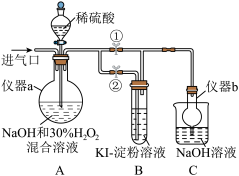
5 . 亚氯酸钠(NaClO2)是一种高效漂白剂,在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某化学兴趣小组探究NaC1O2的制备与性质,装置如图所示。(已知:I2遇淀粉溶液变蓝色)
回答下列问题:
Ⅰ.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应(该反应放出大量的热)。
(1)仪器a的名称为________ ,仪器b的作用是________ 。
(2)装置A中生成NaClO2,反应的离子方程式为_________ 。
(3)实际反应中发现消耗的NaOH比理论值偏少,原因可能是________ 。
Ⅱ.探究亚氯酸钠的性质。
停止通入ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)已知增大反应物浓度、升高温度或加入催化剂等会加快反应的进行。开始时A中反应缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是________ 。
(5)实验过程中,B中酸化的KI淀粉溶液变蓝色,产生该现象的离子方程式为________ 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是_________ 。
(7)NaClO2和Cl2消毒时,还原产物均为Cl-。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算NaClO2的消毒效率是Cl2的______ 倍(计算结果保留一位小数)。

回答下列问题:
Ⅰ.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应(该反应放出大量的热)。
(1)仪器a的名称为
(2)装置A中生成NaClO2,反应的离子方程式为
(3)实际反应中发现消耗的NaOH比理论值偏少,原因可能是
Ⅱ.探究亚氯酸钠的性质。
停止通入ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)已知增大反应物浓度、升高温度或加入催化剂等会加快反应的进行。开始时A中反应缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是
(5)实验过程中,B中酸化的KI淀粉溶液变蓝色,产生该现象的离子方程式为
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是
(7)NaClO2和Cl2消毒时,还原产物均为Cl-。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算NaClO2的消毒效率是Cl2的
您最近一年使用:0次
名校
6 . 氧化还原反应在人类的生产、生活中有着重要的应用。回答下列问题:
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为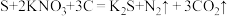 。该反应中,被还原的元素是
。该反应中,被还原的元素是________ (填元素符号),消耗的还原剂和氧化剂质量比为_________ 。
(2)实验室制备Cl2有三种常用方法:
a.
b.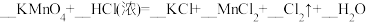
c.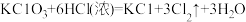
①配平反应b的方程式:___________ 。
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应_____ (填“a”“b”或“c”)。
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:___________ 。
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
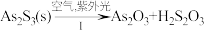 ,
,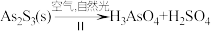 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I______ Ⅱ(填“>”“<”或“=”),转移的电子数之比为_______ 。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为
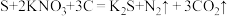 。该反应中,被还原的元素是
。该反应中,被还原的元素是(2)实验室制备Cl2有三种常用方法:
a.

b.
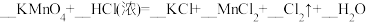
c.
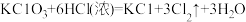
①配平反应b的方程式:
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
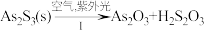 ,
,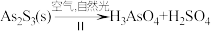 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
您最近一年使用:0次
7 . 高铁酸钾(K2FeO4)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4等。工业上湿法制备K2FeO4的流程如下:
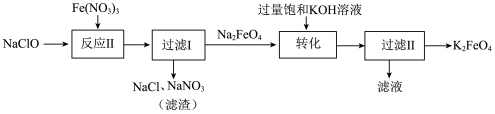
下列说法错误的是

下列说法错误的是
| A.过滤操作需要用到的玻璃仪器有普通漏斗、玻璃棒和烧杯 |
| B.K2FeO4与水反应,每生成1个O2转移4个电子 |
| C.将K2FeO4与盐酸混合使用,会降低其杀菌消毒的效果 |
| D.“反应Ⅰ”中,氧化剂和还原剂的个数之比为2:3 |
您最近一年使用:0次
名校
8 . 下图为氯及其化合物的“价-类”二维图,请按要求填空。
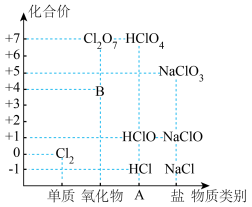
(1)填写二维图中缺失的类别A为___________ ,B的化学式为___________ 。
(2)某同学利用以下试剂研究 的性质,进行以下预测:
的性质,进行以下预测:
从物质类别上看, 属于
属于___________ (填“强”或“弱”)酸,所以可与___________ (填序号)反应,写出其离子反应方程式:___________ 。
a. 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液
溶液
(3)①用 配成的
配成的 溶液,与
溶液,与 恰好完全反应(忽略溶液体积变化),
恰好完全反应(忽略溶液体积变化), 与
与 溶液反应可生成
溶液反应可生成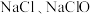 和
和 ,则反应后溶液中
,则反应后溶液中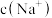 为
为___________  。
。
②我国从2000年起逐步用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,其中氧化产物是
,其中氧化产物是___________ (填化学式)。 的消毒效率是
的消毒效率是 的
的___________ 倍(保留小数点后一位)(还原产物都为 ,消毒效率以单位质量的物质得到的电子数表示)。
,消毒效率以单位质量的物质得到的电子数表示)。

(1)填写二维图中缺失的类别A为
(2)某同学利用以下试剂研究
 的性质,进行以下预测:
的性质,进行以下预测:从物质类别上看,
 属于
属于a.
 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液
溶液(3)①用
 配成的
配成的 溶液,与
溶液,与 恰好完全反应(忽略溶液体积变化),
恰好完全反应(忽略溶液体积变化), 与
与 溶液反应可生成
溶液反应可生成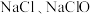 和
和 ,则反应后溶液中
,则反应后溶液中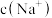 为
为 。
。②我国从2000年起逐步用
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,其中氧化产物是
,其中氧化产物是 的消毒效率是
的消毒效率是 的
的 ,消毒效率以单位质量的物质得到的电子数表示)。
,消毒效率以单位质量的物质得到的电子数表示)。
您最近一年使用:0次
名校
9 . 已知:①向 晶体滴加浓盐酸,产生黄绿色气体;
晶体滴加浓盐酸,产生黄绿色气体;
②向 溶液中通入少量实验①产生的气体,溶液变为黄色;
溶液中通入少量实验①产生的气体,溶液变为黄色;
③取实验②生成的溶液滴在淀粉碘化钾试纸上,产生 ,试纸变蓝。
,试纸变蓝。
下列判断正确的是
 晶体滴加浓盐酸,产生黄绿色气体;
晶体滴加浓盐酸,产生黄绿色气体;②向
 溶液中通入少量实验①产生的气体,溶液变为黄色;
溶液中通入少量实验①产生的气体,溶液变为黄色;③取实验②生成的溶液滴在淀粉碘化钾试纸上,产生
 ,试纸变蓝。
,试纸变蓝。下列判断正确的是
A.上述实验证明还原性: |
B.向 溶液中通入等量的 溶液中通入等量的 ,则转移的电子数为 ,则转移的电子数为 |
C.某溶液中 和 和 共存,为了氧化 共存,为了氧化 而 而 不被氧化,上述物质中可用 不被氧化,上述物质中可用 和 和 |
D.将酸性 溶液和 溶液和 混合观察到有气泡冒出,则证明 混合观察到有气泡冒出,则证明 的氧化性比 的氧化性比 强 强 |
您最近一年使用:0次
名校
10 .  与
与 在不同条件下会发生不同的反应(F在化合物中呈现
在不同条件下会发生不同的反应(F在化合物中呈现 价)。常温条件下,
价)。常温条件下, 与水发生反应①:
与水发生反应①: ;
;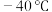 条件下,
条件下, 与冰发生反应②:
与冰发生反应②: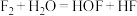 。下列有关上述反应叙述错误的是
。下列有关上述反应叙述错误的是
 与
与 在不同条件下会发生不同的反应(F在化合物中呈现
在不同条件下会发生不同的反应(F在化合物中呈现 价)。常温条件下,
价)。常温条件下, 与水发生反应①:
与水发生反应①: ;
;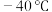 条件下,
条件下, 与冰发生反应②:
与冰发生反应②: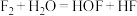 。下列有关上述反应叙述错误的是
。下列有关上述反应叙述错误的是A.反应①和②中 均作氧化剂 均作氧化剂 |
B.反应②中氧化产物是 ,还原产物是 ,还原产物是 |
C.在不同条件下,等量的 与 与 反应转移电子数相同 反应转移电子数相同 |
D.反应①中生成标准状况下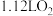 ,转移电子数为 ,转移电子数为 |
您最近一年使用:0次



